基于HPLC法同时测定人血清中4种抗癫痫药物浓度且与CLIA法检测值的一致性评价
2022-09-20史永志韩晓燕牛艺璇鄂尔多斯市中心医院临床药学实验室内蒙古鄂尔多斯07000鄂尔多斯市中心医院重症医学科内蒙古鄂尔多斯07000鄂尔多斯市中心医院医学检验科内蒙古鄂尔多斯07000海口市人民医院中南大学湘雅医学院附属海口医院海南海口57008
赵 娜,史永志,曹 贤,肖 音,韩晓燕,牛艺璇,肖 斌(.鄂尔多斯市中心医院临床药学实验室,内蒙古鄂尔多斯 07000;.鄂尔多斯市中心医院重症医学科,内蒙古 鄂尔多斯 07000;.鄂尔多斯市中心医院医学检验科,内蒙古 鄂尔多斯07000;.海口市人民医院/中南大学湘雅医学院附属海口医院,海南 海口 57008)
癫痫属于慢性神经系统疾病,目前预防癫痫发作的基本手段是药物治疗,目标是在无明显不良反应前提下完全控制癫痫发作[1],大部分癫痫患者需要长期甚至终身服药[2],不少患者需同时服用两种或两种以上抗癫痫药物。传统观念认为治疗效果与药物剂量直接相关,但许多临床实践证明剂量与疗效之间并不完全平行,存在明显的“化学上等价而生物学上不等价”现象。抗癫痫药物体内代谢大多呈非线性药动学特点、药物间相互作用复杂,难以通过药效学指标来确定最佳剂量,因此治疗药物监测(therapeutic drug monitoring,TDM)就显得尤为重要。TDM是将药代动力学原理与血药浓度监测相结合,指导临床合理用药[3-4]。卡马西平(carbamazepine,CBZ)、苯巴比妥(phenobarbital,PB)、苯妥英钠(phenytoin sodium,PHT)、拉莫三嗪(lamotrigine,LTG)是临床中常用的抗癫痫药物,笔者采用高效液相色谱法(high performance liquid chromatography,HPLC)建立同时测定人血清中上述4种药物的浓度方法,旨为临床治疗提供参考。
1 仪器与试药
1.1 仪器
岛津高效液相色谱仪(日本岛津公司)、雅培ARCHITECT i1000sr全自动免疫分析仪(美国雅培公司)、HMS-350小型漩涡振荡器(天津恒奥科技发展有限公司)、TGL-16G离心机(上海安亭科学仪器厂)、 GM-1.0A隔膜真空泵(天津津腾实验设备有限公司)、KQ-500DE数控超声波清洗器(昆山市超声仪器有限公司)、PRACTUM5101-1CN分析天平(德国赛多利斯公司)。
1.2 试药
CBZ对照品(德国Dr.Ehrenstorfer GmhH,批号:CDCT-C10968500,含量:99.5%),PB对照品(中国食品药品检定研究院,批号:171222-201206,含量:99.7%),PHT对照品(中国食品药品检定研究院,批号:100210-201303,含量:99.0%),LTG对照品(加拿大Toronto Research Chemicals lnc,批号:CDDML173250-50mg,含量:98.0%),甲醇(天津市康科德科技有限公司,批号:2019MH007,HPLC色谱纯,含量:99.9%),水为娃哈哈纯净水。
2 方法与结果
2.1 色谱条件与血清样品预处理
色谱柱:Agilent Eclipse Plus C18柱(4.6 mm×250 mm,5 μm),流动相:甲醇-水(44∶56),柱温:37 ℃,检测波长:218 nm,流速:0.9 mL·min-1,进样量:20 μL,全自动进样。精密量取空白血清200 μL,置5 mL离心管,加甲醇600 μL作为蛋白沉淀剂,涡旋振荡2 min,15 000 r·min-1离心10 min,吸取上清液,经孔径0.22 μm有机微孔滤膜过滤2次,取20 μL进样分析。
2.2 试液的制备
2.2.1 对照品储备液的制备精密称取CBZ、PB、PHT和LTG各对照品适量,甲醇溶解并定容至25 mL量瓶,配制成浓度为1.0、5.0、1.0、1.0 mg·mL-1的储备液,分别用移液枪精密移取各对照品储备液适量,用甲醇稀释成标准系列浓度,置– 20 ℃冰箱保存。
2.2.2 标准血样的制备取上述CBZ、PB、PHT和LTG的标准系列浓度储备液,加入适量空白血清,配成CBZ 1.0、2.0、4.0、8.0、16.0、32.0、48.0 μg·mL-1,PB 1.25、2.50、5.00、10.00、20.00、40.00、80.00 μg·mL-1,PHT 1.0、2.0、4.0、8.0、16.0、32.0、48.0 μg·mL-1,LTG 0.63、1.25、2.50、5.00、10.00、20.00、40.00 μg·mL-1的系列浓度混合标准血样。
2.3 患者血样的获取
采集服用此类药物的癫痫患者血清样本,严格控制在药物达到稳态血药浓度后(一般为给药后5 ~ 6个半衰期)[3]的谷浓度时采血,即下一周期给药前。取静脉血2 ~ 3 mL于黄色生化采血管,尽快送检。
2.4 实验方法
2.4.1 化学发光免疫分析法(chemiluminescence immunoassay,CLIA)依据雅培ARCHITECT i1000sr全自动免疫分析仪的标准操作规范测定血药浓度。测定每批次样本时,用质控样品进行平行测定,若质控样本超出标示范围,校正标准曲线,并于当日测定患者血清样本浓度。
2.4.2 HPLC法采用“2.1”项下建立的测定方法学,使用高、中、低浓度质控样本平行测定,测定值RSD< 15%,最低检测限RSD < 20%,以保证同一分析批次测定值准确性,于当日测定患者血清样本浓度。
2.5 结果
2.5.1 专属性实验由图1可知,血清中内源性物质不干扰同时测定CBZ、PB、PHT以及LTG血药浓度。CBZ、PB、PHT、LTG保留时间分别为27.6、10.4、22.4、8.6 min,四者分离度良好。
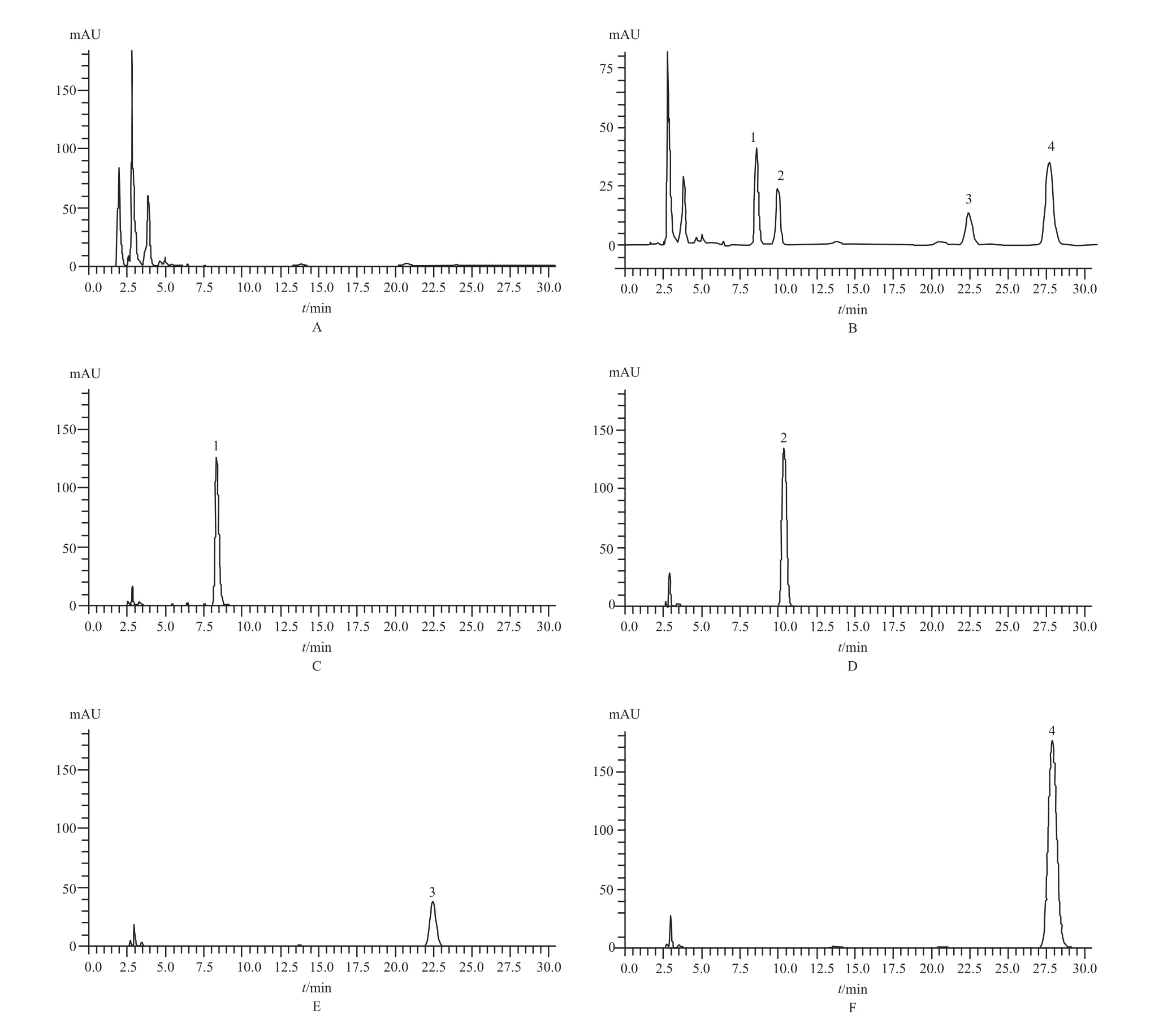
图1 HPLC色谱图A – 空白血清,B – 血清样本,C – LTG对照品,D – PB对照品,E – PHT对照品,F – CBZ对照品;1 – 拉莫三嗪,2 – 苯巴比妥,3 – 苯妥英钠,4 – 卡马西平Fig 1 HPLC chromatogramA – blank serum, B – serum samples, C – LTG reference substance, , D – PB reference substance, E – PHT reference substance, F – CBZ reference substance; 1 – LTG, 2 – PB, 3 – PHT, 4 – CBZ
2.5.2 线性关系及最低检测限分别精密量取CBZ、PB、PHT和LTG对照品系列浓度储备液各20 μL,加入空白血清120 μL,配制成系列标准血样浓度,按照“2.1”项下方法沉淀蛋白,以被监测药物对应的峰面积Y与相应浓度X进行线性回归,见表1。

表1 4种抗癫痫药物线性范围、标准曲线、相关系数和最低检测限Tab 1 Linear range, standard curve, correlation coefficient and minimum detection limit of the 4 antiepileptic drugs
2.5.3 精密度与回收率实验空白血清加入适量系列标准品储备液,制成含4种抗癫痫药物的低、中、高浓度标准血清样本溶液各5份,按“2.1”项下方法处理,所得样本溶液分别连续进样分析;在不同天内分别制备低、中、高5批样本,每个样本连续进样5次并连续进样5 d;分别考察相对回收率及日内、日间精密度。检测结果均符合方法学要求,见表2。

表2 CBZ、PB、PHT、LTG精密度和回收率. n = 5Tab 2 Precision and recovery of CBZ, PB, PHT and LTG. n = 5
2.5.4 稳定性实验分别考察4种抗癫痫药物低、中、高浓度质控样品在不同保存条件下的稳定性。结果表明,质控样品在室温放置0、2、4 h,–4 ℃保存12 h,–20 ℃保存一周并反复冻融3次,含药血清样本稳定性良好。见表3。

表3 CBZ、PB、PHT、LTG稳定性考察Tab 3 Stability investigation of CBZ, PB, PHT and LTG
2.6 临床应用及检测方法对比分析
笔者采集了24例使用CBZ的癫痫患者血清标本,分别采用HPLC法与CLIA法测定,详见表4。使用SPSS 17.0和MedCalc 19.1.3统计软件进行分析。两种方法CBZ测定值经K-S正态性检验均近似正态分布;二者相关系数r= 0.955,经双侧Pearson检验,P< 0.001,差异有统计学意义,可见使用免疫法与色谱法检验的结果高度相关;经F显著性检验,F=228.411,P< 0.001,差异有统计学意义,即此回归方程可建立,回归方程为Y= 1.371 + 0.856X,r= 0.912。
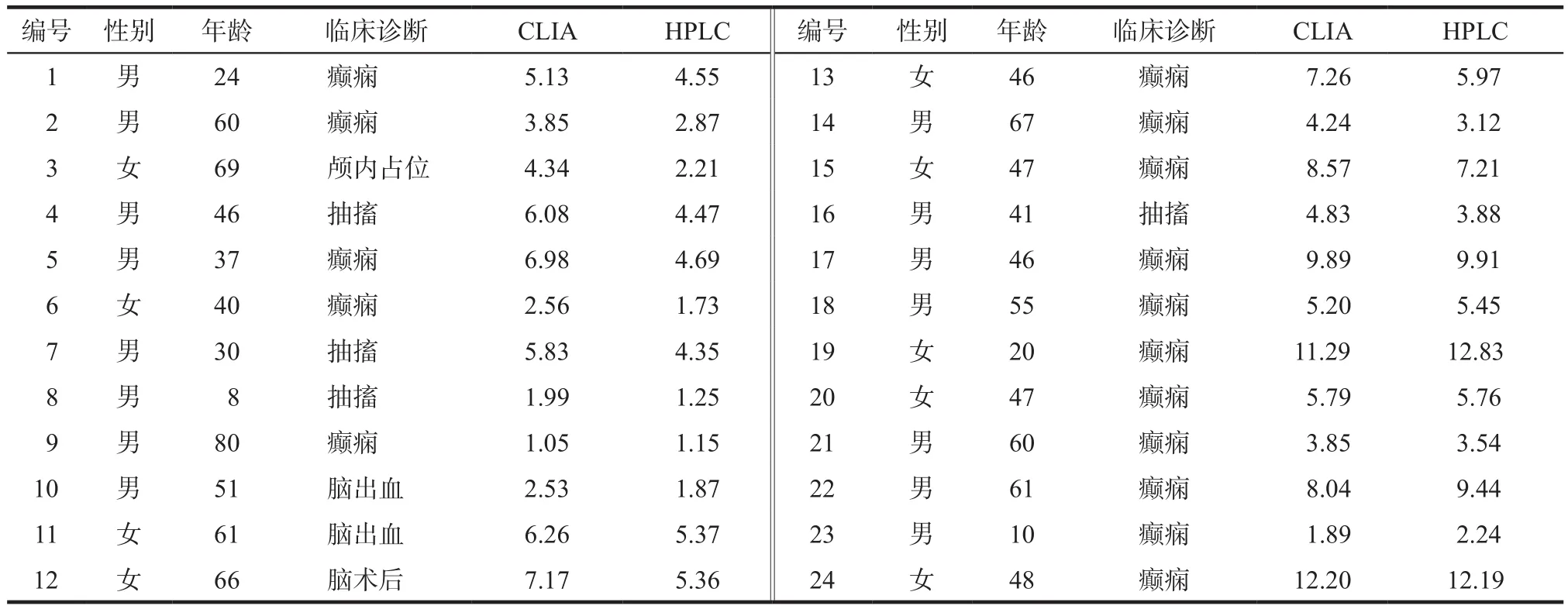
表4 使用CBZ患者的血药浓度分析. mg·L-1Tab 4 Analysis of blood concentration of patients with CBZ. mg·L-1
进一步考察两种方法检测结果差异,首先对所得数据进行配对t检验分析,两种方法测定值间差异有统计学意义(t= 3.216,P< 0.01)。Bland-Altman偏差分析显示,两种方法测定值RE绝大多数为正偏差,平均值0.64%(95%CI:–1.27% ~ 2.56%)。上述结果均说明CLIA法与HPLC法检测值差异有统计学意义,且CLIA法检测值稍高于HPLC法检测值。朱旭等[5]研究荧光偏振免疫(fluorescence polarization immunoassay,FPIA)法检测值显著高于HPLC法,可见CLIA法与HPLC法检测结果较FPIA接近。免疫法检测值高于HPLC法,初步考虑可能由于CBZ的活性代谢产物10,11-环氧卡马西平的化学结构与原药相似,且有着类似的抗原表区,均可发生抗原抗体反应,采用免疫法较难将其完全分开,从而导致检测药物浓度与实际浓度存在一定偏差[5-7]。但由于样本量有限需要在临床上继续收集大量样本进行深入研究。
3 讨论
3.1 抗癫痫药物浓度监测的必要性
目前全球癫痫患者约5000万例,我国癫痫患者约有1000万例,且以每年45万例的速度增长[8]。尽管新型抗癫痫药物不断涌现,但是我国仍有25%患者因未能实施个体化用药指导,导致癫痫控制不理想[9]。CBZ、PB、PHT为传统抗癫痫药物,治疗窗窄且为肝药酶诱导剂,药物代谢易受基因多态性的影响[10],药物间相互作用较复杂,又具有非线性药动学特点,利用药效学指标较难制定个体化用药方案。因此在临床使用中传统抗癫痫药物均应开展TDM[11-13]。LTG属于新型抗癫痫药物,此类药物安全性较传统药物高[14],研究[15-17]表明,虽然LTG安全性较高,但其体内药动学较复杂,且受年龄、性别、体重、合并用药、特殊生理状态及葡萄糖醛酸转移酶影响[18],因此达到有效血药浓度所需剂量个体差异也较大,有必要进行TDM[19-20]。笔者选用HPLC法建立同时监测临床常用传统抗癫痫药物与新型抗癫痫药物浓度的方法学,检测成本较低,且有助于进一步研究药物间相互作用,更深入指导临床合理用药,还可为药物滥用以及药动学研究提供科学思路与依据。
3.2 生物样品预处理技术选择与考察
血药浓度检测中,生物样本预处理常用方法有提取法和蛋白沉淀法。提取法中液-液萃取法应用较多,其优点在于其较强选择性,一定程度上可以保护色谱柱,缺点是容易发生乳化,引起药物损失,而且操作复杂耗时[21]。笔者曾尝试使用二氯甲烷、正己烷等作为提取剂,发现在涡旋振荡时易发生乳化,故最终选用蛋白沉淀法,该方法简便、快速,满足临床血药浓度监测需要[22]。常见的蛋白沉淀剂是乙腈和甲醇。有研究表明当含药的血清或血浆与水性有机溶剂的体积比为1∶(1 ~ 30)时,可以将90%以上蛋白质去除[23],故选用血清:甲醇=1∶3比例,此条件下可去除95%以上蛋白质[23]。样品离心后取上清液经孔径0.22 μm微孔滤膜过滤2次,经验证发现处理后样品干扰较少。
3.3 检测波长及流动相考察
通过查阅2020年版《中华人民共和国药典》发现,在各自适宜条件下,CBZ在238 nm与285 nm波长处有最大吸收;PB吸收波长220 nm;PHT在248 nm波长处存在最大吸收;LTG最大吸收峰在波长(306±2)nm。笔者分别考察了210、215、218、220、240 nm等波长,经比较,在218 nm处内源性物质干扰较小,且LTG信号响应较强,有利于浓度较低的LTG检出。文献[24-25]使用的流动相中均含无机盐或酸,以及梯度洗脱分析,平衡系统和检出后色谱柱冲洗时间较长,干扰因素较多,不利于色谱柱保护,实际操作较繁琐。因此,笔者考察了甲醇-水系统与乙腈-水系统,研究发现二者分离效果相当,乙腈-水系统柱压虽较小,但药物保留时间长于甲醇-水系统,综合考虑各方面因素,笔者选用甲醇-水(44∶56)为流动相。此色谱条件下,上述4种抗癫痫药物可以很好分离,不受血清内源性物质干扰,各药物峰型良好,符合方法学要求。
3.4 HPLC法与免疫法在TDM中的对比分析
当前关于血药浓度监测,HPLC法与免疫法在国内外的医院都得到了广泛的应用。HPLC-MS、UHPLC-MS/MS等应用较多,但由于仪器价格较高,在基层医院具有一定局限性。以往抗癫痫药物浓度监测多针对方法学建立[4],少部分学者建立了监测卡马西平浓度的HPLC法,并与FPIA法进行比较[5,26]。但此类研究仅针对早期FPIA与HPLC法之间的差异,对于CLIA法与HPLC法之间的差异性研究较少。因此笔者建立了同时监测4种抗癫痫药物的方法学,并收集24例使用CBZ的患者血清样本,分别采用HPLC法与CLIA法检测,结果显示CLIA法与HPLC法的检测结果较FPIA接近,CLIA法检测值稍高于HPLC法检测值,但由于样本量较少,需扩充临床样本量进一步验证。
综上,本研究中建立的同时监测4种抗癫痫药物的方法灵敏度、精密度、准确性均较高,操作简便,临床应用成本较低,HPLC法与免疫法各具优缺点,可以根据临床需求以及本单位实际情况选择适宜的方法应用。
