基于网络药理学探讨丹参治疗黄褐斑的作用机制
2022-09-20郝丽娜郝丽莎
郝丽娜,郝丽莎
1.成都青羊菲尔医疗美容诊所,四川成都 610000;
2.西南医科大学附属医院,四川泸州 646000
黄褐斑是一种色素沉着疾病,常见于女性,边界清楚,皮损呈淡褐色或深褐色,对称分布于面部,影响面部美观[1]。近年来研究表明,紫外线暴露、遗传易感性、性激素水平异常与黄褐斑的发病高度相关[2],但具体发病机制尚不明确,可能还有其他致病因素参与[3]。临床治疗黄褐斑的方法很多,但总体疗效不理想。中医学认为肝脾肾三脏与黄褐斑关系密切,其病因在于肝郁、脾湿、肾虚,病机在于气机不畅、气血瘀滞、颜面失养。其中“瘀”是黄褐斑发生的重要因素,治疗中应以活血化瘀为治疗基础,兼顾其他致病之因进行治疗[4-5]。丹参作为活血化瘀、凉血消痈的传统中药,具有改善微循环、扩张血管、抗炎等多种功效[6]。陈之尧等[7]应用1 565 nm非剥脱点阵激光联合丹参注射液行皮内注射治疗黄褐斑患者63例,治疗中起效较快,临床改善明显。李桂玲等[8]应用丹参等具有活血化瘀、祛斑散结的自制中药按摩膏和面膜治疗黄褐斑20例,治疗效果显著,总有效率达70%。目前虽有大量的单味中药或复方中药治疗黄褐斑的研究,但多为经验的总结,缺乏发病和治疗机制上的探讨。因此,本文采用网络药理学及分子对接技术探讨丹参治疗黄褐斑的潜在分子机制,为临床治疗以及丹参药物的研发提供可靠的理论依据。
1 材料与方法
1.1 丹参活性成分及靶点筛选利用中药系统药理学平台TCMSP数据库(http://tcmspw.com/)[9]检索丹参的有效成分,并对有效成分相关靶点进行预测。设置药动学筛选条件:口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18[10],对丹参成分进行初筛,获得活性化合物以及对应的靶标蛋白。应用蛋白质数据库UniProt(http://www.uniprot.org/uploadlists/)将其转换为统一基因名称。
1.2 黄褐斑靶点筛选利用GeneCards数据库(https://www.genecards.org/)和DisGeNet(https://www.disgenet.org/)数据库收集黄褐斑靶点。合并疾病数据库靶点,在UniProt数据库中校正基因信息,经过检索和校对去重后确定黄褐斑的潜在靶点。
1.3 交集靶点蛋白质-蛋白质相互作用(PPI)网络构建为明确丹参靶点与黄褐斑潜在靶点间的相互作用,利用Venny2.1.0网站(https://bioinfogp.cnb.csic.es/tools/venny/)将两者靶点取交集,获得丹参治疗黄褐斑的靶点。将丹参治疗黄褐斑靶点提交至STRING(https://string-db.org/)数据库,限定种属为homo sapiens,构建PPI网络。运用CytoScape 3.8.2分析PPI网络,利用CytoHubba筛选得到排名前4的关键靶点。
1.4 功能与通路的富集分析利用DAVID 6.8(https://david.ncifcrf.gov/)在线分析数据库,对丹参治疗黄褐斑的靶点进行京都基因与基因组百科全书(KEGG)及基因本体(GO)富集分析。将富集结果利用微生信(http://www.bioinformatics.com.cn/)在线工具可视化,制作GO分析结果柱状图和KEGG通路气泡图。
1.5 丹参成分-靶点-通路网络图的构建将丹参活性成分、治疗黄褐斑的靶点、GO富集以及KEGG富集信号通路导入CytoScape3.8.2网络作图软件,构建丹参成分-靶点-通路网络。其中丹参活性成分、靶点、信号通路在网络中以节点(node)表示;各节点之间的相互关系以边(edge)表征。
1.6 丹参治疗黄褐斑关键靶点的分子对接验证运用分子对接技术模拟化合物与靶点的相互作用,对结合模式和结合能力进行预测。从RCSB数据库(https://www.rcsb.org/)中下载PPI网络中的关键靶点蛋白的晶体结构,选择物种为“homo sapiens”,实验方法为“X-RAY DIFFRACTION”,高分子实体类型为“Protein”,选择较低分辨率的蛋白晶体作为对接的模板。从ZINC数据库(http://zinc.docking.org/)中下载筛选出的丹参有效成分3D结构的mol2格式文件。用PyMOL软件移除靶点蛋白中的配体和水分子,保存为pdb格式文件。用AutoDock Tools1.5.6软件对靶点蛋白进行加氢以及电荷计算,对丹参有效成分进行配体设置的预处理,所有配体和受体文件均保存为pdbqt格式。运用AutoDock Vina软件对筛选出的主要靶点进行分子对接,评估和验证化合物-靶标关系的结合亲和力,以及网络药理学的预测结果。使用PyMOL软件对结果进行可视化,显示蛋白质和小分子的3D结构、蛋白质残基和结合键。
2 结果
2.1 丹参活性成分及靶点通过TCMSP获得丹参化学成分及对应的靶标蛋白,并运用UniProt数据库将得到的靶标蛋白转换为基因名。剔除无对应的靶基因信息后,得到58个潜在的活性成分(表1),进一步筛选得到其对应的105个可能靶点。
表1 丹参主要活性成分
2.2黄褐斑靶点从GeneCards数据库获得黄褐斑靶点34个。从DisGeNet数据库中以“chloasma”为关键词获得黄褐斑靶点31个。合并所有黄褐斑靶点后删除重复值,在UniProt数据库校正疾病基因名,最终获得51个黄褐斑靶点。
2.3 交集靶点PPI网络将筛选的丹参成分靶点与黄褐斑靶点取交集,通过Venny2.1.0网站绘制韦恩图,得到丹参成分-黄褐斑共同靶点7个,分别为血管内皮生长因子A(VEGFA)、前列腺素G/H合酶2(PTGS2)、雌激素受体1(ESR1)、雌激素受体2(ESR2)、孕酮受体(PGR)、诱导型一氧化氮合酶2(NOS2)、酪氨酸酶(TYR),见图1A。将靶点提交至STRING平台,选择物种为“homo sapiens”,获得交集靶点的PPI网络互作图(图1B)。应用CytoScape 3.8.2软件中的Cyto-Hubba插件得到按照MCC(Maximal Clique Centrality)分析法,获得排名前4的关键基因(图1C),依次为VEGFA、PTGS2、ESR1、PGR,图中度值越大,则节点就越大,表示该节点越重要。
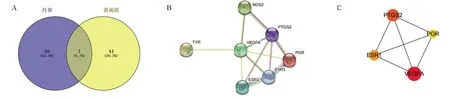
图1 丹参治疗黄褐斑靶点PPI分析
2.4 靶点功能与通路的富集分析将丹参治疗黄褐斑的靶点信息导入David数据库进行GO、KEGG富集分析。设定阈值P<0.05。获得GO注释条目37个,其中包括19个生物过程(biological processes,BP)、2种细胞组分(cell composition,CC)和16种分子功能(molecular function,MF)。按照P值升序排列,绘制GO条目柱状图(图2A)。生物过程富集结果表明基因表达的负调控、RNA聚合酶Ⅱ启动子转录的正调控、血管生成、细胞迁移的正调控、乳腺小泡发育、对维生素D的反应、细胞内雌激素受体信号通路、一氧化氮生物合成过程的正调控、氧化还原过程、类固醇激素介导的信号通路、对雌二醇的反应、炎症反应的调节、RNA聚合酶Ⅱ启动子转录的负调控、缺氧反应、细胞信号转导等生物过程均在丹参治疗黄褐斑过程中发挥着重要作用。核心靶点大多位于细胞核和细胞质。KEGG通路富集分析得到7条信号通路并绘制气泡图(图2B),结果显示丹参可作用于癌症的途径、血管内皮生长因子信号通路、催乳素信号通路、HIF-1信号通路、雌激素信号通路、小细胞肺癌、利什曼病。
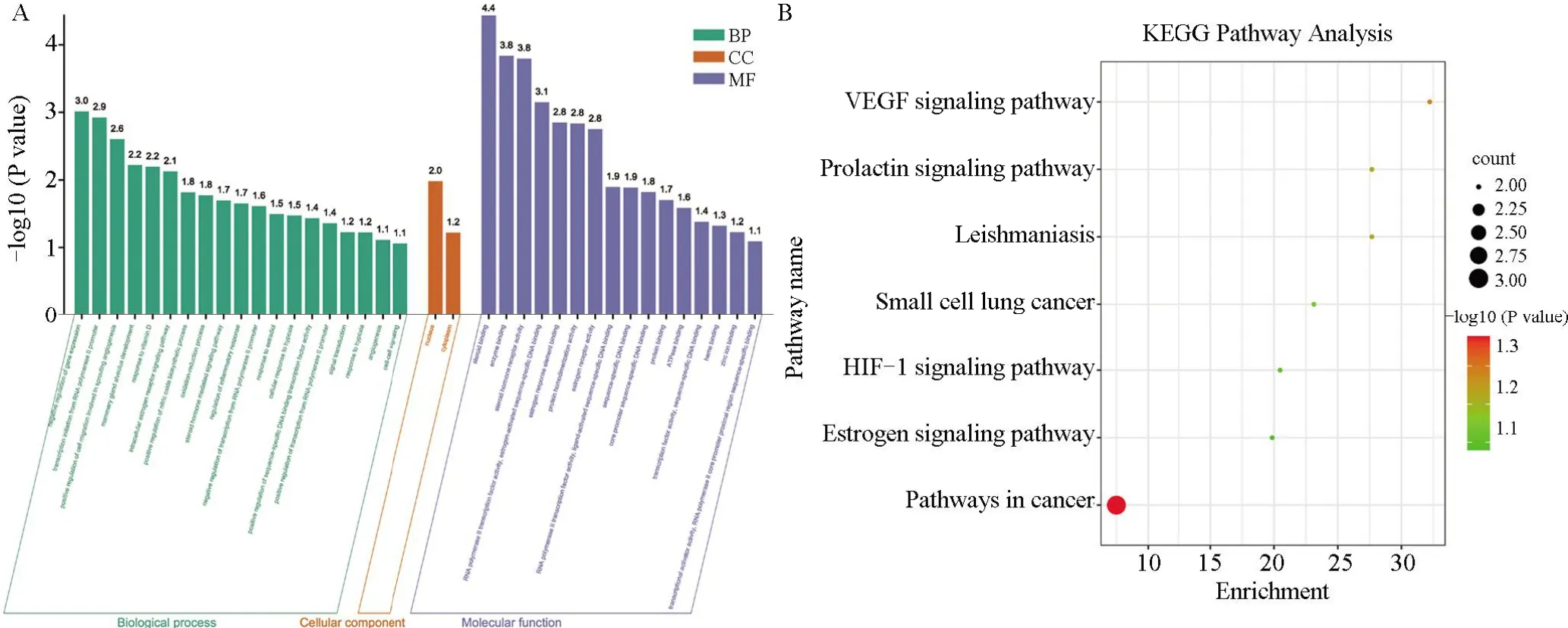
图2 交集靶点GO及KEGG分析结果
2.5 药物-成分-靶点-通路网络以上述得到的丹参有效成分、交集靶基因、GO和KEGG富集通路为基础,利用CytoScape3.8.2网络作图软件,构建药物-成分-靶点-通路网络(图3)。
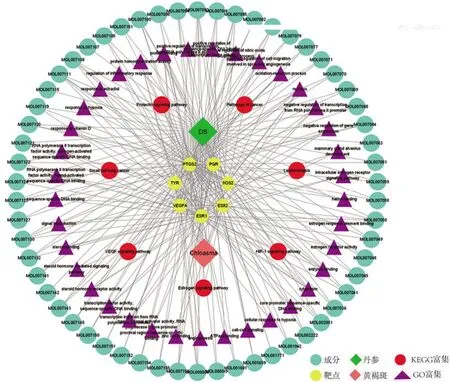
图3 丹参治疗黄褐斑的药物-成分-靶点-通路网络
2.6 分子对接结果分析基于PPI互作网络以及有关文献报道[11],选取与黄褐斑相关经典靶点蛋白4个[血管内皮生长因子A(VEGFA)、前列腺素G/H合酶2(PTGS2)、雌激素受体1(ESR1)、酪氨酸酶(TYR)]进行分子对接(图4~图6)。受体蛋白与活性成分结合所需的能量越少,结合越稳定。本次结果表明,参与分子对接的打分值均为负数(表2),最低结合能均小于-5 kal/mol,活性成分分子与靶点受体蛋白周围分子可通过氢键等分子间作用力形成较为稳定的构象,表明丹参主要活性成分与黄褐斑相关靶点生物亲和力高,具有良好的活性。
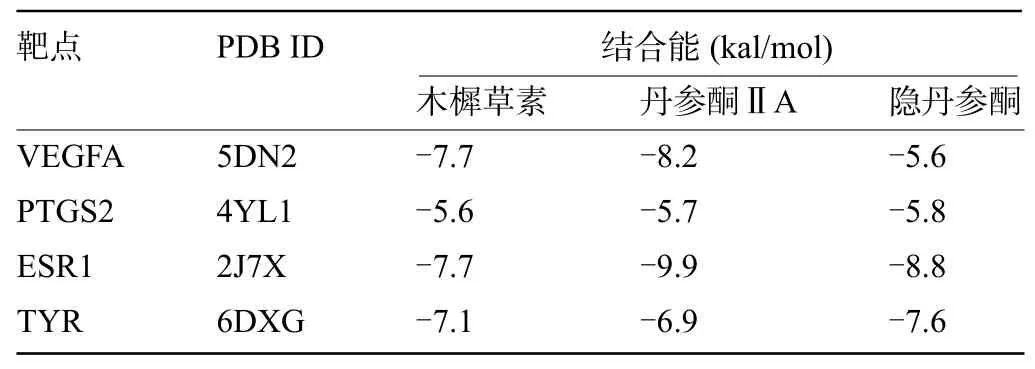
表2 丹参活性成分与靶点蛋白间的最低结合能
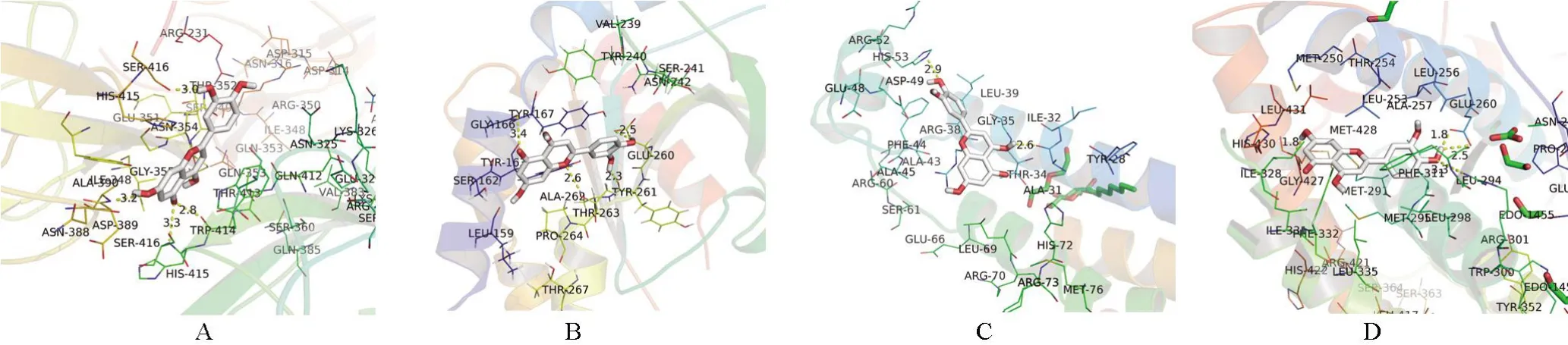
图4 木樨草素(luteolin)与靶点蛋白对接

图5 丹参酮ⅡA(tanshinoneⅡa)与靶点蛋白对接
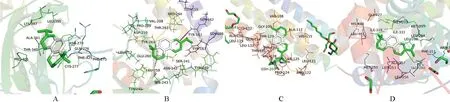
图6 隐丹参酮(cryptotanshinone)与靶点蛋白对接
3 讨论
中医认为,血瘀是黄褐斑形成的重要因素,临床应当确立在活血化瘀的基础上,兼顾其他致病之因进行治疗[4]。丹参是多年生草本植物,以根入药,具有活血化瘀、祛瘀生新等功效[12]。有研究表明,采用丹参治疗黄褐斑效果明显、治疗安全,有利于减轻皮肤氧化应激情况[7,13]。本研究通过网络药理学和分子对接技术,对丹参治疗黄褐斑的作用机制进行分子层面的探讨。
本次采用TCMSP获得丹参化学成分及对应的靶标蛋白,剔除无对应的靶基因信息后,得到58个潜在的活性成分,主要为丹参酮Ⅰ、丹参酮Ⅱa、隐丹参酮、木犀草素等。丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮均属于丹参酮类化合物,具有抑制炎症细胞增殖、清除氧自由基、植物雌激素样作用等[14]。有研究显示,植物雌激素在体内可产生双向调节作用,其调节方向与机体内源性雌激素状态以及雌激素受体的数量和类型相关[15-18]。在体内雌激素水平较低时有拟雌激素作用;当体内雌激素水平较高时有抗雌激素作用[19]。JIAN等[20]和KIM等[21]研究发现,雌激素可通过结合黑素细胞上雌激素受体诱导黑素生成相关酶合成,进而促进黑色素生成。此过程可能通过cAMP-PKA途径,增强cAMP水平,上调环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)、小眼畸形相关转录因子(MITF)和酪氨酸酶家族蛋白的表达来实现[22]。JANG等[16]研究也发现,女性在妊娠期以及口服避孕药后,黄褐斑的发病率会明显升高,而且,在黄褐斑皮损真皮处,雌激素受体-β的表达也增高。以上结果表明,黄褐斑的发病机制与体内较高雌性激素水平及其雌激素受体信号通路密切相关[11]。本次研究也显示,丹参中的丹参酮、丹参新醌、原紫草酸、异隐丹参酮等多种化合物可与黄褐斑的ESR1、ESR2、PGR等核心靶点相结合,作用于细胞内雌激素信号通路、催乳素信号通路,并参与类固醇激素介导以及对雌二醇反应等生物过程。这提示,在较高雌性激素水平的人体内,丹参可能作用于ESR1、ESR2等核心靶点发挥抗雌激素样作用,进而干扰黄褐斑的生成代谢。
酪氨酸酶是黑色素的关键限速酶,其大量生成易导致黄褐斑发生[23-24]。丹参药物中的活性成分木犀草素是一种黄酮类化合物,具有多种药理活性,如消炎、抗过敏、降尿酸、抗肿瘤等[12]。杨城等[25]研究发现,木犀草素能非竞争性抑制酪氨酸酶,作用位点位于酪氨酸酶疏水口袋边缘,相互作用力包括疏水作用力与氢键。刘华等[26]研究也表明,木犀草素能快速与酪氨酸酶发生作用并迅速降低酶的活性,通过显著增强酪氨酸酶的表面疏水性,诱导酪氨酸酶构象伸展和解折叠,使酶结构变化不利于形成活性中心,进而降低酪氨酸酶活力。本次PPI网络和GO富集分析显示,黄褐斑的核心靶点TYR主要位于细胞核和细胞质,可通过VEGFA与ESR1、ESR2等其他核心靶点相互作用,共同参与氧化还原过程、调节炎症反应、缺氧反应、细胞信号转导等生物过程。分子对接显示,木犀草素与TYR可形成稳固结合,最低结合能为-7.1 kal/mol。以上提示,丹参可能通过抑制酪氨酸酶干扰黑色素的生成,进而治疗黄褐斑。
环氧合酶-2(COX-2)可由前列腺素G/H合酶2(PTGS2)基因转录生成,正常情况下,COX-2在多数组织或细胞中不表达或低表达,在受紫外线、脂多糖(LPS)、白细胞介素-l(IL-l)、肿瘤坏死因子(TNF)等多种细胞内外因素刺激后可高水平表达[27]。研究发现,在黄褐斑皮损处,IL-17、COX-2等炎症因子较周围皮肤明显升高,黄褐斑面积及严重程度评分与COX-2呈正相关[28-29]。周凌等[30]研究表明,紫外线可诱导人表皮黑素细 胞 中Cox-2表 达 上 调,激 活Cox-2/Akt/GSK3β/β-Catenin信号通路,促使β-Catenin向核内转移,增加黑素细胞黑色素生成。惠坤等[31]研究也认为,COX-2不仅能影响黑色素的生成,还能调控黑素细胞中树突的形成及延长,影响黑色素的转运和沉着[32]。这提示,黄褐斑的形成与COX-2密切相关,抑制COX-2的表达可能成为治疗黄褐斑的新途径。研究表明,丹参酮ⅡA可降低内皮细胞COX-2 mRNA和蛋白的表达,其机制可能与抑制p38MAPK、NF-κB的磷酸化有关[33]。赵俊云等[34]研究也显示,丹参酮ⅡA可通过抑制转录因子核因子-κB、激活蛋白-1的活性,进而抑制环氧合酶-2的表达,从而抑制乳腺癌细胞的增殖。本次研究表明,丹参中的大部分化合物木犀草素、丹参酮、丹参醇等均能与PTGS2靶点相互作用,主要富集于癌症途径、血管内皮生长因子信号通路、小细胞肺癌、利什曼病等信号通路,参与血管生成、一氧化氮生物合成过程的正向调节、细胞对缺氧反应以及对雌二醇反应等生物过程。以上提示,丹参可能通过多种信号通路共同调节COX-2的表达,进而干扰黑色素的生成,影响黄褐斑代谢。
VEGF是血管生成的主要介质,可促进血管生成,诱导内皮细胞迁移、增殖和侵袭[35-37]。其家族成员有:VEGF-A、VEGF-B、VEGF-C、内分泌腺源性VEGF和胎盘生长因子等[38]。其中,VEGF-A在促进血管生成以及肿瘤发生发展中发挥主导作用[39]。KWON等[40]研究发现,黄褐斑皮损处的血管数目、血管大小以及血管密度均大于病变周围皮肤,VEGF、干细胞因子(SCF)等影响血管生成的细胞因子水平明显升高。本次PPI网络分析也显示,丹参治疗黄褐斑的核心靶点中,VEGFA靶点度值大,颜色红,与其他靶点之间作用关系强。KEGG和GO富集结果显示,VEGFA主要富集于血管内皮生长因子信号通路、癌症途径和HIF-1信号通路,参与血管生成、细胞对缺氧反应等生物过程。这提示,VEGFA可能与黄褐斑的形成过程关系密切。有研究表明,木犀草素能降低VEGF表达,抑制PI3K-Akt-mTOR信号通路,进而抑制A375和B16F10细胞的增殖和侵袭能力,诱导细胞凋亡[41]。张曦倩等[42]研究也显示,木犀草素能有效减少大鼠卵巢中VEGF、VEGFR-2、IL-6的表达,可有效抑制OHSS大鼠卵巢组织的炎症反应及血管通透性。本次分子对接表明,丹参中的木犀草素化合物可与VEGFA形成稳固结合,最低结合能为-7.7 kal/mol。以上提示,丹参可能通过VEGFA靶点,作用于血管内皮生长因子信号通路和HIF-1信号通路,进而影响黄褐斑的生成。
本次分子对接结果显示,丹参活性成分木犀草素、丹参酮ⅡA、隐丹参酮与核心靶点蛋白VEGFA、PTGS2、ESR1、TYR对接良好,构象稳定,最低结合能均小于-5 kal/mol,从而验证了本研究的结果。
综上所述,本文基于网络药理学及分子对接技术,对丹参活性成分、作用靶点、生物过程以及相关通路进行分析,发现丹参治疗黄褐斑具有多成分、多靶点、多途径相互作用的特点,其主要成分及关键靶点可能通过抗雌激素作用、抗炎、抗血管生成、抗酪氨酸酶等方面治疗黄褐斑,其分子机制涉及血管内皮生长因子信号通路、细胞内雌激素信号通路、催乳素信号通路、HIF-1信号传导通路等。这些结果提示,丹参有望成为治疗黄褐斑的临床药物,但因网络药理学研究方法的局限性,后期仍需要进一步的实验验证。
