不同类型金属有机骨架材料合成及载雷公藤红素工艺研究
2022-09-20陈功森林龙飞刘宇灵石国琳杨安辉
陈功森,林龙飞,刘宇灵,石国琳,杨安辉,李 慧, *
不同类型金属有机骨架材料合成及载雷公藤红素工艺研究
陈功森1,林龙飞1,刘宇灵1,石国琳1,杨安辉2, 3,李 慧1, 2, 3*
1. 中国中医科学院中药研究所,北京 100700 2. 中国中医科学院中医药健康产业研究所,江西 南昌 330006 3. 江西中医药健康产业研究院,江西 南昌 330000
不同类型金属有机骨架材料(metal organic frameworks,MOFs)制备工艺优化及筛选,用于负载抗肿瘤单体成分雷公藤红素(celastrol,Cel),从而改善其生物利用度并增强抗肿瘤药效。以粒径大小为指标,单因素考察结合正交试验优化MOFs制备工艺,选择最佳MOFs;吸附法负载雷公藤红素,单因素优化载药工艺,CCK-8法初步评价其抗肿瘤细胞药效。UIO-66最佳工艺为苯甲酸为调节剂,投料比1∶1,溶剂60 mL,溶剂热法反应24 h,粒径(172.3±3.0)nm,多分散指数(polydispersity index,PDI)为0.166±0.023;ZIF-8最佳工艺为投料比1∶50,水10 mL,室温密闭搅拌30 min,粒径(154.0±1.4)nm,PDI为0.245±0.060;MIL-101(Fe)最佳工艺为投料比1∶1,溶剂10 mL,溶剂热法反应24 h,粒径(553.5±36.2)nm,PDI为0.642±0.109;选择ZIF-8进行雷公藤红素的包载,最佳载药工艺为ZIF-8与雷公藤红素比例2∶1,载药时间24 h,药物质量浓度为1 mg/mL,制得ZIF-8@Cel粒径为(164.9±8.0)nm,PDI为0.297±0.029,载药量为(23.47±0.26)%;实验剂量下ZIF-8对HepG2细胞无毒,雷公藤红素处理HepG2细胞24 h的半数致死浓度(half-inhibitory concentration,IC50)为3.821 μg/mL,ZIF-8@Cel的IC50值为3.289 μg/mL(以雷公藤红素含量计)。优选的ZIF-8材料制备及载药工艺稳定可行,粒子形状规则,晶型良好,分布均匀,载药量高,生物安全性好,载药后可明显增强药物药效,为雷公藤红素抗肿瘤纳米制剂的研究提供了基础。
金属有机骨架材料;雷公藤红素;正交试验设计;纳米;载药量;肝癌
雷公藤红素(celastrol,Cel)是从雷公藤根皮中分离得到的五环三萜类活性化合物,分子式为C29H38O4。现代药理研究表明,雷公藤红素具有抗肿瘤、抗炎、抗肥胖、免疫抑制及镇痛等药理活性,杂志将其列为最有可能发展为药物的五种天然产物之一[1-5]。近年来,其抗肿瘤研究逐渐增多,雷公藤红素对前列腺癌、肺癌、肝癌、白血病、结肠癌、卵巢癌、乳腺癌等肿瘤细胞具有明显的抑制作用[6-10]。然而,在生物药剂学分类系统(BCS)中,雷公藤红素属于BCS II类,其难溶于水,溶出慢,生物利用度低及大剂量下的肝肾毒性限制了其临床应用[11-12]。近年来纳米载体的发展为雷公藤红素的应用提供了新方向。An等[13]制备了聚合物胶束用于雷公藤红素的递送以改善其水溶性,延长半衰期。Jin等[14]使用介孔二氧化硅装载雷公藤红素,制得的纳米粒子可改善其溶解度和生物利用度。
传统无机多孔材料如介孔二氧化硅、石墨烯等,其作为药物载体载药量高,但是存在体内不易降解等不足;有机材料如纳米脂质体、胶束等可体内降解完全,但载药量相对较低。金属有机骨架材料(metal organic frameworks,MOFs)作为一类新兴的多孔材料,近年来在药物载体领域发展迅速。其是由金属离子或金属团簇与有机配体通过配位键,辅助以范德华力或氢键等相互作用,自组装形成的一类具有无限周期性网络结构的聚合物材料。MOFs具有种类多样性、孔径可调、可表面修饰及大比表面积等优势,可兼顾载药量与体内可降解性。目前,研究较多的主要有IRMOFs系列(isoreticular metal organic frameworks)、MILs系列(material institute lavoisier frameworks)、ZIFs系列(zeoliticim idazolate frameworks)、PCNs系列(porous coordination networks)、UIOs系列(university of oslo)以及CPLs系列(coordinational pillared layers),见表1。
本研究选择在药物载体领域最常用的3种MOFs:UIO-66、ZIF-8与MIL-101(Fe),以粒径大小为指标,对其制备工艺进行正交优选,并对制备MOFs的晶体性质、形貌特征进行表征。筛选适宜MOFs,考察其对雷公藤红素的载药性能,同时对载药材料对HepG2细胞的细胞药效进行了初步评价,为后续体内外研究提供基础。
1 仪器与材料
Mettler Toledo XP105型电子分析天平,梅特勒-托利多集团;DHG-9030A型鼓风干燥箱,上海一恒科学仪器有限公司;聚四氟乙烯内衬不锈钢反应釜,上海予申仪器有限公司;真空干燥箱,上海一恒科学仪器有限公司;S3400扫描电子显微镜(SEM),日本日立公司;Zetasizer Nano S90马尔文纳米粒径仪,英国马尔文公司;Rigaku UItima IV X射线衍射仪(XRD),日本理学公司;LC-20AT型高效液相色谱仪,日本岛津公司;F7000型荧光光谱仪,日本日立公司。
表1 常见MOFs介绍
Table1 Introduction of several common MOFs
名称出现时间主要发明人金属离子结构代表特点 IRMOFs1999年美国密歇根大学Yaghi课题组二价锌立方体网状MOF-5 (IRMOF-1)比表面积大,孔道结构规则,孔容积较大 MILs[15]2005年法国凡尔赛大学Férey小组三价铬、钒、铝、铁菱形孔道结构MIL-101 (Fe)多级分孔,部分具有呼吸现象 ZIFs[16]2006年美国密歇根大学Yaghi课题组二价锌、钴类沸石三维网络结构ZIF-8具有肿瘤酸效应 PCNs[17]2006年美国德克萨斯A&M大学Zhou课题组二价铜孔笼和三维正交孔道结构PCN-14比表面积大,孔隙率高 UIOs[18]2008年挪威奥斯陆大学Cavka J H小组四价锆三维孔笼结构UIO-66结构稳定 CPLs[19]1999年日本京都大学Kitagawa研究组二价铜层状结构CPL-1具有“开孔”现象
HepG2细胞购买于广州吉妮欧生物科技有限公司;四氯化锆,批号C11495248,质量分数>98%,上海麦克林生化科技有限公司;对苯二甲酸、三氯化铁,分析纯,天津福晨化学试剂有限公司;,-二甲基甲酰胺(DMF),冰醋酸、盐酸、磷酸、六水和硝酸锌,分析纯,国药集团化学试剂有限公司;苯甲酸、二甲基咪唑,分析纯,天津光复科技发展有限公司;雷公藤红素,批号YRL0094201022,质量分数>98%,宝鸡翊瑞生物科技有限公司;DMEM高糖培养基、胎牛血清、青链霉素混合液、CCK8染色液,北京索莱宝科技有限公司;甲醇,色谱纯,赛默飞世尔科技有限公司;水为娃哈哈纯净水。
2 方法与结果
2.1 UIO-66制备工艺考察
2.1.1 溶剂热法合成UIO-66 分别精密称定适量四氯化锆和对苯二甲酸,加入一定体积DMF充分溶解,加适量调节剂。将反应液转移至50 mL聚四氟乙烯内衬的不锈钢反应釜内,在干燥箱内升温至120 ℃,恒温反应,反应结束后取出产物。12 000 r/min离心(离心半径75 mm)5 min,收集,沉淀分别依次用DMF和甲醇洗涤3次,置于真空干燥箱内室温干燥24 h。
2.1.2 调节剂种类单因素考察 比较不同种类调节剂乙酸、盐酸与苯甲酸对UIO-66的影响,其余制备条件一致。使用纳米粒径仪分别测定其粒径分布和多分散指数(polydispersity index,PDI)。表2结果表明,使用苯甲酸作为调节剂时,粒径较小且PDI值小于0.3,表明粒子分布较均匀。
2.1.3 UIO-66制备正交试验考察 以粒径大小为指标,苯甲酸作为调节剂,采用3因素3水平正交实验设计,考察投料比(A)、溶剂量(B)、反应时间(C)对UIO-66粒径大小的影响。正交试验的因素水平、实验设计与结果以及直观分析见表3,方差分析见表4。
表2 UIO-66粒径分布(, n = 3)
Table 2 Particle size distribution of UIO-66 (, n = 3)
调节剂种类粒径/nmPDI 乙酸885.2±23.20.594±0.126 盐酸1 684.0±26.80.312±0.098 苯甲酸240.9±5.70.144±0.022
表3 UIO-66正交试验因素水平、实验设计与结果
Table 3 Factors level, experimental design and result of orthogonal test ofUIO-66
序号AB/mLC/hD (误差)粒径/nm 11∶1 (1)20 (1)12 (1)(1)248.9 21∶1 (1)40 (2)24 (2)(2)221.4 31∶1 (1)60 (3)36 (3)(3)215.1 41∶2 (2)20 (1)24 (2)(3)384.6 51∶2 (2)40 (2)36 (3)(1)286.5 61∶2 (2)60 (3)12 (1)(2)218.4 71∶4 (3)20 (1)36 (3)(2)456.4 81∶4 (3)40 (2)12 (1)(3)893.8 91∶4 (3)60 (3)24 (2)(1)275.2 K1685.41 089.91 361.1810.6 K2889.51 401.7881.2896.2 K31 625.4708.7958.01 493.5 R940.0693.0479.9682.9
表4 UIO-66合成正交试验方差分析结果
Table 4 Analysis results of variance of UIO-66
误差来源离差平方和自由度方差F值P值 A162 978.402 2281 489.201 11.766 30.361 5 B80 309.075 6240 154.537 80.870 40.534 7 C44 299.095 6222 149.547 80.480 10.675 6 D (误差)92 271.895 6246 135.947 8
方差分析结果表明,3因素各水平无显著性差异。由直观分析可知,各因素对实验结果的影响依次为A>B>C,表明投料比对粒径影响较大。因素水平分析(值分析)A为3>2>1,A1粒径最小,即投料比四氯化锆-对苯二甲酸为1∶1;B为2>1>3,B3粒径最小,即溶剂量60 mL;C为1>3>2,C2粒径最小,即反应时间24 h。故UIO-66合成素最佳条件为A1B3C2,即投料比1∶1,溶剂60 mL,反应24 h,此时制得UIO-66粒径最小。对A1B3C2进行3批验证,结果见表5。
3批验证结果表明,UIO-66合成工艺稳定可行,平均粒径为172.3 nm,分散性良好。
2.2 ZIF-8制备工艺考察
2.2.1 室温搅拌法合成ZIF-8 精密称取2-甲基咪唑溶解于一定体积溶剂中,精密称取六水硝酸锌溶解于少量溶剂中。在室温搅拌下,将六水硝酸锌溶液逐滴滴加至2-甲基咪唑溶液中,密闭搅拌一段时间,ZIF-8纳米粒自发形成,得到白色混悬液。12 000 r/min离心(离心半径75 mm)5 min,得到白色沉淀,甲醇洗涤3次,室温下真空干燥。
表5 UIO-66合成最优结果3批验证
Table 5 Verification of UIO-66 synthesis results
试验号粒径/nmPDI 1169.40.176 2172.1 0.140 3175.40.182
2.2.2 溶剂种类比较 ZIF-8合成常用溶剂有水、甲醇、氨水及DMF,其余条件保持一致,比较分别使用4种溶剂制备ZIF-8粒径差异,结果见表6。水为溶剂合成ZIF-8粒径在200 nm左右,甲醇为溶剂合成ZIF-8粒径在600 nm左右,PDI均较低,分散均匀。12%氨水为溶剂合成ZIF-8粒径在250 nm左右,PDI较高,而DMF为溶剂室温下无明显产物出现,推测可能因为DMF常用于溶剂热法合成ZIF-8,室温合成法不适用。经比较,初步选择水作为合成溶剂制备ZIF-8。
表6 ZIF-8粒径分布(, n = 3)
Table 6 Particle size distribution of ZIF-8 (, n = 3)
溶剂粒径/nmPDI 水195.0±6.50.108±0.009 甲醇597.8±12.60.099±0.011 氨水248.5±2.80.384±0.006 DMF−−
2.2.3 ZIF-8合成正交试验考察 以粒径大小为指标,水为合成溶剂,采用3因素3水平正交试验设计,考察投料比(A)、溶剂量(B)、反应时间(C)对ZIF-8粒径大小的影响。因素水平表、实验设计与结果以及直观分析见表7,方差分析见表8。
方差分析结果表明,A因素投料比与B因素溶剂量有显著性差异,C因素反应时间无统计学差异;由直观分析表可知,ZIF-8合成最优工艺为A3B1C2,即投料比1∶50,溶剂10 mL,反应30 min。对A3B1C2进行3批验证,结果见表9。
3批验证结果表明,ZIF-8合成工艺稳定可行,粒径均在154 nm左右,分散性良好。
2.3 MIL-101(Fe)合成正交试验考察
2.3.1 溶剂热法合成MIL-101(Fe) 分别精密称定适量三氯化铁和对苯二甲酸,加入一定体积 DMF充分溶解,加适量调节剂。将反应液转移至50 mL聚四氟乙烯内衬的不锈钢反应釜内,在干燥箱内升温至110 ℃,恒温反应,反应结束后取出产物。12 000 r/min离心(离心半径75 mm)5 min收集,沉淀分别依次用DMF和甲醇洗涤3次,置于真空干燥箱内室温干燥24 h。
表7 ZIF-8正交试验因素水平、实验设计与结果
Table 7 Factors level, experimental design and result of orthogonal test ofZIF-8
序号AB/mLC/minD (误差)粒径/nm 11∶10 (1)10 (1)10 (1)(1)666.2 21∶10 (1)15 (2)30 (2)(2)650.9 31∶10 (1)20 (3)60 (3)(3)737.7 41∶30 (2)10 (1)30 (2)(3)149.3 51∶30 (2)15 (2)60 (3)(1)191.2 61∶30 (2)20 (3)10 (1)(2)271.2 71∶50 (3)10 (1)60 (3)(2)151.7 81∶50 (3)15 (2)10 (1)(3)144.0 91∶50 (3)20 (3)30 (2)(1)177.4 K12 054.8967.21 081.41 034.8 K2611.7986.1977.61 073.8 K3473.11 186.31 080.61 031.0 R1 581.7219.1103.842.8
表8 ZIF-8合成正交试验方差分析结果
Table 8 Analysis results of variance of ZIF-8
误差来源离差平方和自由度方差F值P值 A511 502.495 62255 751.247 81 367.133 80.000 7 B9 826.895 624 913.447 826.265 10.036 7 C2 376.008 921 188.004 46.350 50.136 0 D (误差)374.142 22187.071 1
表9 ZIF-8合成最优结果3批验证
Table 9 Verification of ZIF-8 synthesis results
试验号粒径/nmPDI 1155.30.178 2154.10.296 3152.60.260
2.3.2 MIL-101(Fe)合成正交试验 以粒径大小为指标,采用3因素3水平正交试验设计,考察投料比(A)、溶剂量(B)、反应时间(C)对MIL-101(Fe)粒径大小的影响。因素水平表、实验设计与结果以及直观分析见表10,方差分析见表11。
表10 MIL-101 (Fe) 正交因素水平、实验设计与结果
Table 10 Factors level, experimental design and result of orthogonal test ofMIL-101 (Fe)
序号AB/mLC/minD (误差)粒径/nm 11∶1 (1)10 (1)12 (1)(1)398.1 21∶1 (1)20 (2)24 (2)(2)526.1 31∶1 (1)30 (3)36 (3)(3)497.2 41∶2 (2)10 (1)24 (2)(3)494.3 51∶2 (2)20 (2)36 (3)(1)689.9 61∶2 (2)30 (3)12 (1)(2)933.5 71∶3 (3)10 (1)36 (3)(2)584.8 81∶3 (3)20 (2)12 (1)(3)941.3 91∶3 (3)30 (3)24 (2)(1)609.1 K11 421.41 477.22 272.91 697.1 K22 117.72 157.31 629.52 044.4 K32 135.22 039.81 771.91 932.8 R7 13.8680.1643.4347.3
表11 MIL-101 (Fe) 合成正交试验方差分析结果
Table 11 Analysis results of variance of MIL-101 (Fe)
误差来源离差平方和自由度方差F值P值 A110 516.708 9255 258.354 45.273 10.159 4 B88 095.668 9244 047.834 44.203 30.192 2 C76 138.035 6238 069.017 83.632 80.215 9 D (误差)20 958.482 2210 479.241 1
方差分析结果表明,3因素均无显著性差异;由直观分析表可知,MIL-101(Fe)合成最优工艺为A1B1C2,即投料比1∶1,溶剂10 mL,反应24 h。对A1B1C2进行3批验证,结果见表12。
表12 MIL-101 (Fe) 合成最优结果3批验证
Table 12 Verification of MIL-101(Fe) synthesis results
试验号粒径/nmPDI 1559.00.535 2586.70.753 3514.90.638
3批MIL-101(Fe)粒径均在550 nm左右,工艺较稳定。但粒子PDI均较大,分布不均匀。
2.4 3种MOFs粒子的表征
使用SEM和XRD分别对上述合成的3种MOFs粒子的形貌大小和晶体特征进行表征。
2.4.1 SEM 取粉末样品各微量,甲醇超声分散后,滴1滴于空白玻片表面,室温挥干溶剂,在样品表面喷金2.5 min后,进行SEM观察,记录SEM图谱,观察晶体形貌大小。3种材料的SEM形貌如图1所示。UIO-66粒子呈类球形多面体形状,粒子大小均匀,形状规则;ZIF-8呈六面体形状,分散均匀,粒径较小;MIL-101(Fe)呈八面体形,形状规则,但粒子大小有差异,均匀性较差。

图1 UIO-66 (A)、ZIF-8 (B)、MIL-101 (Fe) (C) 的SEM图
2.4.2 XRD 取样品粉末各10 mg左右,在Cu-Kα(=1.541 nm),高压40 kV,管流40 mA,扫描速度2°/min的条件下进行X射线衍射,得到衍射图谱(图2),测定样品的结晶度和纯度。UIO-66在27.54°、8.70°、25.90°、30.90°等处的衍射峰与文献报道一致[20],且无其他材料衍射峰出现。ZIF-8衍射峰在27.50°、10.54°、12.90°、16.62°及18.20°,均符合文献已报道的ZIF-8衍射峰[21]。MIL-101(Fe)在25.44°、8.70°、9.30°、10.52°及16.68°处均出现明显的吸收峰,与已报道的MIL-101型的标准XRD特征峰一致[22]。
综合上述合成及表征结果,ZIF-8制备简便,粒径小,分布均匀,工艺稳定,较符合药物载体要求选择ZIF-8进行后续载药实验。
2.5 ZIF-8装载雷公藤红素制备纳米粒(ZIF-8@ Cel)的性能研究
2.5.1 ZIF-8装载雷公藤红素工艺 采用吸附法进行载药。将适量ZIF-8粉末置于雷公藤红素甲醇溶液中,室温密闭搅拌一定时间,12 000 r/min离心(离心半径75 mm)5 min,甲醇多次洗涤,室温下真空干燥,即得ZIF-8@Cel载药纳米粒。

图2 UIO-66 (A)、ZIF-8 (B)、MIL-101 (Fe) (C) 的XRD图
2.5.2 载药量测定
(1)雷公藤红素色谱条件:色谱柱为Agilent Zorbax Eclipse plus C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水水溶液(80∶20),等度洗脱;体积流量1.0 mL/min;柱温35 ℃;检测波长244 nm;进样量10 μL。
(2)对照品溶液的制备:精密称取雷公藤红素5 mg于10 mL量瓶中,加甲醇溶解并稀释至刻度,作为储备液。精确量取储备液2 mL于5 mL量瓶中,加甲醇稀释至刻度,即得含雷公藤红素0.2 mg/mL的对照品溶液。
(3)供试品溶液的制备:取ZIF-8@Cel约5 mg,精密称定,加1 mL冰醋酸,加适量甲醇超声处理(功率150 W、频率40 kHz)20 min,定容至10 mL量瓶中,摇匀,即得。
(4)阴性供试品溶液的制备:取空白材料约5 mg,精密称定,按照“2.5.2(2)”项方法制成阴性供试品溶液。
(5)专属性考察:分别吸取对照品溶液、供试品溶液和阴性供试品溶液各1 mL,经微孔滤膜滤过后,按照“2.5.2(1)”项下色谱条件,进高效液相检测,色谱图见图3。
(6)线性关系考察:精密称取雷公藤红素对照品5.0 mg置于10 mL量瓶中,甲醇定容至刻度,配制成质量浓度为0.5 mg/mL的对照品母液。精密吸取母液适量,依次用甲醇稀释,得到质量浓度分别为0.2、0.1、0.05、0.02、0.01、0.005 mg/mL系列对照品溶液。按“2.5.2(1)”项下方法检测,以峰面积为纵坐标(),质量浓度为横坐标(),绘制标准曲线并进行线性回归,得雷公藤红素的回归方程为=12 125 696.90+14 234.01,2=1.000 0,表明雷公藤红素在0.005~0.5 mg/mL线性关系良好。
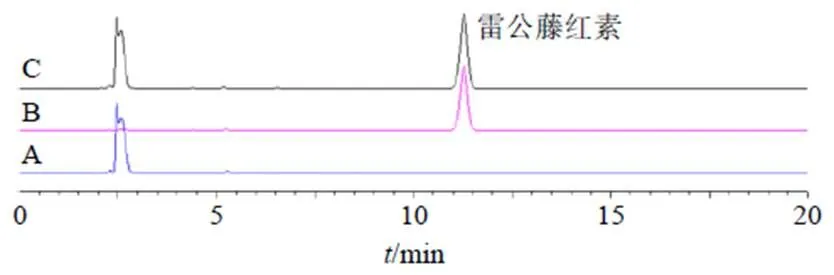
图3 ZIF-8 (A)、雷公藤红素对照品(B) 及ZIF-8@Cel (C) 的HPLC图
(7)检测限与定量限:精确吸取“2.5.2(2)”项中对照品溶液,甲醇稀释,按照“2.5.2(1)”项色谱条件进行测定。样品峰高为仪器噪声高度3倍时的样品质量浓度即为样品的检出限,样品峰高为仪器噪声高度10倍时的样品质量浓度即为样品的定量限。结果显示,雷公藤红素的检测限为0.06 μg/mL,定量限为0.20 μg/mL。
(8)精密度试验:精密吸取质量浓度为0.2 mg/mL的雷公藤红素对照品溶液1 mL,按照“2.5.2(1)”项下色谱条件每天连续进样6次,连续进样3 d,记录峰面积,计算RSD值。结果日内精密度RSD为1.62%,日间精密度RSD为0.32%,表明其精密度良好。
(9)稳定性试验:精密移取ZIF-8@Cel供试品溶液1 mL,按照“2.5.2(1)”项下色谱条件,分别在0、2、4、8、12、24 h进样,记录峰面积,计算RSD值,测得峰面积的RSD值为0.37%,表明供试品溶液在24 h内稳定。
(10)重复性试验:重复制备6份ZIF-8@Cel供试品溶液,分别精密吸取上述供试品溶液各1 mL,按照“2.5.2(1)”项下色谱条件进样测定。结果ZIF-8@Cel样品中雷公藤红素的平均载药量为23.36%,其RSD值为1.15%,表明测定方法的重复性良好。
(11)加样回收率试验:精密称定ZIF-8@Cel样品2.5 mg,加入0.5 mg/mL对照品溶液1 mL,按照“2.5.2(3)”项下方法制备加样回收供试品溶液6份,测得加样回收率为97.77%,RSD小于5%,表明该方法回收率符合要求。
2.5.3 ZIF-8@CEL载药工艺单因素考察
(1)ZIF-8与雷公藤红素质量比考察:根据文献调研及预实验结果,设置ZIF-8与雷公藤红素质量比分别为1∶2、1∶1、2∶1、3∶1,药液质量浓度5 mg/mL,载药时间24 h,比较载药粒子粒径大小及载药量。结果(表13)表明,随着ZIF-8比例的增大,粒径呈减小趋势,变化幅度逐渐减小,比例为2∶1与3∶1粒径接近;载药量随着ZIF-8比例的增大而减小。综合粒径与载药量结果,选择ZIF-8与CEL比例2∶1进行后续实验。
表13 ZIF-8与雷公藤红素质量比单因素考察结果(, n = 3)
Table 13 Results of single factor investigation of the ratio of ZIF-8 to CEL (, n = 3)
ZIF-8与雷公藤红素质量比粒径/nmPDI载药量/% 1∶2451.8±4.50.347±0.02541.32±2.34 1∶1272.6±2.30.296±0.03632.17±2.15 2∶1176.4±2.50.211±0.01924.58±1.98 3∶1174.0±1.90.205±0.02620.65±1.69
(2)载药时间考察:载药时间的长短也对载药行为影响较大。暂定ZIF-8与CEL比例2∶1,药液质量浓度5 mg/mL,设置载药时间24、12、6 h进行考察。结果(表14)表明,时间越短粒子粒径越小,载药量越低,最终确定载药时间24 h。
(3)药液质量浓度考察:固定ZIF-8与CEL比例2∶1,载药时间24 h,比较药液质量浓度1、2、5、10、20 mg/mL的影响。结果(表15)表明,药物质量浓度为1 mg/mL时,粒径相对较小,同时载药量较高。
综合上述单因素结果,确定最佳载药工艺为ZIF-8与CEL质量比2∶1,载药时间24 h,药物质量浓度为1 mg/mL。进行3批最佳工艺验证,结果ZIF-8@CEL的平均粒径为(164.9±8.0)nm,PDI为0.297±0.029,载药量为(23.47±0.26)%,工艺稳定可行。
表14 载药时间单因素考察结果(, n = 3)
Table 14 Results of single factor investigation of drug loading time (, n = 3)
t/h粒径/nmPDI载药量/% 24176.4±2.50.211±0.01924.58±1.98 12162.5±1.60.288±0.05520.59±1.56 6162.3±1.50.255±0.04615.31±1.45
表15 药物质量浓度单因素考察结果(, n = 3)
Table 15 Results of single factor investigation of drug concentration (, n = 3)
质量浓度/(mg∙mL−1)粒径/nmPDI载药量/% 1162.9±2.40.296±0.03423.82±1.88 2188.3±2.70.355±0.05921.09±1.98 5179.1±3.50.308±0.04522.72±1.66 10189.2±4.60.351±0.05622.19±1.75 20174.5±1.90.276±0.02922.01±1.77
2.6 细胞水平药效评价
HepG2细胞在含有10%胎牛血清和抗生素(100 µg/mL青霉素和100 µg/mL链霉素)的DMEM高糖培养基中,在37 ℃、5% CO2下培养2~3 d。
在比较游离CEL和ZIF-8@CEL的细胞毒性作用之前,采用CCK-8法检测空白ZIF-8对HepG2细胞的体外细胞毒性。当细胞覆盖培养瓶底部的80%以上面积时,用胰蛋白酶消化收集细胞,并在新鲜培养基中重悬。细胞接种于96孔板,接种密度为100 μL/孔,接种数量为6000个/孔,培养过夜。然后用不同质量浓度的ZIF-8处理细胞24 h,弃上清液,每孔加入含10% CCK-8的100 μL培养基溶液,37 ℃避光孵育3 h。用酶标仪测定了在450 nm波长处的吸光度()值。根据表16,不同质量浓度的ZIF-8(0、10、20、30、40 μg/mL)孵育24 h后,细胞存活率无显著降低,说明ZIF-8在实验剂量下是无毒的。接着,CCK-8法比较了游离雷公藤红素和ZIF- 8@CEL对HepG2细胞的毒性。结果(表17)显示随着质量浓度升高,细胞存活率逐渐降低,具有明显质量浓度相关性。雷公藤红素的半数致死浓度(half-inhibitory concentration,IC50)值为3.821 μg/mL,ZIF-8@CEL的IC50值为3.289 μg/mL(以雷公藤红素计)。含相同质量浓度雷公藤红素条件下,ZIF-8@CEL对HepG2细胞抑制效果更强,IC50值更小。
3 讨论
MOFs结合了有机材料的可降解性及无机材料的高载药量的优势。其是由金属配位键、范德华力等作用力结合,其相对较弱的结合力会在体内被逐渐解离,变为小分子有机物及金属离子,小分子可直接被代谢,金属离子为体内存在的锌、铁等离子,可被吸收代谢,具有良好的安全性[23]。Baati等[24]制备了MIL88B、MIL88A及MIL100等多种铁基MOFs,并静脉注射到大鼠体内,发现其在体内会被肝脏和脾脏分解成铁离子和有机配体,并通过尿液和粪便排除,基本不存在代谢毒性。
表16 不同质量浓度ZIF-8作用24 h后HepG2细胞的存活率(, n = 4)
Table 16 Survival rate of HepG2 cells after different concentrations of ZIF-8 for 24 h (, n = 4)
质量浓度/(μg∙mL−1)细胞存活率/% 0100.00±0.00 10101.87±4.14 20103.13±5.00 30105.44±3.16 40105.88±4.41
表17 雷公藤红素与ZIF-8@CEL对HepG2细胞毒性CCK8结果(, n = 4)
Table 17 CCK8 results of CEL and ZIF-8@CEL on HepG2 cytotoxicity (, n = 4)
质量浓度/(μg∙mL−1)(以雷公藤红素计)细胞存活率/% 雷公藤红素ZIF-8@Cel 空白对照100.00±0.00100.00±0.00 0.592.03±4.45*89.70±5.30* 172.13±3.65*77.04±1.91* 242.04±3.98*46.09±2.76* 436.72±3.53*40.02±3.89* 819.12±2.16*25.92±2.56*
与空白对照比较:*<0.05
*< 0.05control group
本实验选择的3类MOFs分别属于UIOs系列、ZIFs系列与MILs系列。文献研究表明,这3类MOFs在生物医药领域的应用较多。UIO-66、ZIF-8与MIL-101(Fe)分别为3类MOFs中的代表,其金属中心依次为四价锆、二价锌及三价铁,包括了不同金属类型及价位,且3类材料具有不同的晶体结构,具有良好的代表性。目前,这3种MOFs作为药物载体的研究受到较多关注[25-26]。Haddad等[27]使用UIO-66负载抗肿瘤药物二氯乙酸,同时修饰了定位于线粒体的三苯基膦,具有良好的抗肿瘤效果和靶向性。Zhang等[28]使用ZIF-8负载抗肿瘤前药,进一步使用透明质酸功能化修饰,制备的纳米粒子具有良好的抗肿瘤效果。Cai等[29]将叶酸和5-羧酸荧光素用于修饰MIL-101(Fe)以构建功能化纳米平台,同时递送抗肿瘤药物雷公藤甲素,具有优异的荧光成像和协同靶向抗癌活性。本实验通过单因素考察结合正交试验分别对3类MOFs的合成工艺进行了优化,得到最佳制备工艺。经比较,ZIF-8粒径在154 nm左右,形状规则,晶型良好,分布均匀,适宜作为药物载体用于后续实验。
对于CEL的包载,常用方法有“一步法”与吸附法。“一步法”为药物与合成原料同时加入,在材料合成的同时,将药物分子包裹在材料孔隙内;吸附法为先合成空白材料,再将材料置于一定质量浓度药液中密闭搅拌一定时间,依靠材料吸附性进行药物装载。前期预试验发现,“一步法”制备的载药粒子载药量均较低,增加药物浓度以提高载药量的同时,粒径也急剧增大,载药量5%左右时粒径接近900 nm。经分析可能是由于雷公藤红素中含有羧基基团,其在二甲基咪唑形成的碱性溶液里与金属离子配位结合产生络合物,导致形成的ZIF-8金属中心数量少,粒子粒径大,同时载药量较低。因此最终采用吸附法进行载药,通过单因素试验,考察影响吸附法载药的3个因素载体药物比、载药时间与药物浓度,最终确定载药工艺为ZIF-8与雷公藤红素比例2∶1,载药时间24 h,药物质量浓度为1 mg/mL,得到ZIF-8@CEL粒径为165 nm左右,分散均匀,载药量约23%,工艺稳定可行。
最后,CCK-8细胞毒性试验评价了ZIF-8、CEL及ZIF-8@CEL对HepG2细胞的抑制作用,结果表明ZIF-8在实验剂量下安全性良好,ZIF-8@CEL相较于雷公藤红素抑制效果更强,IC50值更小。后续细胞毒性机制及体内抗肿瘤试验将进一步验证纳米载体的优势。
利益冲突 所有作者均声明不存在利益冲突
[1] Kashyap D, Sharma A, Tuli H S,. Molecular targets of celastrol in cancer: Recent trends and advancements [J]., 2018, 128: 70-81.
[2] You D, Jeong Y, Yoon S Y,. Celastrol attenuates the inflammatory response by inhibiting IL‑1β expression in triple‑negative breast cancer cells [J]., 2021, 45(6): 89.
[3] Abdelmoneem M A, Abd Elwakil M M, Khattab S N,. Lactoferrin-dual drug nanoconjugate: Synergistic anti- tumor efficacy of docetaxel and the NF-κB inhibitor celastrol [J]., 2021, 118: 111422.
[4] 梁柳春, 杨亚玺, 郭夫江. 雷公藤红素药理作用及结构修饰研究进展 [J]. 中国药物化学杂志, 2020, 30(10): 622-635.
[5] Sanna V, Chamcheu J C, Pala N,. Nanoencapsulation of natural triterpenoid celastrol for prostate cancer treatment [J]., 2015, 10: 6835-6846.
[6] 林凯莉, 邓秋狄, 雷雪萍. 雷公藤红素抑制非小细胞肺癌迁移和侵袭的作用及其分子机制研究 [J]. 上海中医药大学学报, 2022, 36(2): 43-48.
[7] 徐佳, 伍春莲. 雷公藤红素抑制食管癌细胞转移及其机制[J]. 生理学报, 2015, 67(3): 341-347.
[8] Lim H Y, Ong P S, Wang L Z,. Celastrol in cancer therapy: Recent developments, challenges and prospects [J]., 2021, 521: 252-267.
[9] Zhang R, Chen Z, Wu S S,. Celastrol enhances the anti-liver cancer activity of sorafenib [J]., 2019, 25: 4068-4075.
[10] 李忠孝, 金百冶. 荷载雷公藤红素的甘氨脱氧胆酸钠/DSPE-mPEG 2000仿生混合胶束体内外抗前列腺肿瘤研究 [J]. 中药材, 2018, 41(6): 1423-1429.
[11] Guo Z H, Shi L Q, Feng H Y,. Reduction-sensitive nanomicelles: Delivery celastrol for retinoblastoma cells effective apoptosis [J]., 2021, 32(3): 1046-1050.
[12] Shi J F, Li J X, Xu Z Y,. Celastrol: A review of useful strategies overcoming its limitation in anticancer application [J]., 2020, 11: 558741.
[13] An L M, Li Z R, Shi L Q,. Inflammation-targeted celastrol nanodrug attenuates collagen-induced arthritis through NF-κB and Notch1 pathways [J]., 2020, 20(10): 7728-7736.
[14] Jin T, Wu D, Liu X M,. Intra-articular delivery of celastrol by hollow mesoporous silica nanoparticles for pH-sensitive anti-inflammatory therapy against knee osteoarthritis [J]., 2020, 18(1): 94.
[15] Férey G, Mellot-Draznieks C, Serre C,. A chromium terephthalate-based solid with unusually large pore volumes and surface area [J]., 2005, 309(5743): 2040-2042.
[16] Park K S, Ni Z, Côté A P,. Exceptional chemical and thermal stability of zeolitic imidazolate frameworks [J]., 2006, 103(27): 10186-10191.
[17] Ma S Q, Zhou H C. A metal-organic framework with entatic metal centers exhibiting high gas adsorption affinity [J]., 2006, 128(36): 11734-11735.
[18] Cavka J H, Jakobsen S, Olsbye U,. A new zirconium inorganic building brick forming metal organic frameworks with exceptional stability [J]., 2008, 130(42): 13850-13851.
[19] Kondo M, Okubo T, Asami A,. Rational synthesis of stable channel-like cavities with methane gas adsorption properties: [{Cu2(pzdc)2(L)}] (pzdc=pyrazine-2,3- dicarboxylate; L=a pillar ligand) [J]., 1999, 38(1/2): 140-143.
[20] 罗小莉, 朱陈斌, 蓝丹, 等.金属-有机多孔材料UiO-66负载黄酮苷类药物负载率的研究 [J]. 化学研究与应用, 2021, 33(7): 1266-1271.
[21] 何江, 高飞, 张峰,等. ZIF-8负载柠檬酸包覆纳米零价铁复合物的制备及其对U(VI)的吸附性能研究 [J]. 核技术, 2021, 44(4): 37-46.
[22] 蒋实, 黄芳, 林晓宇,等. MIL-101(Fe)对草甘膦的吸附行为研究 [J]. 武汉科技大学学报, 2019, 42(2): 121-128.
[23] Kumar P, Anand B, Tsang Y F,. Regeneration, degradation, and toxicity effect of MOFs: Opportunities and challenges [J]., 2019, 176: 108488.
[24] Baati T, Njim L, Neffati F,. In depth analysis of thetoxicity of nanoparticles of porous iron (III) metal- organic frameworks [J]., 2013, 4(4): 1597.
[25] Wu M X, Yang Y W. Metal-organic framework (MOF)- based drug/cargo delivery and cancer therapy [J]., 2017, 29(23): 1606134.
[26] Banerjee S, Lollar C T, Xiao Z F,. Biomedical integration of metal-organic frameworks [J]., 2020, 2(5): 467-479.
[27] Haddad S, Abánades Lázaro I, Fantham M,. Design of a functionalized metal-organic framework system for enhanced targeted delivery to mitochondria [J]., 2020, 142(14): 6661-6674.
[28] Zhang H Y, Li Q, Liu R L,. A versatile prodrug strategy toencapsulate drugs in MOF nanocarriers: A case of cytarabine-IR820 prodrug encapsulated ZIF-8 toward chemo-photothermal therapy [J]., 2018, 28(35): 1802830.
[29] Cai M, Zeng Y, Liu M,. Construction of a multifunctional nano-scale metal-organic framework- based drug delivery system for targeted cancer therapy [J]., 2021, 13(11): 1945.
Study on synthesis of different types of metal organic frameworks and technology of celastrol loading
CHEN Gong-sen1, LIN Long-fei1, LIU Yu-ling1, SHI Guo-lin1, YANG An-hui2, 3, LI Hui1, 2, 3
1. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China 2. Institute of Traditional Chinese Medicine Health Industry, China Academy of Chinese Medical Sciences, Nanchang 330006, China 3. Jiangxi Health Industry Institute of Traditional Chinese Medicine, Nanchang 330000, China
The preparation process optimization and screening of different types of metal organic frameworks (MOFs), which are used to load the antitumor monomer celastrol (Cel), so as to improve its bioavailability and enhance the antitumor efficacy.Taking the particle size as the index, the preparation process of MOFs was optimized by single factor investigation and orthogonal test, and then the best MOFs was selected. Celastrol was loaded by adsorption method, and the drug loading process was optimized by single factor experiment. The anti-tumor effect was preliminarily evaluated by CCK-8 method.The optimum process of UIO-66 is as follows: benzoic acid as regulator, feed ratio 1:1, solvent 60 mL, solvothermal reaction for 24 h, particle size (172.3 ± 3.0) nm, PDI 0.166 ± 0.023. The optimum process of ZIF-8 is as follows: feed ratio 1:50, water 10 mL, airtight stirring at room temperature for 30 min, particle size (154.0 ± 1.4) nm and PDI 0.245 ± 0.060. The optimum process of MIL-101(Fe) is as follows: the feed ratio is 1:1, the solvent is 10 mL, the solvothermal reaction is 24 h, the particle size is (553.5 ± 36.2) nm, and the PDI is 0.642 ± 0.109. ZIF-8 was selected for the encapsulation of celastrol. The optimal drug loading process was that the ratio of ZIF-8 to celastrol was 2:1, the drug loading time was 24 h, and the drug concentration was 1 mg/mL. The particle size of ZIF-8@Cel was (164.9 ± 8.0) nm, the PDI was 0.297 ± 0.029, and the drug loading was (23.47 ± 0.26)%. ZIF-8 was non-toxic to HepG2 cells at the experimental dose. The IC50value of HepG2 cells treated with celastrol for 24 h was 3.821 μg/mL, and the IC50value of ZIF-8@Cel was 3.289 μg/mL (calculated by celastrol content).The optimized ZIF-8 material has stable and feasible preparation and drug loading process, regular particle shape, good crystal form, uniform distribution, high drug loading and good biosafety. ZIF-8@Cel can significantly enhance the drug cell efficacy, which provides a basis for the research of celastrol antitumor nano preparation.
metal organic frameworks; celastrol; orthogonal experimental design; nanometer; drug loading; liver cancer
R283.6
A
0253 - 2670(2022)18 - 5673 - 09
10.7501/j.issn.0253-2670.2022.18.010
2022-04-02
中央级公益性科研院所基本科研业务费专项资金资助(ZXKT21012);中央级公益性科研院所基本科研业务费专项资金资助(ZZ13- 035-08);中央级公益性科研院所基本科研业务费专项资金资助(CI2021A04301);中央级公益性科研院所基本科研业务费专项资金资助(ZZ13-YQ-059)
陈功森,博士研究生,研究方向为中药新制剂与新剂型。E-mail: gongsenchen@163.com
李 慧,研究员,博士生导师,主要从事中药新剂型与新药开发研究。E-mail: lihuiyiren@163.com
[责任编辑 郑礼胜]
