脂肪甘油三酯脂肪酶在头颈部鳞状细胞癌中的表达及相关分子机制▲
2022-09-18言柯柯李丽媚周晓莹
肖 雪 言柯柯 李丽媚 赵 军 张 哲 周晓莹
(广西医科大学第一附属医院1 耳鼻咽喉头颈外科,2 放疗科,广西南宁市 530021; 3 广西医科大学口腔医学院-附属口腔医院儿童口腔科,广西南宁市 530021; 4 广西医科大学生命科学研究院,广西南宁市 530021)
GLOBOCAN2020数据显示,头颈部肿瘤是世界上第七高发的恶性肿瘤,2020年全球新发病例超过90万[1]。头颈部鳞状细胞癌(简称为头颈鳞癌)是发生于口腔、口咽、下咽、喉、鼻窦、唾液腺等解剖位置的恶性肿瘤,约占头颈部肿瘤的90%。由于头颈鳞癌的临床症状不典型,许多病例初诊时就已经处于晚期(Ⅲ期或Ⅳ期)。尽管在过去的二三十年间肿瘤治疗手段飞速发展,但是头颈鳞癌患者的治疗效果仍不佳。如何寻找有效的诊断及预后评估的标记物,是当今头颈鳞癌研究的热点。
头颈鳞癌的发病危险因素有很多,包括经典的危险因素如吸烟、饮酒,以及近年来备受关注的人乳头状瘤病毒(human papilloma virus,HPV)[2]。HPV相关性头颈鳞癌约占所有头颈鳞癌的25%,这类患者以青壮年人群为主,治疗效果通常较好,预后也好于HPV阴性患者[3],但具体的原因和机制尚未完全阐明。
脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL),又称含Patatin样磷脂酶结构域蛋白3,是脂肪分解过程中的限速酶[4]。在前期研究中,我们发现鼻咽癌细胞通过表观遗传沉默UbcH8后下调ATGL的表达,导致脂滴堆积从而维持其恶性表型[5]。我们还报告了EB病毒编码的潜伏膜蛋白2A通过影响ATGL的表达从而抑制鼻咽癌细胞的恶性生物学行为[6]。但是ATGL在头颈鳞癌中的表达及作用尚未见研究报告。因此,本研究分析ATGL在头颈鳞癌中的表达及与肿瘤预后的关系,并基于肿瘤免疫和表观遗传探讨相关分子机制,以及HPV感染通过调控ATGL表达对头颈鳞癌免疫微环境的影响。
1 资料与方法
1.1 ATGL在头颈鳞癌中转录水平和蛋白表达水平的分析 首先,通过UALCAN数据库(http://ualcan.path.uab.edu/index.html)对ATGL在头颈鳞癌中的转录水平和蛋白表达水平进行分析[7],其中转录水平分析纳入520例头颈鳞癌组织和44例头颈部非癌组织,蛋白表达水平分析纳入108例头颈鳞癌组织和71例头颈部非癌组织。另外,UALCAN数据库提供以“HPV感染状态”为分层因素的分析,因此本研究纳入80例HPV阳性和434例HPV阴性的头颈鳞癌组织,联合44例非癌组织,进行ATGL的转录水平分析。
随后,通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)检索ATGL微阵列数据集,纳入标准为:(1)包含肿瘤和非肿瘤分组;(2)肿瘤组为根据WHO标准[8]确诊为头颈鳞癌的患者;(3)每组病例数>3例;(4)可获得ATGL的数据。对入选的微阵列进行Meta分析以验证ATGL在头颈鳞癌中的转录水平。使用SPSS 22.0软件进行相关统计学分析,使用漏斗图和Begg′s检验进行发表偏倚评价,使用Cochran′sQ检验进行异质性分析,当P<0.05、I2>50%时被认为有异质性,此时使用随机效应模型进行分析。通过绘制森林图分析ATGL在头颈鳞癌中的表达情况,通过绘制漏斗图并进行Begg′s检验以评价和检验发表偏倚。以P<0.05视为差异具有统计学意义。
1.2 ATGL表达与头颈鳞癌分级和预后的关系 通过UALCAN数据库分析ATGL蛋白表达与头颈鳞癌肿瘤分级的关系。根据Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/index.php?p=background)绘制不同肿瘤分期(Ⅲ、Ⅵ期)头颈鳞癌患者和整体头颈鳞癌患者的生存曲线[9],分析ATGL基因表达与生存情况的关系。
1.3 ATGL在头颈鳞癌中的DNA甲基化水平分析 通过MethSurv(https://biit.cs.ut.ee/methsurv/)分析ATGL CpG岛在头颈鳞癌中的甲基化状态,并评估ATGL CpG岛甲基化与头颈鳞癌患者预后的相关性[10],预后评价指标为总体生存率。
1.4 ATGL相关信号传导通路的基因富集分析 通过基因富集分析(Gene Set Enrichment Analysis,GSEA)软件[11],解析ATGL参与调控的信号通路。将基因集设置为“h.all.v7.5.1.symbols.gmt”,对TCGA数据库的头颈鳞癌基因表达谱数据进行富集分析,FDR<0.25,基因数量设置为≥35。
1.5 ATGL与头颈鳞癌中免疫细胞浸润的相关性分析 使用TIMER数据库(http://timer.cistrome.org/)分析ATGL基因表达与头颈鳞癌中免疫细胞浸润水平的相关性,分析在不同HPV感染状态下,ATGL基因表达与免疫细胞标志物的相关性[12]。
2 结 果
2.1 ATGL在头颈鳞癌中的转录水平和蛋白表达水平 通过UALCAN数据库进行分析发现,ATGL在头颈鳞癌组织中的转录水平低于头颈部非癌组织(P<0.01),见图1。随后,纳入GEO数据库的21个数据集(表1)进行Meta分析,由于数据集之间存在异质性(I2=60.2%,P<0.001),因此使用随机效应模型,分析结果显示ATGL在头颈鳞癌组织中的表达下调[SMD(95%CI)=-0.34(-0.58,-0.10),P<0.05],漏斗图提示数据没有发表偏倚(Begg′s检验P>0.05),见图2。在蛋白表达水平方面,UALCAN数据平台分析结果提示ATGL在头颈鳞癌组织中的蛋白表达水平亦低于头颈部非癌组织(P<0.001),见图1。
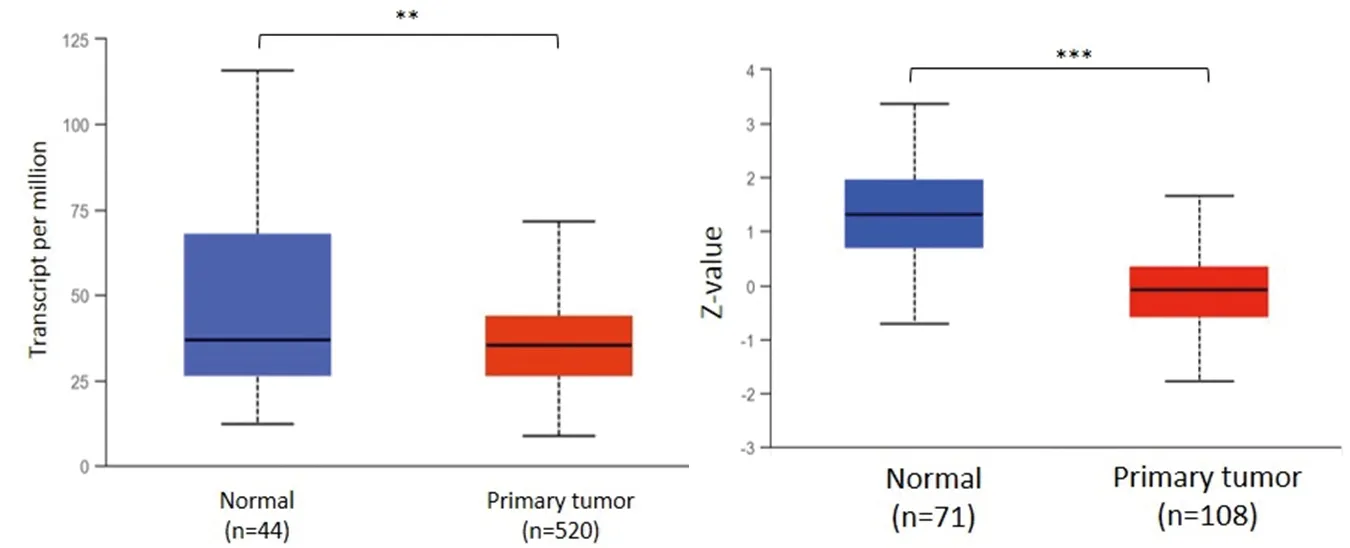
图1 ATGL在头颈鳞癌组织中的表达情况
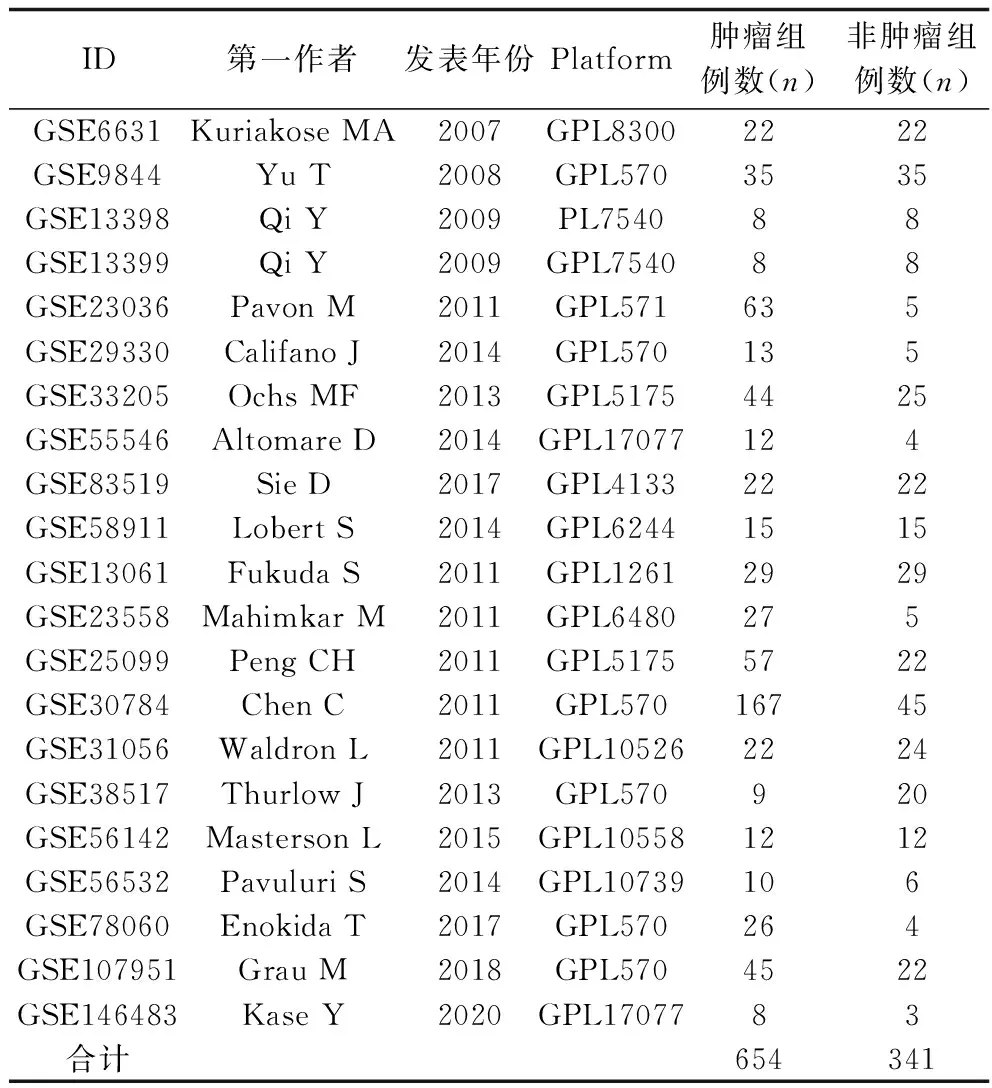
表1 纳入数据集的基本信息
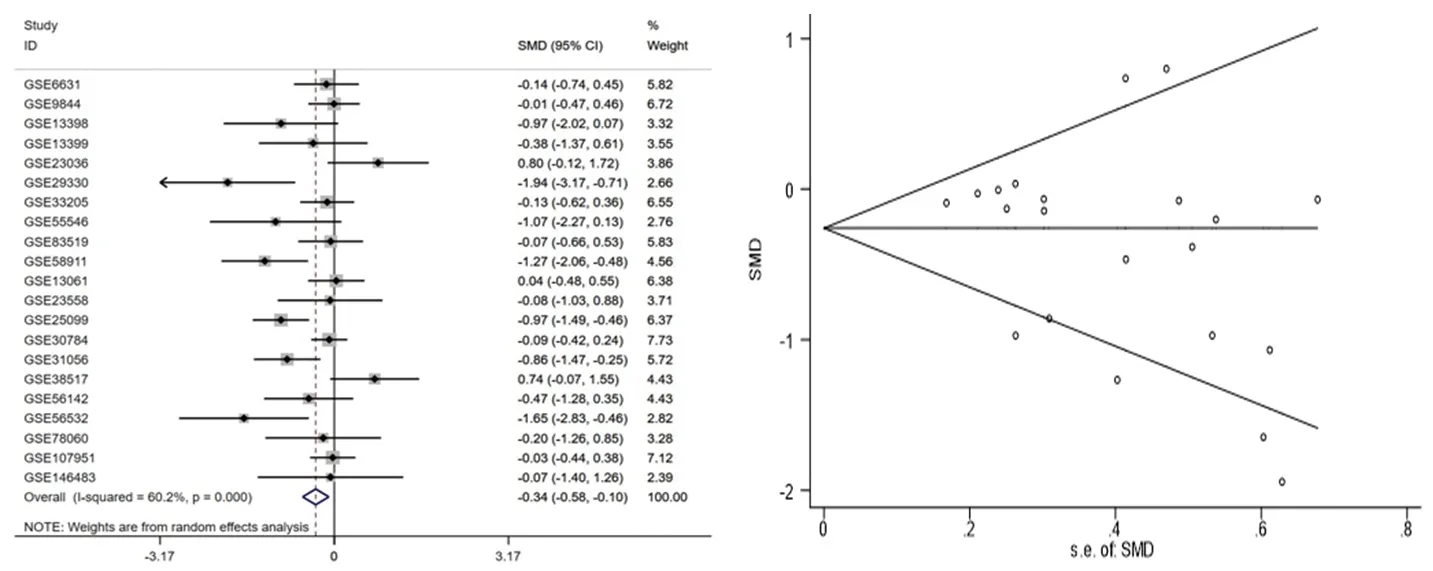
图2 ATGL在头颈鳞癌中转录水平的验证结果
2.2 ATGL表达与头颈鳞癌分级和预后的关系 对ATGL蛋白表达水平与头颈鳞癌肿瘤分级之间的关系进行分析,结果提示,与中分化(Grade 2)头颈鳞癌组织相比,低分化(Grade 3)头颈鳞癌组织中ATGL的蛋白表达更低(P<0.05),见图3A。对78例Ⅲ期、259例Ⅳ期的头颈鳞癌患者中进行总体生存分析,结果提示ATGL高表达的患者的生存率更高(均P<0.05),见图3B、图3C;对499例头颈鳞癌患者进行总体生存分析,结果提示ATGL低表达、ATGL高表达的头颈鳞癌患者的中位生存期分别为48.87个月、58.73个月,ATGL高表达者的总体生存率更高(P<0.05),见图3D。
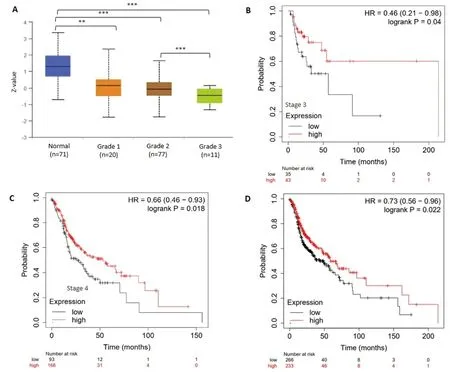
图3 ATGL表达与头颈鳞癌分级、分期和预后的关系
2.3 ATGL DNA甲基化与头颈鳞癌患者预后的相关性 MethSurv数据库中ATGL共有20个候选CpG岛位点,由于甲基化改变通常发生在CpG岛,因此我们对ATGL CpG岛的7个甲基化位点进行分析,结果提示共有3个位点的甲基化与患者的预后相关,分别为cg04519421、cg09051513和cg19713609(均P<0.05),见表2。进一步分析发现与cg04519421、cg09051513位点未发生高甲基化的头颈鳞癌患者相比,发生高甲基化的头颈鳞癌患者生存率更低(均P<0.05),预后更差;而与cg19713609位点未发生高甲基化的头颈鳞癌患者相比,发生高甲基化的头颈鳞癌患者的生存率更高(均P<0.05)。见图4。
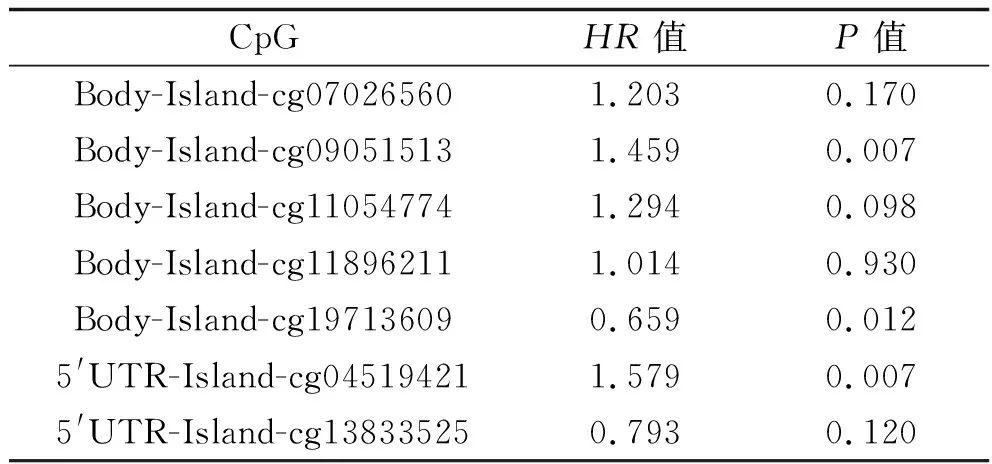
表2 ATGL DNA甲基化对头颈鳞癌患者预后的相关性

图4 ATGL CpG位点cg04519421、cg09051513和cg19713609不同甲基化水平患者的生存曲线比较
2.4 ATGL相关信号传导通路的GSEA结果 最终纳入富集分数最高、同时满足P<0.05和FDR>0.25的15个信号通路,发现在头颈鳞癌中ATGL主要涉及转录因子E2F、DNA损伤检查点G2M、原癌基因MYC、蛋白分泌、上皮-间质转化、转化生长因子β(transforming growth factor-β,TGF-β)、Hedgehog、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,MTOR)、糖酵解等信号传导通路,见表3。ATGL的表达与这些信号通路的基因富集呈负相关,即头颈鳞癌可能通过下调ATGL来激活这一系列信号通路。
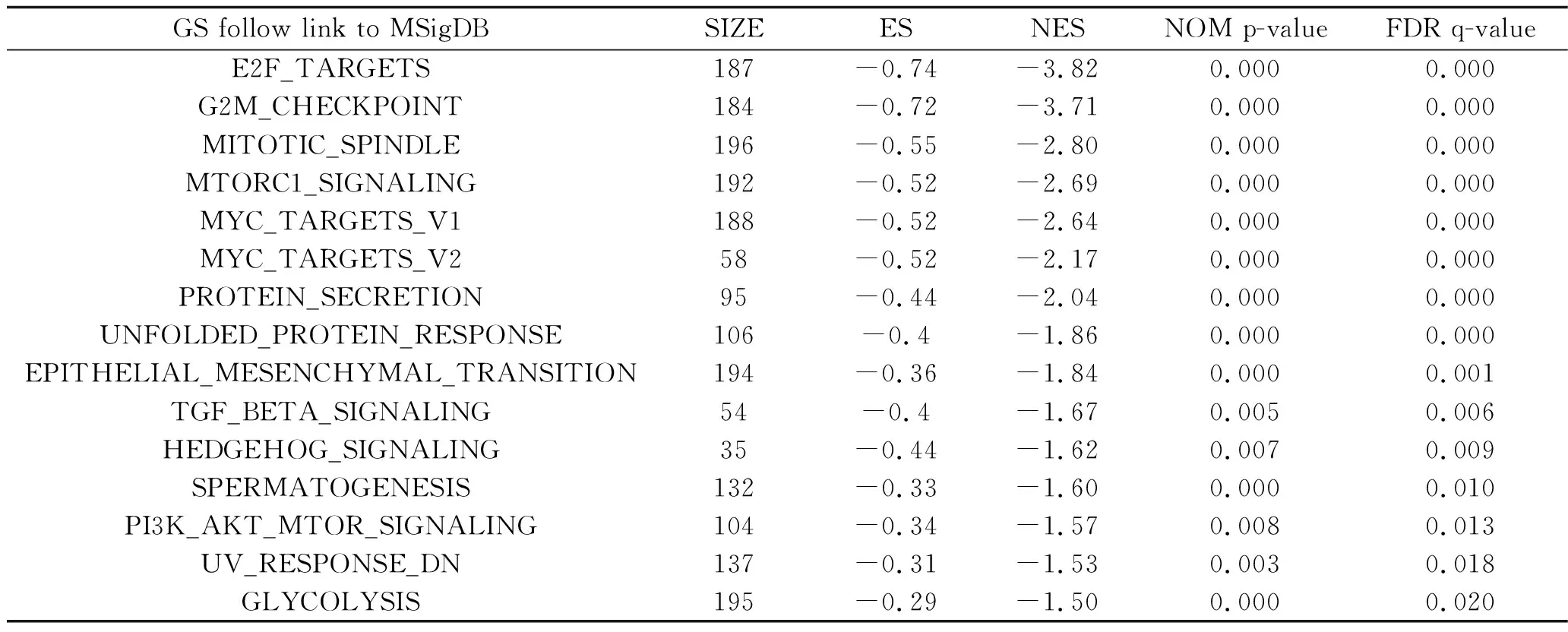
表3 ATGL参与调控的信号传导通路列表
2.5 ATGL表达与头颈鳞癌的肿瘤纯度及免疫细胞浸润相关性分析 结果显示,ATGL的基因表达水平与肿瘤纯度无相关性(r=0.038,P=0.394),而与B淋巴细胞(r=0.215,P=2.09×10-6)、CD4+T淋巴细胞(r=0.246,P=4.61×10-8)及CD8+T淋巴细胞(r=0.124,P=6.75×10-3)、巨噬细胞(r=0.215,P=1.94×10-6)、中性粒细胞(r=0.230,P=3.50×10-7)及树突状细胞(r=0.243,P=6.38×10-8)等免疫细胞的浸润水平呈正相关,见图5。
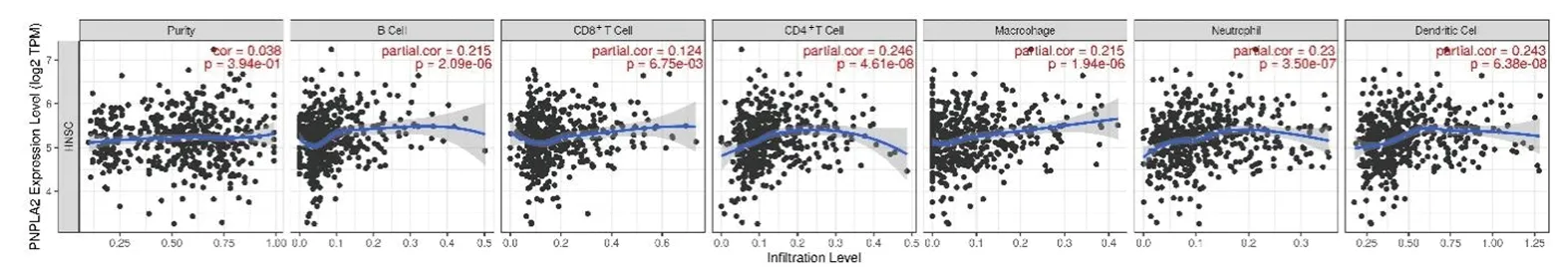
图5 ATGL基因表达与头颈鳞癌的肿瘤纯度和免疫细胞浸润水平的相关性
2.6 HPV通过上调ATGL的表达影响头颈鳞癌免疫微环境 通过ULACAN数据库分析发现,与HPV阴性的头颈鳞癌组织相比,ATGL的转录水平在HPV阳性的头颈鳞癌组织中表达更高,见图6。基于此继续探索在HPV感染状态下ATGL对头颈鳞癌免疫微环境的影响,结果显示,与HPV阴性的头颈鳞癌组织相比,在HPV阳性的头颈鳞癌组织中ATGL基因表达水平与CD8+T淋巴细胞、T淋巴细胞(总)、B淋巴细胞、树突状细胞浸润水平的相关性更高,见表4。

图6 不同HPV感染状态的头颈鳞癌组织中的ATGL表达水平

表4 ATGL与免疫细胞标志物表达的相关性
3 讨 论
ATGL在肿瘤发生和发展中扮演了重要角色。ATGL具有肿瘤特异性,在不同的肿瘤类型中其表达情况也不同,例如,ATGL在乳腺癌、结肠癌、肝癌等组织中表达上调[13-15],但在更多的肿瘤中,如肺癌、胰腺癌、平滑肌肉瘤,ATGL的转录水平呈现异常下调,并参与肿瘤进展的调控[16]。在本研究中,我们发现ATGL在头颈鳞癌中的转录水平下调(P<0.05);与中分化头颈鳞癌相比,在低分化头颈鳞癌中ATGL蛋白的表达水平更低(P<0.05);且ATGL基因表达水平越低,肿瘤Ⅲ期及Ⅳ期患者的生存率、头颈鳞癌患者的总体生存率均更低(P<0.05)。这表明ATGL低表达与头颈鳞癌的发生、发展及预后均有关。Qiao等[17]在一项病例对照研究中发现,外周血中ATGL的异常甲基化与早期肺癌,尤其是年轻女性罹患肺癌的发病风险密切相关。本研究的甲基化水平分析结果也提示ATGL CpG岛的3个位点的甲基化与患者的预后相关(P<0.05),其中cg04519421、cg09051513位点发生高甲基化的头颈鳞癌患者生存率更低。结合甲基化水平分析结果,我们推测头颈鳞癌细胞可能通过表观遗传机制沉默ATGL的表达,以促进自身的恶性生物学行为,从而导致预后不良。
有学者提出,ATGL 通过氧化物酶增殖体激活受体α、炎症、氧化还原稳态及自噬等途径调控肿瘤的发生和发展[18]。而本研究结果提示,头颈鳞癌中ATGL主要涉及转录因子E2F、DNA损伤检查点G2M、原癌基因MYC、上皮-间质转化、TGF-β、Hedgehog、PI3K/AKT/MTOR、糖酵解等信号传导通路,表明上述通路均从不同层面或角度参与肿瘤的发生和发展,这也印证了我们提出的关于头颈鳞癌细胞通过下调ATGL从而激活肿瘤进程的假说。
肿瘤微环境由肿瘤细胞及其周围的免疫细胞、炎症细胞、成纤维细胞、微血管、细胞因子和趋化因子等构成[19]。在这个复杂的体系中,肿瘤细胞及其微环境相互影响,维持肿瘤细胞的恶性表型。本研究结果显示,头颈鳞癌中ATGL的表达与B淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、巨噬细胞、中性粒细胞及树突状细胞等免疫细胞浸润程度呈正相关(P<0.05)。这提示头颈鳞癌细胞可能通过下调ATGL,以抑制免疫细胞的防御功能,从而发生免疫逃避,导致患者预后不良。
HPV也参与调控头颈鳞癌的免疫微环境。有研究报告,HPV调控头颈鳞癌肿瘤微环境中的体液免疫,从而导致HPV特异性B淋巴细胞反应的发生,并激活抗体分泌细胞和生发中心B淋巴细胞[20]。在HPV相关性头颈鳞癌中,CD8+T淋巴细胞占肿瘤浸润淋巴细胞的30%[21]。2021年,Eberhardt等[21]提出,HPV特异性PD-1+干细胞样CD8+T淋巴细胞具有很高的增殖潜能,对于维持肿瘤特异性CD8+T淋巴细胞应答至关重要,靶向性调控这一细胞亚群可能可以通过利用局部免疫反应,从而改善患者的临床结局。在本研究中,我们发现与HPV阴性的头颈鳞癌组织相比,ATGL在HPV阳性的头颈鳞癌组织中的表达较更高,并与CD8+T淋巴细胞、T淋巴细胞(总)、B淋巴细胞、树突状细胞高浸润的相关性相对更强。由此可从HPV调控免疫重编程的角度切入,解释HPV阳性的头颈鳞癌患者临床治疗效果和预后较好的现象。
本研究从肿瘤免疫和表观遗传的角度,对ATGL在头颈鳞癌尤其是HPV相关性头颈鳞癌中的作用及相关机制进行了多维度的探索。结合研究结果,我们提出:ATGL是头颈鳞癌的抑癌基因,是候选的预后评估相关分子标志物;头颈鳞癌细胞可能通过表观遗传机制沉默ATGL的表达,从而促进自身的恶性生物学行为,同时抑制免疫细胞的防御功能以发生免疫逃避,由此导致不良预后;而HPV可介导ATGL高表达从而激活肿瘤微环境中的免疫应答,这是HPV相关性头颈部鳞状细胞癌患者治疗应答较好的可能机制。
