花旗松素对高糖诱导的人肾小管上皮细胞炎症损伤的影响及其机制▲
2022-09-18陈静张进
陈 静 张 进
(1 宝鸡职业技术学院教务处,陕西省宝鸡市 721003; 2 宝鸡市人民医院内分泌科,陕西省宝鸡市 721000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的并发症之一,有30%~40%的糖尿病患者最终会发展为DN[1]。肾小管上皮细胞损伤是DN的主要特征之一,高血糖可诱导肾小管上皮细胞凋亡并诱发炎症反应,导致肾小管损伤[2]。因此,减轻高糖诱发的肾小管上皮细胞损伤可能是阻断DN进展的有效策略。花旗松素是从松科植物中提取的生物类黄酮,具有抗菌、消炎、抗氧化、抗癌等作用[3]。最近研究表明,花旗松素可通过抑制促炎细胞因子的分泌减少破骨细胞的生成,对骨质疏松具有潜在的治疗作用[4]。此外,花旗松素还可以预防甲醇暴露引起的大鼠视神经氧化损伤和炎症损伤[5]。然而,有关花旗松素对高糖诱导的人肾小管上皮细胞炎症损伤的改善作用的研究仍较少。环状RNA(circular RNA,circRNA)是一类具有稳定共价闭合环的内源性非编码RNA,对糖尿病及其并发症进展具有重要的调节作用[6]。研究发现,circRNA circ_0001445在氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导的内皮细胞中表达下调,过表达circ_0001445可抑制ox-LDL诱导的炎症反应,并抑制细胞凋亡[7]。但circ_0001445是否与高糖诱导的人肾小管上皮细胞损伤相关并不清楚。本研究观察花旗松素对高糖诱导的肾小管上皮细胞凋亡及其分泌炎症因子水平的影响,并基于circ_0001445探讨该药的保护机制。
1 材料与方法
1.1 实验材料 人肾小管上皮细胞购自美国ATCC公司(批号:20190201);Lipofectamine 2000转染试剂盒、TRIzol试剂购自美国Invitrogen公司(批号:20181225、20181109);花旗松素(纯度98.9%)购自中国食品药品检定研究院(批号:111816-201102);circ_0001445过表达质粒(pcDNA-circ_0001445)、质粒空载体(pcDNA)、circ_0001445小干扰RNA(si-circ_0001445)、小干扰RNA阴性对照(si-NC)均购自上海吉凯基因公司(批号:20190103、2019106、2019108、2019110);Annexin Ⅴ-FITC/碘化丙啶凋亡检测试剂盒购自上海翊圣生物公司(批号:20181114);人白细胞介素6(interleukin 6,IL-6)ELISA试剂盒、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、GAPDH兔源多克隆抗体、活化型Caspase(cleaved Caspase)-3兔单克隆抗体、cleaved Caspase-9兔多克隆抗体均购自美国Abcam公司(批号:20181214、20181115、20181005、20180926、20181117);RIPA缓冲液购自上海远慕生物公司(批号:20181016);化学发光试剂盒购自北京百奥莱博科技有限公司(批号:20181203);PrimeScriptTM反转录试剂盒、SYBR Premix EX Taq试剂盒均购自日本Takara公司(批号:20190102、20190113)。
1.2 实验方法
1.2.1 细胞培养和实验分组:采用添加10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM-F12,并置于含5% CO2、37 ℃恒温培养箱中培养肾小管上皮细胞,细胞融合度为80%时采用胰酶消化,按1 ∶3比例传代培养。将对数期肾小管上皮细胞以5×105个/孔接种在6孔板中过夜,利用Lipofectamine 2000转染试剂将2 μg pcDNA、2 μg pcDNA-circ_0001445、2 μg si-NC、2 μg si-circ_0001445分别转染融合度为60%的肾小管上皮细胞,培养6 h后更换为含血清的培养液,转染48 h时采用实时荧光定量PCR验证转染效果。
将未经转染的肾小管上皮细胞分为5组,包括Con组、HG组、HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组。Con组采用含5.5 mmol/L葡萄糖的DMEM-F12培养液孵育肾小管上皮细胞,作为一般对照组;HG组采用含25 mmol/L葡萄糖的DMEM-F12培养液孵育肾小管上皮细胞[8],作为高糖对照组;HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组分别采用含1 μmol/L、10 μmol/L、100 μmol/L的花旗松素加25 mmol/L葡萄糖的DMEM-F12培养液孵育肾小管上皮细胞[9],作为治疗低、中、高剂量花旗松素组。培养24 h后,收集细胞进行后续实验。
另外,再将经过转染的肾小管上皮细胞分为4组,包括HG+pcDNA组、HG+pcDNA-circ_0001445组、HG+花旗松素+si-NC组、HG+花旗松素+si-circ_0001445组。HG+pcDNA组、HG+pcDNA-circ_0001445组分别采用含25 mmol/L葡萄糖的DMEM-F12培养液孵育经转染的肾小管上皮细胞;HG+花旗松素+si-NC组、HG+花旗松素+si-circ_0001445组分别采用含100 μmol/L花旗松素和含25 mmol/L葡萄糖的DMEM-F12培养液孵育经转染的肾小管上皮细胞。培养24 h后,收集细胞进行后续实验。
1.2.2 流式细胞术检测肾小管上皮细胞凋亡率:采用冰冷的PBS洗涤1.2.1中各组肾小管上皮细胞1次,用500 μL结合缓冲液(含5 μL Annexin Ⅴ-FITC和5 μL 碘化丙啶)室温避光染色20 min,然后采用FACSCalibur流式细胞仪(美国Beckman Coulter公司)检测细胞凋亡率。细胞凋亡率=[Annexin Ⅴ(+)碘化丙啶(-)细胞数量+Annexin Ⅴ(+)碘化丙啶(+)细胞数量]/所有细胞数量。每组设置3个复孔,实验重复3次。
1.2.3 ELISA检测IL-6和TNF-α水平:1.2.1中各组肾小管上皮细胞处理完毕后,收集细胞培养的上清液,检测其IL-6和TNF-α水平,严格按照ELISA试剂盒说明书进行。实验重复3次。
1.2.4 Western blot检测cleaved Caspase-3、cleaved Caspase-9蛋白表达量:将1.2.1中各组肾小管上皮细胞置于冰上,加入RIPA缓冲液裂解细胞。将适量蛋白与等体积1×上样缓冲液混合100 ℃孵育3 min使蛋白变性。每孔中加入30 μg蛋白样品,进行SDS-PAGEA,采用湿式转膜装置将蛋白转移到PVDF膜,用封闭缓冲液室温孵育2 h。用特异性一抗溶液(cleaved Caspase-3为1 ∶1 000,cleaved Caspase-9为1 ∶1 000,GAPDH为1 ∶2 500)4 ℃摇床孵育过夜。TBST洗膜3次,10 min/次,37 ℃下用二抗溶液(1 ∶1 000)孵育膜1 h,TBST洗膜3次,10 min/次。以GAPDH为内参,用化学发光试剂盒检测免疫条带,采用ImageJ软件检测灰度值,以目的蛋白与内参的灰度值比值表示目的蛋白的相对表达量。每组设置3个复孔,实验重复3次。
1.2.5 实时荧光定量PCR检测circ_0001445表达水平:使用TRIzol试剂提取1.2.1中各组肾小管上皮细胞总RNA,使用分光光度计对获得的RNA样品的浓度和纯度进行定量。浓度和纯度合格后,利用PrimeScriptTM反转录试剂盒将RNA样本反转录为cDNA,再用SYBR Premix EX Taq试剂盒进行实时荧光定量PCR。反应体系为10×PCR Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正反向引物各0.5 μL,cDNA 2 μL,RNase-Free ddH2O补足体系至25 μL。反应条件为95 ℃预变性5 min,95 ℃变性30 s,63.3 ℃退火30 s,72 ℃延伸30 s。变性、退火和延伸步骤重复40个循环。以GAPDH基因为内参对照,2-ΔΔCt法计算circ_0001445相对表达量。circ_0001445上游引物5′-CAAGATGGGCGAAAGTTCACT-3′,下游引物5′-TGTGTTGCTCCATGTCTAATCATT-3′;GAPDH上游引物5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物5′-GCAGGAGGCATTGCTGATGAT-3′。每组设置3个复孔,实验重复3次。
1.3 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料采用(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 花旗松素对高糖诱导的人肾小管上皮细胞凋亡及cleaved Caspase-3、cleaved Caspase-9蛋白表达量的影响 与Con组比较,HG组肾小管上皮细胞的凋亡率、cleaved Caspase-3和cleaved Caspase-9蛋白表达量均升高(均P<0.05);与HG组比较,HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组肾小管上皮细胞的凋亡率、cleaved Caspase-3和cleaved Caspase-9蛋白表达量均降低(均P<0.05),肾小管上皮细胞的凋亡率、cleaved Caspase-3和cleaved Caspase-9蛋白表达量由高到低均为HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组(均P<0.05)。见图1和表1。
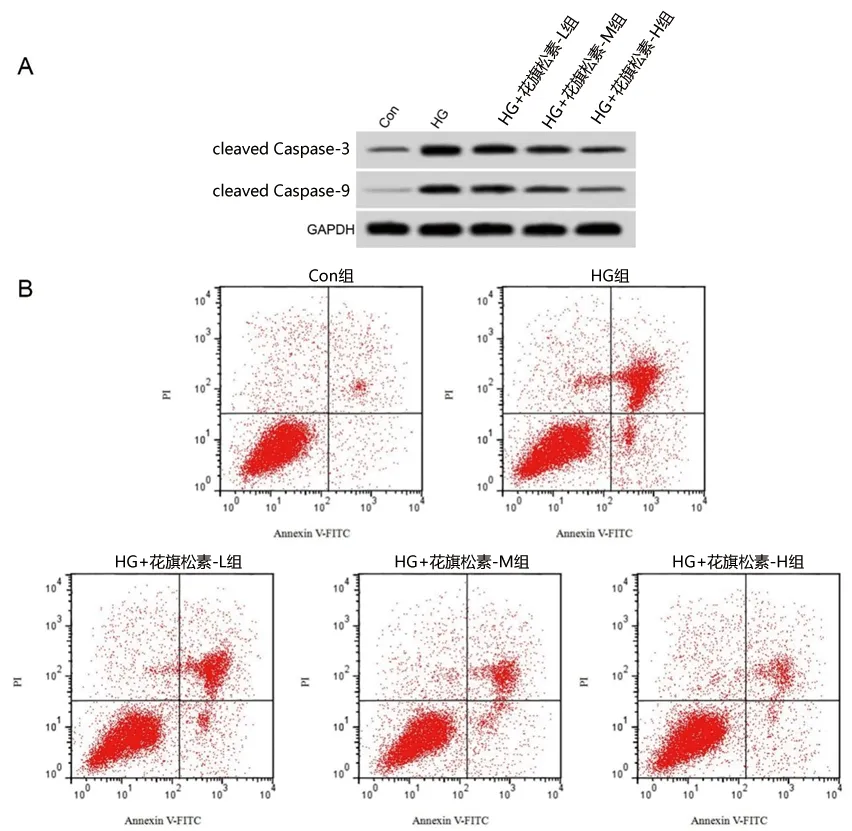
图1 花旗松素对高糖诱导的人肾小管上皮细胞凋亡及cleaved Caspase-3和cleaved Caspase-9蛋白表达量的影响注:图A为蛋白条带图;图B为细胞凋亡流式图。

表1 各组细胞凋亡率及cleaved Caspase-3、cleaved Caspase-9蛋白相对表达量的比较(x±s)
2.2 花旗松素对高糖诱导的人肾小管上皮细胞炎症因子水平的影响 与Con组比较,HG组肾小管上皮细胞的IL-6和TNF-α水平均增加(均P<0.05);与HG组比较,HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组肾小管上皮细胞的IL-6和TNF-α水平均下降(均P<0.05),肾小管上皮细胞的IL-6和TNF-α水平由高到低均为HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组(均P<0.05)。见表2。

表2 各组细胞IL-6和TNF-α水平的比较(x±s,pg/mL)
2.3 花旗松素对高糖诱导的人肾小管上皮细胞circ_0001445表达的影响 与Con组比较,HG组肾小管上皮细胞的circ_0001445表达量降低(P<0.05);与HG组比较,HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组肾小管上皮细胞的circ_0001445表达量均升高(P<0.05),肾小管上皮细胞circ_0001445相对表达量由低到高为HG+花旗松素-L组、HG+花旗松素-M组、HG+花旗松素-H组(均P<0.05)。见表3。
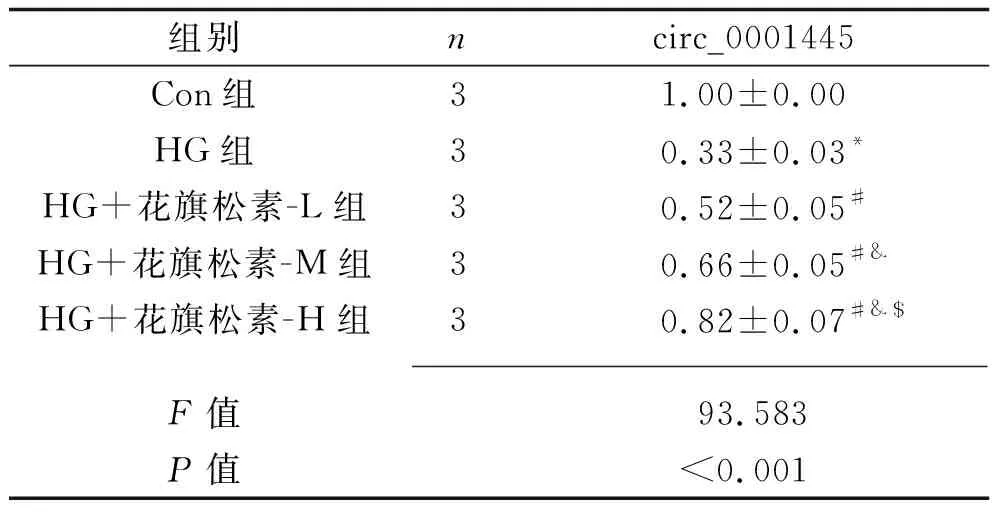
表3 各组细胞circ_0001445相对表达量的比较(x±s)
2.4 circ_0001445过表达对高糖诱导的人肾小管上皮细胞凋亡和炎症因子水平的影响 与HG+pcDNA组比较,HG+pcDNA-circ_0001445组肾小管上皮细胞circ_0001445表达量升高,细胞凋亡率、cleaved Caspase-3蛋白表达量、cleaved Caspase-9蛋白表达量、IL-6和TNF-α水平均降低(均P<0.05)。见图2和表4。

图2 circ_0001445过表达对高糖诱导的人肾小管上皮细胞凋亡及相关蛋白表达的影响注:图A为蛋白条带图;图B为细胞凋亡流式图。
2.5 干扰circ_0001445表达后花旗松素对高糖诱导的人肾小管上皮细胞凋亡、相关蛋白表达及炎症因子水平的影响 与HG+花旗松素+si-NC组比较,HG+花旗松素+si-circ_0001445组肾小管上皮细胞circ_0001445表达量降低,细胞凋亡率、cleaved Caspase-3蛋白表达量、cleaved Caspase-9蛋白表达量、IL-6和TNF-α水平均升高(均P<0.05)。见图3和表5。

图3 干扰circ_0001445表达后花旗松素对高糖诱导的人肾小管上皮细胞凋亡及相关蛋白表达的影响注:图A为蛋白条带图;图B为细胞凋亡流式图。

表5 各组细胞凋亡、相关蛋白相对表达量及炎症因子水平的比较(x±s)
3 讨 论
花旗松素已被证实在多种类型损伤模型中可发挥保护作用。例如叶艳琼等[10]研究发现,花旗松素可抑制炎性小体表达,抑制心肌细胞凋亡,保护心肌细胞免受氧化损伤;Tang等[11]的研究表明,花旗松素可调节缺血再灌注大鼠心肌细胞的氧化应激反应,减少心肌细胞凋亡,并能改善大鼠的心功能;Turovskaya等[12]的研究证实花旗松素通过上调抗凋亡相关基因、抗氧化相关基因的表达,下调促炎因子的表达,进而抑制糖氧剥夺诱导的神经元细胞损伤。而花旗松素是否对高糖诱导的肾小管上皮细胞炎症损伤具有改善作用鲜见报告。
高血糖刺激可导致过量活性氧生成和氧化应激反应,诱导肾小管上皮细胞凋亡[13];此外,高血糖刺激还导致促炎性因子分泌增加,这些炎症因子可直接损伤肾小管上皮细胞[14]。本研究中,高糖干预后肾小管上皮细胞凋亡率、促炎因子IL-6和TNF-α水平、促凋亡蛋白cleaved Caspase-3和cleaved Caspase-9表达量均增加,而花旗松素可明显抑制高糖诱导的肾小管上皮细胞凋亡和炎症因子的表达,并可下调促凋亡蛋白cleaved Caspase-3和cleaved Caspase-9的表达,这表明花旗松素对高糖诱导的细胞炎症损伤具有改善作用,且其作用呈一定的剂量依赖性。
circRNA是由其前体RNA反向剪切形成的非编码RNA,其通过调控炎症、凋亡、自噬、细胞增殖等过程参与DN的发病机制[15]。研究发现,circ_0000285在DN小鼠模型肾组织、高糖诱导的小鼠足细胞中的表达显著升高,抑制circ_0000285可上调miR-654-3p进而减轻高糖诱导的炎症损伤[16]。还有研究表明,circACTR2参与高糖诱导的近端肾小管上皮细胞焦亡、炎症和纤维化[17]。有学者发现,circ_0001445在绝经后骨质疏松症患者血浆中表达降低,而抗骨质疏松治疗后血浆中circ_0001445表达明显上调,血浆circ_0001445是潜在的绝经后骨质疏松症诊断标志物[18]。此外,肝癌、宫颈癌等肿瘤中circ_0001445表达下调,恢复其表达能够抑制肿瘤生长和转移[19-20]。本研究中,高糖干预后肾小管上皮细胞中circ_0001445表达量降低,而花旗松素可显著上调细胞中circ_0001445的相对表达量,这提示circ_0001445表达增加可能是花旗松素对高糖诱导的肾小管上皮细胞损伤发挥改善作用的重要因素。本研究结果还显示,通过转染pcDNA-circ_0001445过表达circ_0001445,可显著抑制高糖诱导的肾小管上皮细胞凋亡和炎症因子的表达,并降低cleaved Caspase-3和cleaved Caspase-9蛋白的表达,这与花旗松素的保护效果类似,提示circ_0001445可能介导花旗松素对高糖诱导肾小管上皮细胞损伤的保护作用。本研究结果还显示,通过转染si-circ_0001445干扰circ_0001445表达,可明显减弱花旗松素对高糖诱导肾小管上皮细胞凋亡、炎症因子分泌、cleaved Caspase-3,cleaved Caspase-9蛋白表达的影响,这进一步证实花旗松素通过上调circ_0001445表达,从而抑制高糖诱导的肾小管上皮细胞凋亡和炎症反应。
综上所述,花旗松素可呈剂量依赖性地减轻高糖诱导的人肾小管上皮细胞凋亡和炎症因子表达,其机制可能为通过上调circ_0001445表达实现的。这初步揭示了花旗松素抑制高糖诱导的人肾小管上皮细胞炎症损伤的作用机制,为花旗松素治疗DN提供了实验依据。
