毕赤酵母高效表达外源蛋白的分子水平策略
2022-09-16张欣然凌焱杨英
张欣然,凌焱,杨英*
1(军事医学研究院 辐射医学研究所,北京,100850)2(河北大学 生命科学学院,河北 保定,071000)
巴斯德毕赤酵母(Pichiapastoris)作为被应用最广泛的工程菌之一,已有超过5 000种外源蛋白利用其表达并进行工业化制备。其中不仅包括脂肪酶、植酸酶、甘露聚糖酶等应用范围广泛的工业酶,还包括人血清白蛋白、胰岛素、乙肝表面抗原等具有重要应用价值的药物相关蛋白。毕赤酵母在重组蛋白表达方面的成功是由于其易于实现工业化大批量发酵生产,且自分泌的蛋白较少,相较于原核表达系统,毕赤酵母还具有翻译后修饰等功能。但是毕赤酵母表达系统仍存在着表达效率低、外源基因不稳定、蛋白在细胞内易被降解等问题。为解决上述问题,学者从外源基因的特性、菌种、表达环境和发酵技术等多个方面对毕赤酵母表达系统进行改造,以期望达到更高效的外源蛋白表达效果。本文着眼于分子水平上的基因转录、蛋白质加工、蛋白质降解模块以及转运分泌4个模块,对利用毕赤酵母表达系统通过优化为毕赤酵母偏嗜型密码子、插入多拷贝数的外源基因、选择合适的启动子以及高效率的引导肽、敲除相关蛋白酶的基因、共表达促折叠因子等方式使外源蛋白高效率表达的相关分子水平策略进行了简要综述。
1 毕赤酵母表达系统简介
酵母菌是一种当前被广泛应用于生产蛋白质类药物的菌种。在酵母菌细胞中,蛋白质的表达机制与哺乳动物细胞中的相似。与细菌相比,酵母细胞具有生长速度快、翻译后修饰、分泌表达、易于遗传操作等优点。目前已经有超过5 000种异源蛋白可以利用毕赤酵母成功表达[1]。不同于其他表达系统,选择毕赤酵母作为表达外源蛋白菌株的优势主要有以下几点:
(1)高表达。区别于酿酒酵母的GAL1启动子,毕赤酵母具有的AOX1启动子是强诱导型启动子,其蛋白表达水平是酿酒酵母的10~100倍,甲醇可作为其唯一碳源,实现高效的异源表达,大量外源蛋白表达量达到g/L水平,如人血清白蛋白表达量能达到10 g/L[2],木葡聚糖内转糖苷酶表达量能达到5 g/L[3]。
(2)高分泌。由α-因子信号肽引导,将外源蛋白分泌至胞外。外源蛋白的含量占培养基中总蛋白量的80%~90%,并且毕赤酵母较少分泌内源性蛋白,这就对后期目的蛋白的分离纯化提供了极大的便利。
(3)高稳定性。在酿酒酵母中,质粒复制进行游离表达;然而,在毕赤酵母中,质粒整合在宿主染色体上,因此重组菌株非常稳定,即使没有外界抗生素的筛选压力,外源基因仍能稳定存在于宿主染色体基因组[4]。
(4)糖基化程度低。虽然酿酒酵母和毕赤酵母的N-连接糖基化都是甘露糖形式,但毕赤酵母翻译后将长度为8~14个甘露糖残基的寡糖链添加到蛋白上去,相比于酿酒酵母翻译后添加到蛋白上的50~150个甘露糖残基要短很多。除此之外,毕赤酵母的O-连接糖基化也非常少[5]。
(5)培养成本低。毕赤酵母对培养基的营养要求低,可使用成本低廉的培养基进行大规模发酵,又因为其好氧生长速度快,适合高密度培养,十分有利于工业化放大生产[6]。
2 影响外源蛋白表达的因素
毕赤酵母不仅具有许多原核生物容易培养等优点[7],同时克服了许多酿酒酵母系统存在的缺陷[8],十分适合高水平外源基因的表达,目前被广泛用于生产各种工业酶[9]和药用蛋白[10]。然而,使用毕赤酵母进行工业化生产仍存在许多限制,如需要易燃化学物质甲醇来诱导表达、延长发酵时间和低表达水平。因此,可根据限制毕赤酵母高效表达的因素,通过合理设计实验条件[11]、开发强启动子、优化蛋白质分泌途径[12]、改变蛋白质糖基化[13]和转录因子的共表达[14]等方式来增强外源蛋白在毕赤酵母中的表达效率。表1总结了影响毕赤酵母表达外源蛋白效率的因素以及对应的提高表达效率的方法。

表1 影响毕赤酵母表达外源蛋白效率的因素Table 1 Factors affecting the expression efficiency of exogenous proteins in Pichia pastoris
3 高效表达的分子水平策略
3.1 基因转录模块
基因转录模块主要分为密码子的优化、基因剂量的优化、启动子的选择与优化3个部分。密码子的优化主要采用的方法是将外源基因的密码子设计成毕赤酵母偏好的密码子;基因剂量的优化主要是增加外源基因拷贝数,通过体外构建法或者体内构建法来达到高效表达外源蛋白的目的;而启动子优化是通过人为选择,利用转录强度高且制约因素少的启动子来表达外源蛋白,从而提高表达效率。
3.1.1 密码子优化
外源基因的密码子和其mRNA的二级结构影响了外源蛋白表达效率的高低。毕赤酵母有其偏好的一套表达密码子,构建表达载体时需将外源基因按照其偏好的密码子进行优化,如果外源基因的密码子与毕赤酵母偏好的密码子不一致,将会在mRNA翻译时导致顺序错位无法正常译出,甚至提前终止。除此之外,mRNA的5′非翻译区(5′ untranslated region,5′UTR)序列对外源基因的表达水平起关键调控作用,使用AOX1基因的5′UTR可显著提高外源基因的表达量。
密码子优化是在确保外源蛋白质的氨基酸序列不发生变化的基础上,改造为毕赤酵母偏好的外源基因密码子类型。李富强等[32]通过密码子优化将猪圆环病毒2型Cap蛋白的表达量由近乎为0提高到155 mg/mL。顾莉莉等[33]通过密码子合理优化将黑曲霉的Ⅱ型脂肪酶表达量提高了174.5 U/L。通过优化外源基因的密码子也可以实现多种外源蛋白的共表达。唐小雁等[34]通过密码子优化UDP-糖基转移酶UGT76G1和蔗糖合成酶AtSUS基因,实现了双酶在毕赤酵母中的胞内共表达。因此,通过优化密码子可以提高毕赤酵母中外源蛋白质的合成速率。
3.1.2 基因剂量的优化
提高外源基因剂量的主要方法是增加基因拷贝数。一般情况下,单拷贝的基因在毕赤酵母中的表达量普遍较低,可以通过体内构建或者体外构建来适当增加基因拷贝数使效率提高。
体内构建法是在体外逐步地串联外源基因的表达盒,以此得到多拷贝数的表达质粒。主要依赖于限制性内切同尾酶的作用,但由于载体分子质量本身较大,随着拷贝数增加其操作也变得越来越困难,一般情况下最多只能构建到6拷贝左右。王义春等[35]通过密码子优化、体外多拷贝构建的方法,将外源基因与α-因子信号肽编码序列一起合成,通过酶切酶连构建含1~6个表达盒的表达质粒,获得玉米赤霉烯酮降解酶的重组菌株,其重组蛋白表达的分子质量为28.9 kDa。刘洁等[36]优化β-胡萝卜素合成限速酶的基因拷贝数,构建了β-胡萝卜素产量为3.7 mg/g菌体干重的新菌株Pp-EYBI+(YB) 3H。吕星星等[37]使用同尾酶法构建了鳜鱼β-防御素(Sinipercachuatsiβ-defensin, ScBD)基因的2拷贝和4拷贝表达盒载体pPICZαA-ScBDn(n=2或4),分别电转至毕赤酵母X-33后成功筛选到各种重组菌株。结果表明,含1拷贝、2拷贝和4拷贝表达盒载体的重组菌株的基因组中ScBD基因的拷贝数分别为1.19×105、2.56×105和5.29×105,证明载体所含的表达盒数目与嵌合进毕赤酵母基因组中的ScBD基因拷贝数之间存在正相关关系,也由此证明了多拷贝表达盒载体的构建是提高目的基因拷贝数和转录水平的有效方法。增加基因的数量可以在一定范围内增加外源蛋白质的合成,但是过多的拷贝会增加宿主的代谢负荷。WU等[38]表达内质网氧化蛋白时的拷贝数超过5时,表达水平显著降低。
体外构建法通常是通过抗生素压力筛选得到多拷贝外源基因菌株,如提高G418抗性的浓度,能筛选到基因拷贝数为7~12的表达菌株。SCORER等[39]在含有不同浓度的G418平板上涂布毕赤酵母转化子,通过测出每块板上转化子的外源蛋白的表达水平,提出了外源基因的拷贝数和G418筛选浓度存在正相关性的观点。目前一种新的筛选方法则是利用荧光蛋白作为分子信标,直观快速地做高表达菌株的筛选,虞维红[40]通过2A肽将绿色荧光蛋白和红色荧光蛋白分别与抗菌肽PR39多拷贝进行融合表达,筛选得到的D-PR39-Y菌株表达量提高了69.4%。陈永安等[19]通过检测菌株的荧光值代替检测重组蛋白的表达水平和活性,根据绿色荧光值的高低对包含不同植酸酶表达水平的重组菌株的菌群进行分选,从而实现多拷贝菌株的筛选,大大提高了其应用的便捷性及通用性。
3.1.3 启动子的选择和优化
启动子是基因表达的关键元件。启动子的强度与外源基因的mRNA水平及外源蛋白的表达量直接相关,选择适用的启动子有利于外源蛋白的高效合成。启动子可分为需要诱导剂的诱导型启动子和不需要诱导剂的组成型启动子。AOX1基因的启动子——PAOX1是常用的诱导型启动子,该启动子受甲醇的诱导,被葡萄糖和甘油抑制,因此可通过更换不同的碳源(甘油或甲醇),使细胞生长与外源蛋白合成2个过程分开,有利于平衡生物量与积累外源蛋白。在毕赤酵母PAOX1控制下,外源蛋白在细胞内的表达量能达到20 g/L,其分泌表达量可达到15 g/L。MOMBENI等[41]用甲醇氧化酶基因(pMOX)的启动子区域在蛋白酶缺陷型和野生型毕赤酵母菌株中探索异源表达外源蛋白情况。MOX的启动子区被分离出来,并用pPINK-HC质粒中的pAOX1取代。引入了pMOX这种新的小而强的无甲醇启动子,用于在毕赤酵母中生产重组蛋白。
目前不同来源的多种诱导型启动子被发现并被利用,如磷酸转运载体基因的启动子PPHO89(磷酸缺少时被诱导)、异柠檬酸裂合酶基因的启动子PICL1(乙醇诱导)等。甘油醛三磷酸脱氢酶基因的启动子PGAP是最常用的组成型启动子,其在葡萄糖和甲醇条件下具有相同的转录强度。PGCW14是毕赤酵母中发现具有最高转录强度的组成型启动子,当葡萄糖是唯一碳源时,将EGFP用作报告蛋白,其表达量比PGAP控制下的表达量提高了10倍,当甘油为唯一碳源时,表达量提高了5倍。
3.2 蛋白加工模块
内质网是真核生物中蛋白分泌表达加工折叠的主要场所,即使可从多种高效的引导肽中选择最合适的引导肽,其新合成蛋白的通量增加会导致内质网中未折叠和错误折叠的蛋白积累,使外源蛋白在毕赤酵母细胞中滞留,当表达水平高时,尤其如此。当在细胞中合成大量的外源蛋白质并且没有被及时折叠时,会给内质网造成压力,当未折叠或错误折叠的蛋白质在内质网中大量积累,远超过分子伴侣辅助折叠的能力,超出降解系统清除错误蛋白的限度时,往往会造成内质网的损伤,称为内质网胁迫,也叫内质网应激。严重时还会引起其他细胞器的损伤、细胞自噬,甚至造成细胞死亡。
为了解决这个问题,可以通过导入促折叠因子基因使得菌株过表达促折叠因子,及时促进折叠和分泌大量的外源蛋白质,这些促折叠因子对提高蛋白质产量有显著作用。王晨蕾等[42]在重组菌株中分别过量表达蛋白质折叠(BIP、ERO1)、囊泡运输(SEC53、SEC1)、胁迫应激(Hac1、GCN4)相关的6种分子伴侣,结果显示,共表达这6种分子伴侣对分泌表达漆酶的菌株PP-L的正常生长没有影响;共表达BIP使重组菌胞外酶活力提高359%,共表达ERO1胞外酶活力反而降低22%;共表达其他4种分子伴侣胞外酶活力提高18%~53%。组合共表达BIP和Hac1的重组菌较之前胞外酶活力提高了602%,酶活力达到3 896 U/L。但是,此类折叠因子的表达也将占据一定量的细胞资源,需要进一步的实验来确定实际的促进折叠的作用和最佳的促进分泌的剂量。
此外,真核细胞已经进化出未折叠的蛋白质反应(unfolded protein response, UPR)途径来应对内质网压力并维持蛋白质折叠的稳态。UPR信号传导是一个进化上保守的通路,尤其是在酵母和丝状真菌中表现出相当的保守性,由内质网腔的未折叠蛋白累积造成胁迫来自然激活。如图1所示通路上的转录因子Hac1p在激活、维持这一信号途径中起着关键作用,通过依赖于UPR信号响应元件(unfolded protein reaction element,UPRE)调节蛋白折叠或降解等相关基因的转录过程,来缓解产生于内质网腔的这种胁迫。内质网未折叠蛋白的增加会减少分子伴侣Kar2,导致形成具有激酶和核酸酶活性的Ire1成形二聚体,该二聚体与未折叠蛋白结合。磷酸化后,它可以激活并影响其核酸酶活性,对转录因子Hac1的mRNA进行特异性的非经典剪切,使Hac1去除内含子来正常表达(通过将Hac1转换为Hac1i)。然后,转录因子Hac1进入细胞核,与UPR靶基因启动子的响应元件结合,并启动UPR靶基因的转录,从而使细胞能够抵消内质网压力。内质网压力响应因子的共表达或用于内质网蛋白加工的分子伴侣和相关酶的过表达都有助于提高内质网蛋白加工的水平,因此能够进一步提高产量。闵琪等[43]利用毕赤酵母表达甘露糖聚酶ManA(Accession No.KJ806637)时,将Hac1与ERO1、PDI、PDI1、CPR5、BiP这5种与蛋白折叠相关的分子伴侣共表达,使酶活力提高了26%,最高达到1 014 U/mL。
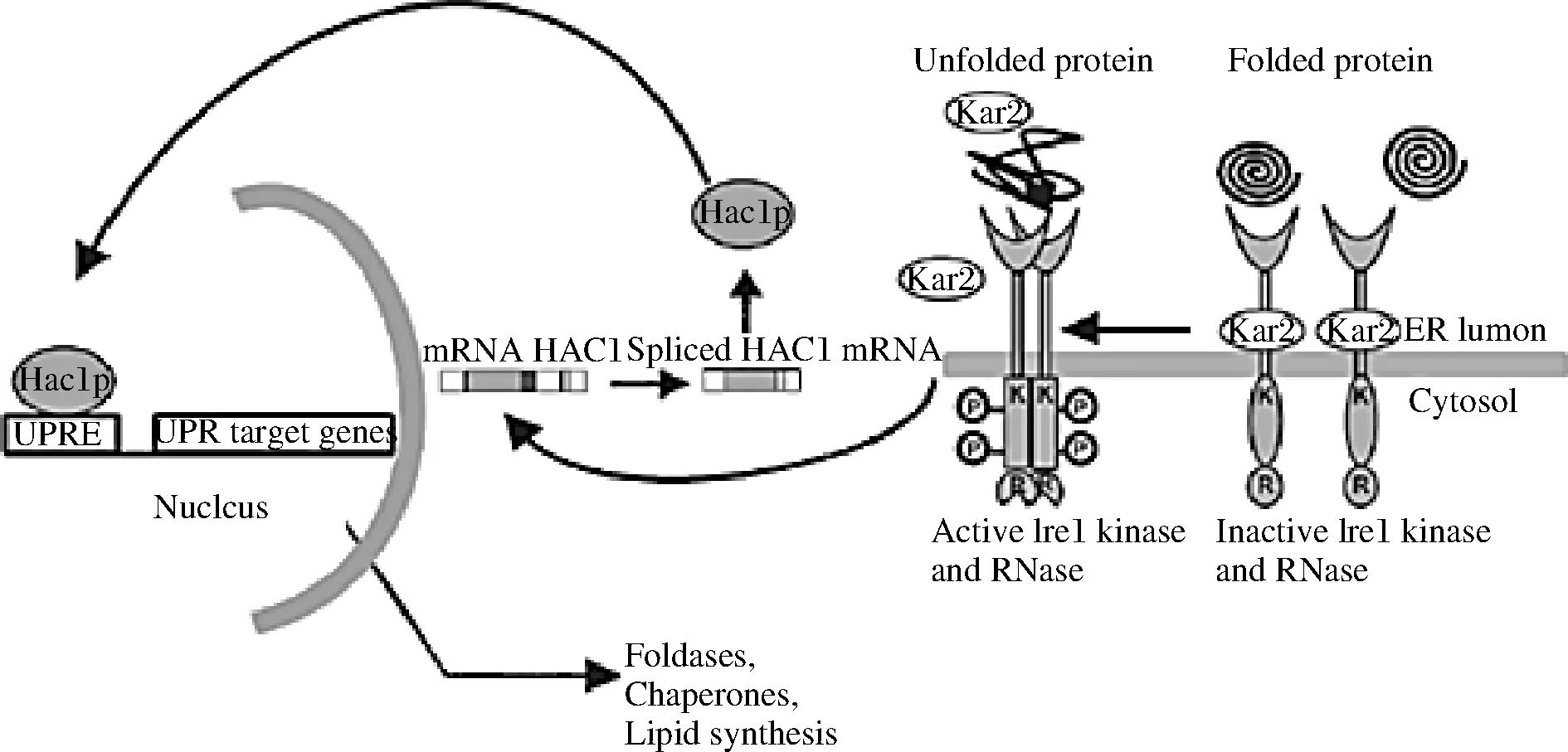
图1 酵母UPR的激活Fig.1 Activation of UPR in yeast
目前的研究热点多集中在提高外源基因拷贝数以及共表达分子伴侣,这2种方案都需要向酵母基因组中整合新的质粒片段,而这样的基因操作是有次数限制的:宿主能接受多少种筛选压力,类似的片段整合就能进行多少次。之前的研究中,有学者尝试针对一种抗生素通过不断提高其浓度反复进行电击转化,进而筛选多拷贝宿主,但这种方法极易产生假阳性,且筛选转化子的工作量非常大。对于毕赤酵母而言,能够被实际运用于基因工程的标记基因数量有限,进行多次基因操作时会受到限制,所以筛选经多次基因修饰的重组菌株时就会相对困难。同时,利用多个标记基因筛选重组菌株也会增加前期载体构建的复杂程度,因此可以通过有效地消除标记基因克服这些难题。利用无标记基因操作的方法可实现基因的敲入、敲除、定点突变等基因操作,筛选标记回收后还可以重复利用,从而对同一个宿主菌株进行多次基因修饰且不会引入多余的标记基因。牛硕等[44]利用kFPR1基因作为反向筛选标记,建立了一种适用于毕赤酵母的无标记基因操作方法,实现筛选标记在基因操作过程中的回收以及靶基因的成功整合,克服了筛选标记选择的限制,以实现外源基因在毕赤酵母中的高效合成。
3.3 蛋白降解模块
在表达外源蛋白期间,毕赤酵母的胞内或胞外都存在着蛋白酶。因此,大多数的外源蛋白都存在着被蛋白酶降解的风险。一旦被蛋白酶水解,不仅会使外源蛋白表达量大大降低,同时也会使其后续纯化变得十分困难。胞内蛋白酶主要降解蛋白质前体以产生具有活性的蛋白质,或者从膜上运输后切割蛋白质的信号肽,使调节蛋白、变异体或不需要的蛋白质失活,参与分解蛋白质,提供营养、前体和能量。胞外蛋白酶分泌的较少,主要分解某些蛋白质以提供营养,例如氨基酸和肽。
改造蛋白降解相关途径可大大减缓目的蛋白被降解的概率,从而提高产量。目前,最常用的避免蛋白酶降解的方式就是敲除相关蛋白酶的基因。近年来基因编辑技术作为代谢工程的一个重要工具受到广泛关注,除了传统的同源重组外,许多新型基因编辑技术也应运而生,比较热门的技术包括锌指核酸酶(zinc finger nuclease,ZFN)技术、类转录激活因子效应物核酸酶 (transcription activator-like effector nuclease,TALEN)技术和CRISPR/Cas(clustered regularly interspaced short palindromic repeats/Cas endonuclease)系统,其中CRISPR/Cas9系统是目前比较热门且使用较多的技术,其作用机制如图2所示。可利用CRISPR/Cas9编辑技术,通过外源DNA修复DNA双链断裂形式,让外源基因在某一个点发生突变,或利用gRNA串联形式可以同时对多个靶位点定点修饰。同时设计外源片段,可以定位插入到靶位点,实现毕赤酵母本身特定基因的插入、敲除、替换。谷洋[45]构建了RNA pol Ⅲ启动子控制下的CRISPR/Cas9系统用于高效表达人血清白蛋白,这一新系统的编辑效率高达80%。蒋秋琪等[46]使用CRISPR/Cas9技术分别敲除谷胱甘肽降解途径中的3个基因DUG1(YFR044c),DUG2(YBR281c)和DUG3(YNL191w)。其中,敲除DUG3基因的毕赤酵母,谷胱甘肽产量从160 mg/g提高到了224 mg/g。
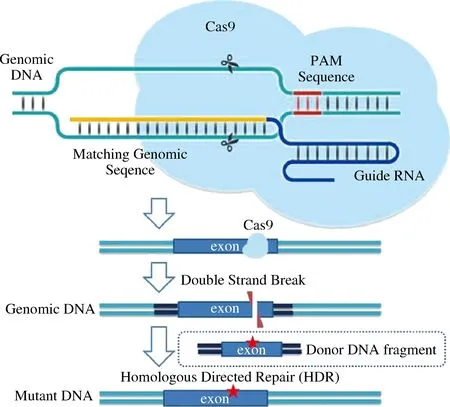
图2 CRISPR/Cas9的作用机制Fig.2 Mechanism of action of CRISPR/Cas9
避免被蛋白酶降解还可以向甲醇补料溶液中添加特异性蛋白酶抑制剂。SHI等[47]使用巴斯德毕赤酵母表达一种抗马氏杆菌丝氨酸蛋白酶抑制剂单链抗体时,发现添加丝氨酸蛋白酶抑制剂使发酵液的总蛋白酶活性降低了53%,而天冬氨酸蛋白酶抑制剂降低了总蛋白酶活性30%。
除了敲除蛋白酶基因和添加蛋白酶抑制剂以外,还可以将目的蛋白与蛋白酶抑制剂或者毕赤酵母中的稳定的蛋白伴侣共表达。此外,将目的蛋白运输至过氧化物酶体也可避免其被降解,只需在目的蛋白上连接一个过氧化物酶体靶向信号,这种方法同时减少了外源蛋白对宿主细胞可能具备的毒性副作用。
3.4 转运分泌模块
在毕赤酵母中重组蛋白分泌到胞外必须经过信号肽的引导。由于信号肽与目的蛋白融合表达,从而使目的蛋白在加工折叠后被引导分泌到胞外。常用的酵母信号肽有α交配因子信号肽(MF-α)、酸性磷酸脂酶信号肽(PHO1)、蔗糖酶信号肽(SUCZ)、Killer毒素信号肽和菊粉酶信号肽(INU)等。MF-α是毕赤酵母表达重组蛋白时应用最广泛的一种信号肽,最常用的分泌型表达载体pPIC9K和pPICZα-A的信号肽就是MF-α。MF-α对引导小分子多肽和蛋白的分泌非常有效,但对于引导大分子蛋白的分泌效果并不明显。研究表明,分泌信号肽是影响外源蛋白在毕赤酵母中表达的重要因素。苗杨利等[48]通过Signal P4.1在线预测软件预测出9种具有分泌潜力的毕赤酵母内源信号肽序列:FLO10、CPR5、PRY2、DSE4、NUP145、MSB2、SSP120、FRE2、FLO9。以MF-α信号肽为对照,考察这9种内源信号肽对EGFP和米黑根毛霉脂肪酶(RhizomucormieheiLipase,RML)在蛋白酶缺陷型Pichia PinkTM表达系统的分泌效果。结果发现FLO10、PRY2、DSE4、MSB2、SSP120、FRE2能有效介导EGFP分泌,且PRY2、DSE4、MSB2、FRE2介导EGFP的分泌水平优于MF-α,分别是MF-α的2.15倍、1.15倍、1.33倍、1.3倍;FLO10、PRY2、DSE4、FRE2能有效介导RML的分泌,且FLO10介导RML的分泌水平最高,是MF-α的1.5倍,证明了内源信号肽FLO10更能有效分泌RML。
N端信号肽的序列会影响蛋白易位进入内质网的效率,通过修饰N-末端或通过去除额外的接头肽可以提高外源蛋白分泌的效率。随着内质网蛋白的加工和折叠通量的增加,从内质网到高尔基体和细胞膜的下游运输通量已成为外源蛋白分泌和表达的瓶颈。可通过转运相关因子的过表达来改善下游分泌通量并增加外源蛋白的表达。毕赤酵母中分泌小泡蛋白Sec4的过度表达使米根霉来源的葡糖淀粉酶的分泌和表达增加了一倍。调节分泌和碳源反应相关基因的转录因子Aft1的过表达也可以显著增加外源蛋白的表达量。王儒昕等[49]采用共表达分子伴侣二硫键异构酶(protein disulfide isomerase,PDI)或转录因子Aft1的方法来提高重组人溶菌酶(human lysozyme,HLY)的表达量,共表达PDI的HLY表达量增加了8.3%,共表达Aft1的HLY的胞外总蛋白增加了46.5%。
4 展望
毕赤酵母作为一种重组蛋白表达系统,其比传统的原核表达系统具有许多显著优势,备受欢迎,针对毕赤酵母高效表达外源蛋白的优化改造等研究工作也陆续展开。研究人员已从外源基因表达盒、分泌途径、出发菌株、基因编辑与发酵过程控制等方面建立多种方法来提高表达效率。特别是在分子水平上,使用有效的分子操作方法和工具对毕赤酵母表达菌株和外源基因进行修饰,这样可以使外源基因更加适应宿主菌的表达偏好。从分子水平上改造外源基因的方法不仅节省了时间和成本,而且显著提高了目的蛋白在毕赤酵母中的表达效率,使蛋白表达量大幅增加。此外,还可通过啤酒酵母等相近酵母菌株合成天然大分子产物(如青蒿素、大麻二酚等)的实例得到启发,对于较难合成的外源蛋白如何在分子水平上对其基因或者宿主菌进行改造有了新思路。另一方面,基因组测序技术的发展,能够为非常规酵母提供完善的基因组注释信息。转录组学、蛋白质组学以及代谢组学等技术从宏观角度反映工程菌代谢网络信息,揭示工程菌体内调控模式,为代谢工程改造提供靶点。由于对毕赤酵母生理生化特性认识有限,在目前模式生物构建一碳同化效率低的背景下,从组学角度出发,可能能够更好地探索和阐释一碳同化机制,提高甲醇同化效率,为构建高效毕赤酵母细胞工厂提供指导。
分子生物学不断发展,各种相关技术也在不断推陈出新,研究人员将通过更多的途径以及更有效的分子操作方法和工具来改造毕赤酵母表达菌株,获得表达效果更好的生产菌株,相信未来会有更多稀有蛋白通过毕赤酵母被大量地生产出来。
