椰子油纳米微胶囊的性质表征及体外缓释分析
2022-09-16阚金涛弓淑芳王媛媛宋菲沈晓君
阚金涛,弓淑芳,王媛媛,宋菲,沈晓君*
1(中国热带农业科学院椰子研究所,海南 文昌,571339)2(海南省椰子深加工工程技术 研究中心,海南 文昌,571339)3(椰子国家工程研究中心,海南 文昌,571339)
椰子产品是海南省的一大区域特色,海南省椰子加工企业近700家,全产业链相关从业人员达200多万,产值超200亿元[1]。椰子产品主要有椰子汁、椰子糖、椰奶、椰子油、椰子酒、椰子酱和椰子系列烘焙产品等[2-3]。由于加工工艺、设备和成本等原因,椰子产品椰香味并不明显,需要额外添加椰子增香剂。常用的椰香味添加剂有椰子香精和椰奶香精,均以椰子醛作为主体香料,加入不同配比的香料调配制成的[4]。此类椰香味添加剂香味单一,具有很强的挥发性,香味难以持久,对光、热、氧敏感,易与其他组分反应,香型失真,消费者对化学类椰香味添加剂接受度不高[5]。这些问题限制了化学香精在椰子加工产品中的进一步应用。因此寻找一种天然、椰香味丰富、性质稳定椰香味添加剂是非常有必要的。初榨椰子油具有非常浓郁的椰香味,由醇类、酸类、酮类、酯类、醛类、烃类6种化合物构成椰子油特有的风味[6]。椰子油香味浓厚,直接作为食品增香剂在食品热加工过程中易与水分、氧气反应产生少量具有异味的物质,且其挥发性物质在热加工过程中大量逸失[7],因此需要寻找一种在热加工过程中防止椰子油氧化、香气挥发的方法。
纳米微胶囊技术具有改变物质性态,保护敏感成分,隔离活性物质,降低挥发性等优点[8-9]。微胶囊技术现已应用于食品增香剂中,壁材通过在口腔中溶解破裂释放香精,产生特殊风味[10],因此将椰子油进行微胶囊化后能够很好地解决椰子油作为椰香味添加剂的瓶颈问题。本实验将椰子油进行胶囊化,并对椰子油微胶囊进行理化性质表征以及体外缓释性能分析,以期为健康椰子产品增香添加剂提供技术支撑。
1 材料与方法
1.1 试剂与仪器
椰子油,中国热带农业科学院椰子研究所中试加工厂。明胶、阿拉伯胶,上海麦克林生化科技有限责任公司;NaOH、HCl、正己烷、胃蛋白酶、胰蛋白酶、KH2PO4,国药集团化学试剂有限公司。以上药品均为分析纯。
HH-2数显恒温水浴锅,金坛市精达仪器厂;FA2004B电子分析天平,上海越平科学仪器有限公司);ZNC-BS-T型恒温磁力搅拌器,河南爱博科技仪器有限公司;NS1001 L2K高压均质机,意大利尼鲁索尔维公司;ZN48超声振荡仪,上海易净超声波仪器公司;TU-1901紫外-可见分光光度计,北京普析通用仪器有限责任公司;Zetasizer Nano ZS90纳米粒度电位仪,英国马尔文仪器有限公司;Sirion200扫描电子显微镜,FEI香港有限公司;TGA 2热重分析仪,梅特勒-托利多仪器有限公司;DSC 131 EVO差示扫描量热仪,法国塞塔拉姆有限公司;傅里叶红外Nicolet iS 50光谱仪,美国热电尼高力仪器有限公司;892油脂氧化稳定分析仪,瑞士Metrohm公司;T 25 digital ULTRA-TURRAX®高剪切混合器,艾卡(广州)仪器设备有限公司。
1.2 实验方法
1.2.1 微胶囊的制备
称取质量比为6∶1的麦芽糊精和阿拉伯胶粉末,放入烧杯并加入适量双蒸水,麦芽糊精和阿拉伯胶粉与双蒸水质量比为11∶9,在50 ℃水浴下加热至完全溶解后作为壁材原料。将芯材椰子油与壁材按质量比为1∶2.5混合,在10 000 r/min条件下高速剪切分散5 min;水浴加热至40 ℃,以600 r/min的速度持续搅拌2 h使复凝聚反应完全。
1.2.2 微胶囊粒度分布测定
室温下,准确称取1 g椰子油微胶囊分散于800 mL去离子水中,超声2 min后使用激光粒度仪测定其粒径大小及其分布,重复3次。
1.2.3 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
分别称量50 mg阿拉伯胶、麦芽糊精与150 mg KBr充分研磨混合均匀后压片、烘干,于4 000~400 cm-1进行扫描。椰子油、微胶囊样品经液体测量池测定。
1.2.4 扫描电子显微镜(scanning electron microscopy,SEM)分析
将样品均匀分布在贴有双面胶的硅片上,并放置干燥箱内烘干;经离子溅射仪在样品表面进行喷金处理,抽真空后,对样品台进行观测,并保存需要的图像。加速电压5 kV。
1.2.5 透射电子显微镜(transmission electron microscope,TEM)测定
取少量微胶囊样品,置于去离子水中超声1 min,用移液枪滴于铜网上面,待干燥后进行TEM测定。
1.2.6 热重分析测定
分别称取10 mg微胶囊样品、椰子油、阿拉伯胶、麦芽糊精放入坩埚内,升温速率为10 ℃/min,N2流速20 mL/min,温度为30~600 ℃,测定微胶囊的热分解曲线。
1.2.7 差示量热扫描(differential scanning calorimetry,DSC)分析
取2 mg微胶囊样品于铝坩埚中压紧,测定样品的玻璃态转化温度(Tg)。检测条件:处理温度-20~220 ℃,以空坩埚为参照,记录样品的起始温度、峰值温度、终止温度和热焓。
1.2.8 椰子油微胶囊货架期的预测
利用Hasenhuettl经验公式对椰子油微胶囊产品的氧化稳定性进行分析[11]。利用油脂氧化稳定分析仪测定微胶囊在100、110、120 ℃的诱导期,测定条件:样品用量8 g;空气进样量20 L/h,温度达到设定值开始测量油脂氧化诱导期。
Hasenhuettl经验公式如公式(1)所示:
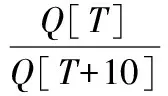
(1)
式中:Q,食品货架期;T,贮藏温度,℃。
1.2.9 体外缓释性能实验
参照梁博等[12]的方法测定微胶囊的体外缓释累计释放率。采用紫外-可见分光光度计在214 nm下测定体积分数分别为4、5、10、15、20 μL/L的椰子油正己烷溶液吸光度,建立椰子油浓度标准曲线。制备模拟胃液:将pH为1.5的HCl溶液加入1 g胃蛋白酶,混匀后,用孔径为0.2 μm的微孔滤膜过滤除菌。制备模拟肠液:将6.8 g KH2PO4溶于500 mL水,用0.1 moL/L的NaOH溶液调节pH至6.8,加入10 g胰蛋白酶,定容至1 000 mL,用孔径为0.2 μm的微孔滤膜过滤除菌。微胶囊体外缓释实验:将2 g椰子油微胶囊加入100 mL模拟胃液或肠液中,在37 ℃恒温下以200 r/min的速率搅拌。每隔4 min取样5 mL,过滤后用正己烷萃取滤液中的椰子油。实验重复3次。椰子油微胶囊在模拟胃液或模拟肠液中的累积释放率(Q)的计算如公式(2)所示:
(2)
式中:φ,胃肠液中椰子油的体积分数,μL/L;V,胃肠液中的总体积,mL;m,微胶囊中椰子油的总质量,mg。
1.2.10 体外缓释机理探究
椰子油微胶囊缓释动力学可以利用表1中3个缓释动力学模型对微胶囊在胃肠液中的释放数据进行拟合,探究最佳的释放模型[13-14]。

表1 体外缓释动力学模型Table 1 Sustained release kinetic model
2 结果与分析
2.1 微观形貌分析
图1-a、图1-b显示微胶囊为多球形不规则结构,含有少许的孔洞,可加快微胶囊的释放[15]。图1-c、图1-d所示微胶囊呈现多核无定边结构,芯材被分为多个部分封装在壁材中。综合可知,较小粒径的微胶囊聚集在一起并被封装再由壁材形成较大的多核微胶囊[16]。根据以上结论,芯材椰子油已成功地嵌入到壁材中,壁材为芯材提供保护作用。

a,b-SEM;c,d-TEM图1 微胶囊SEM及TEM扫描图像Fig.1 SEM and TEM scanning images of microcapsules
2.2 粒径分布
椰子油纳米微胶囊粒径分布如图2所示,微胶囊粒径大小主要集中在220.2~531.17 nm,3次测定粒径分别为373.0、383.2、378.0 nm,平均粒径为378.07 nm。粒径分布曲线呈现正态分布特征,且粒径分布范围相对较窄,表明微胶囊颗粒均匀[17]。
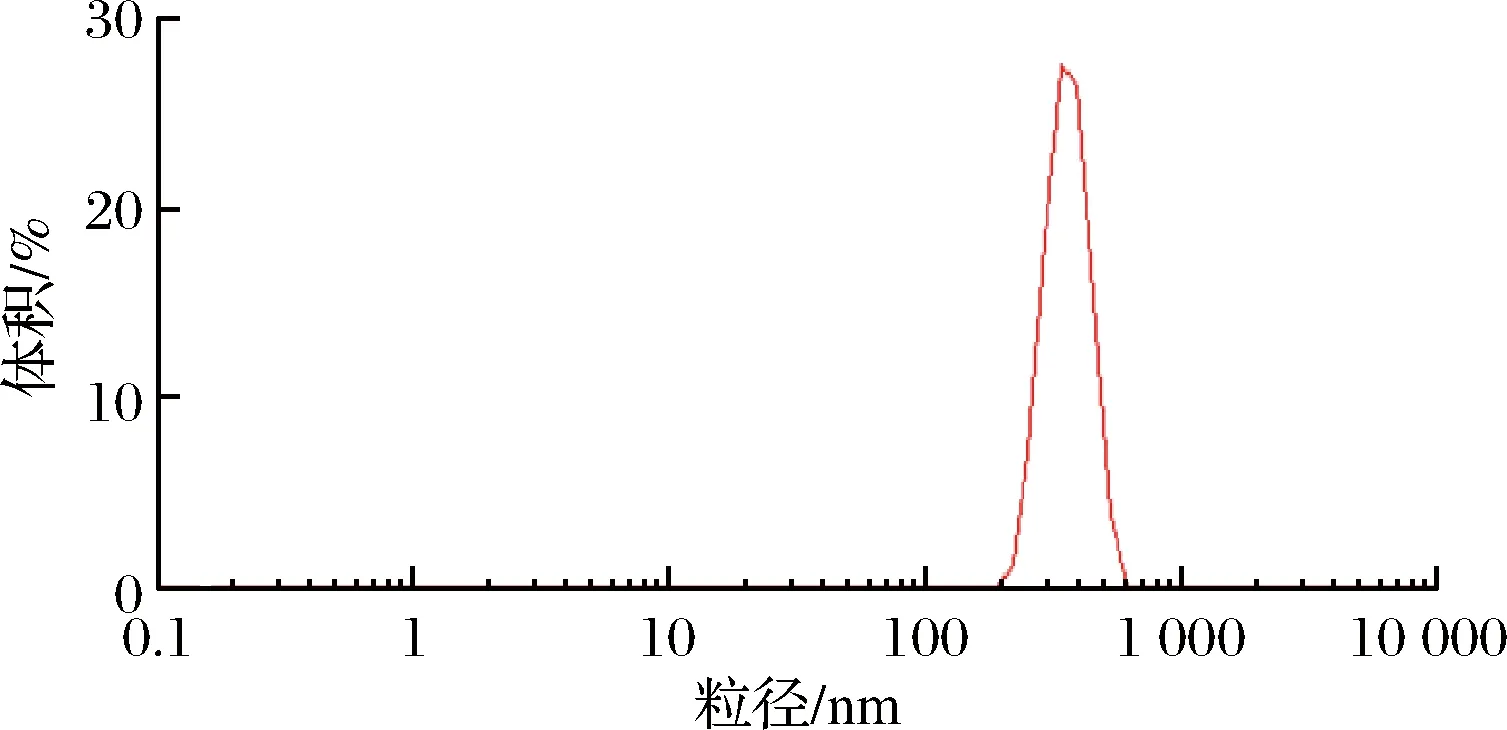
图2 椰子油微胶囊粒径分布图Fig.2 Particle size distribution of coconut oil microcapsules
2.3 椰子油微胶囊的表征与性能测定
麦芽糊精、阿拉伯胶、椰子油、椰子油纳米微胶囊的红外光谱数据如图3所示。椰子油纳米微胶囊在波数3 278.44、2 925.39、1 640.76、1 149.20、1 078.44、1 015.99、927.84 cm-1处有很强的吸收峰,最小透过率为24.23%。麦芽糊精在波数3 417.10、2 929.15、1 608.58、1 075.22 cm-1处的特征峰与微胶囊所对应的峰值非常接近,最小透过率为46.53%。阿拉伯胶在波数3 389.12、2 927.94、1 643.87、1 022 cm-1处的特征峰与微胶囊所对应的峰值吻合,最小透过率为34.14%。椰子油在波数2 922.96、2 853.95、1 742.89、1 152.49 cm-1处的特征峰与微胶囊所对应的峰值相符,最小透过率为36.2%。说明微胶囊中含有壁材和芯材,且椰子油微胶囊中没有出现除麦芽糊精、阿拉伯胶、椰子油外的其他特征峰,说明以麦芽糊精-阿拉伯胶为壁材的椰子油纳米微胶囊通过复凝聚法制备成功。
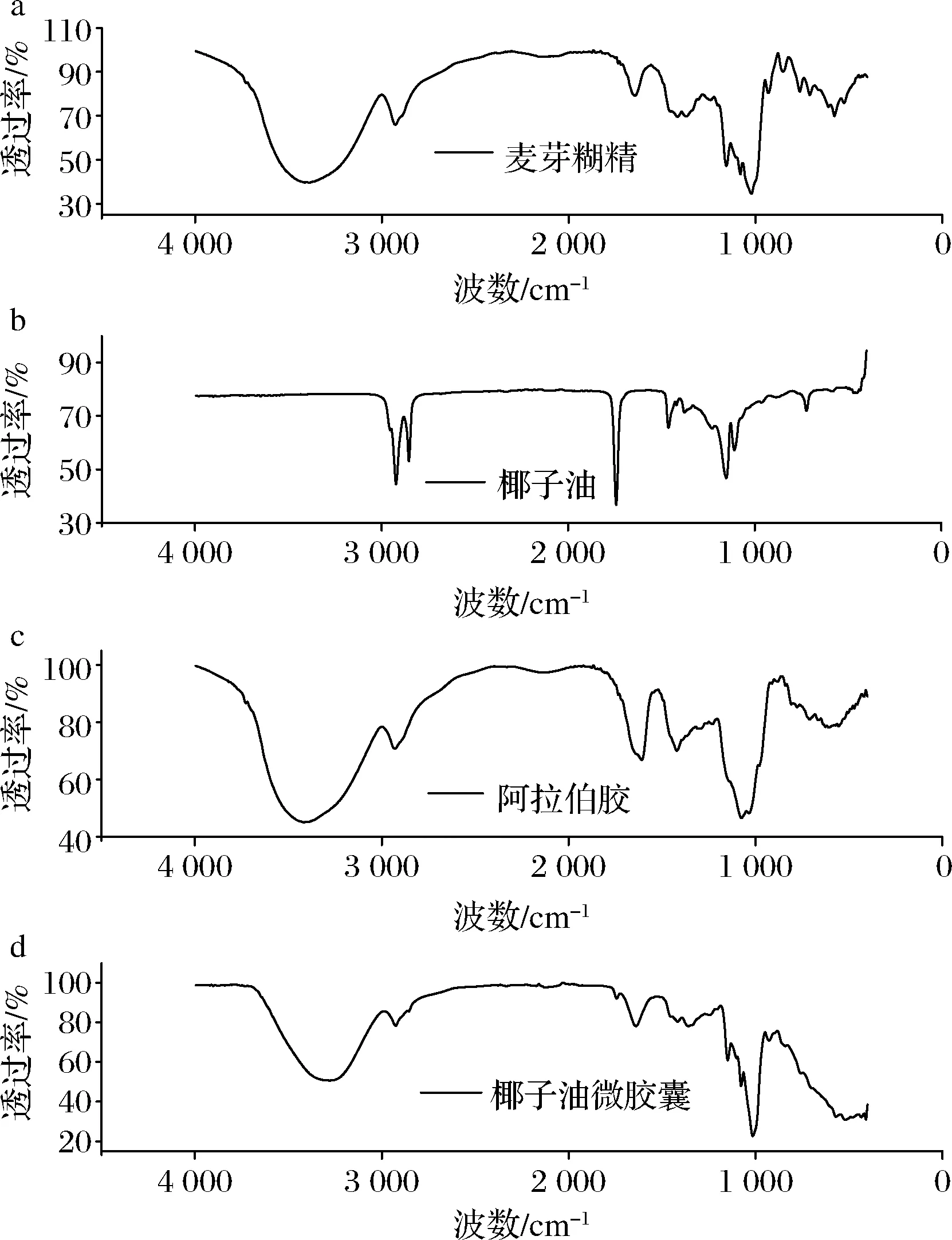
a-麦芽糊精;b-椰子油;c-阿拉伯胶;d-椰子油微胶囊图3 麦芽糊精、阿拉伯胶、椰子油和椰子油微胶囊FTIR谱图Fig.3 FTIR spectra of gelatin, gum Arabic, coconut oil and coconut oil microcapsules
2.4 热重分析
麦芽糊精、阿拉伯胶、椰子油、椰子油微胶囊的热重曲线如图4所示。麦芽糊精在167.42~492.16 ℃阶段迅速分解,质量损失为69.47%。阿拉伯胶的热重分析曲线表明,在第一失重阶段(30.92~151.09 ℃)少量分解,失重16.66%,这主要是阿拉伯胶的水分蒸发引起的;在第二失重阶段(162.49~473.98 ℃),曲线斜率较大,失重为58.11%,这是由于阿拉伯胶分解造成的。椰子油在227.81~439.17 ℃迅速分解,质量损失为99.46%。椰子油微胶囊在74.68 ℃之前有1%左右的损失量,这可能是微胶囊表面残留及吸附空气中少量的水分导致的,在第一失重阶段(74.68~180.97 ℃)内较快分解,失重为17.58%,这可能是椰子油和壁材脱离造成椰子油释放导致的。第二阶段(183.75~340.57 ℃)大量分解,失重为45.80%,可能是中间产物进一步裂解炭化引起的。第三阶段(342.73~429.00 ℃)少量分解,失重为15.62%,已完全炭化分解。壁材、芯材之间的静电作用、物质间氢键的存在提高了微胶囊的热稳定性[18],说明复合壁材的存在明显提高芯材的热稳定性。这与梁博等[12]的研究结果一致。
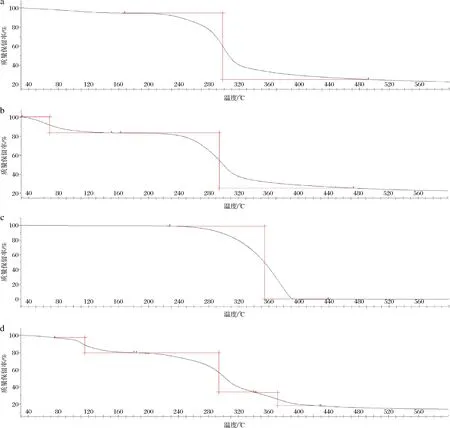
a-麦芽糊精;b-阿拉伯胶;c-椰子油;d-椰子油微胶囊图4 麦芽糊精、阿拉伯胶、椰子油、椰子油微胶囊的热重曲线Fig.4 Thermal decomposition curves of maltodextrin, gum arabic, coconut oil, and coconut oil microcapsules
2.5 差示扫描量热分析
玻璃转化温度(Tg)是衡量微胶囊热稳定性的重要指标[16]。由图5可知,阿拉伯胶、麦芽糊精、椰子油、椰子油微胶囊的Tg分别为64.26、62.38、24.00、113.85 ℃,熔解焓分别为287.0、401.1、121.4、393.4 J/g。椰子油微胶囊的Tg和熔解焓均比壁材、芯材要高,这可能是在形成微胶囊的过程中壁材阿拉伯胶、麦芽糊精之间形成静电作用黏合,从而提高了椰子油纳米微胶囊的Tg和熔解焓[19]。此外,微胶囊DSC分析曲线(图5-d)出现的峰数同微胶囊热分解次数(图4-d)是相对应的。微胶囊满足在常规热加工中热稳定性的要求。
2.6 货架期预测
货架期加速试验是通过提高食品的贮藏温度,在短时间内加速食品劣变过程来预测食品的货架期的,可比较各物质间的氧化稳定性。分别测定100、110、120 ℃条件下椰子油微胶囊的氧化诱导期,微胶囊的诱导期(ln) 与温度存在线性关系。ln(诱导期)与温度的方程为y=-0.082x+12.82,R2=0.956。根据方程式外推出椰子油纳米微胶囊在25 ℃的预测货架期为5.43年。而椰子油在常温下的货架期为4.16年[20],间接证明芯材椰子油已成功地嵌入到壁材中,壁材为芯材提供保护作用,延长了芯材的货架期。
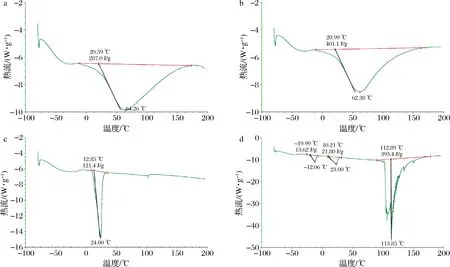
a-阿拉伯胶;b-麦芽糊精;c-椰子油;d-椰子油微胶囊图5 阿拉伯胶、麦芽糊精、椰子油、椰子油微胶囊的DSC曲线Fig.5 DSC curves of maltodextrin, gum arabic, coconut oil, and coconut oil microcapsules
2.7 体外缓释性能分析
椰子油正己烷溶液在波长214 nm的标准曲线方程为Y=0.037 6x+0.351(R2=0.997)。椰子油微胶囊体外缓释累计释放率如图6所示。
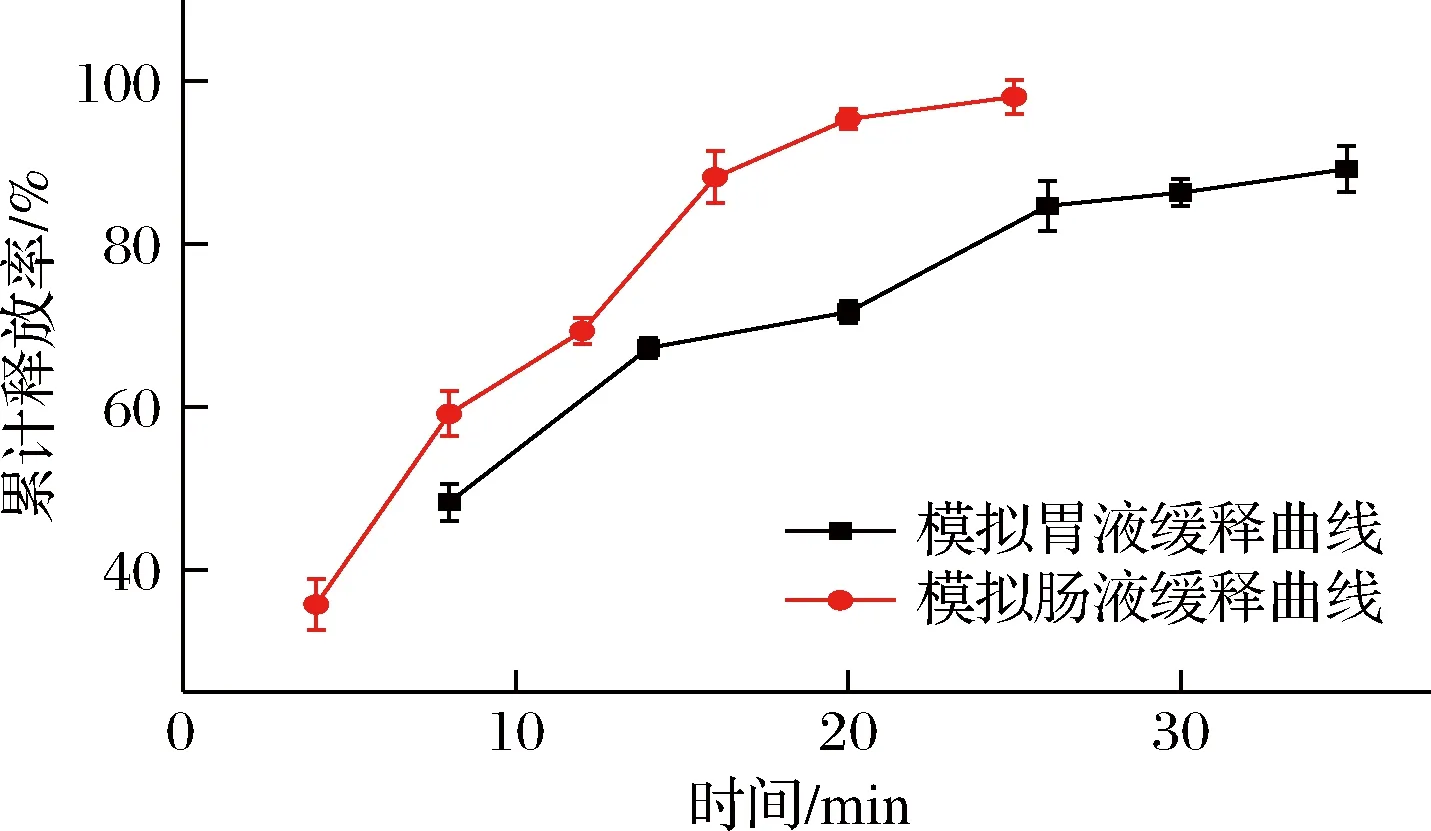
图6 椰子油纳米微胶囊在模拟胃液、模拟肠液 中的缓释拟合曲线Fig.6 Fitting results of the slow-release model of ccoconut oil microcapsules in the simulated gastric juice and simulated intestinal juice
椰子油微胶囊在模拟肠液的累计释放率高于其在胃液的释放率,这可能是胰蛋白酶在偏碱性的模拟肠液中作用于壁材氨基酸的羧基肽键,破坏壁材结构,使得椰子油能够被快速释放[21]。微胶囊在模拟肠胃液的释放过程一般持续4~60 h[22-23],而椰子油微胶囊15 min内在模拟胃肠液中就已释放65%以上芯材,说明微胶囊具有短时释放的特点,这可能是在37 ℃下壁材中的麦芽糊精和阿拉伯胶在水溶剂中有较大的溶解度并在搅拌的情况下快速溶解释放出椰子油造成的。
椰子油微胶囊缓释模型拟合结果如表2所示,从模拟胃液消化模型的相关性R2得出,Peppas释放模型>Higuchi 释放模型>零级释放模型,椰子油微胶囊在胃液中符合Ritger-Peppas[12,24]释放模型,相关性R2为0.959,参数n为0.39,说明椰子油微胶囊释放为Fickian自由扩散机制,在35 min内,累计释放率为89.23%。从肠液的消化模拟模型的相关性R2可知,椰子油微胶囊在肠液中符合Huguchi释放模型,相关性R2为0.965,为凝胶层扩散和骨架溶蚀释放机制。从R2可以看出微胶囊的释放与零级释放模型和Huguchi释放模型同样密切相关,实际上微胶囊芯材释放过程复杂,芯材的释放过程也与壁材降解和胃肠液中微胶囊含量有关[25]。
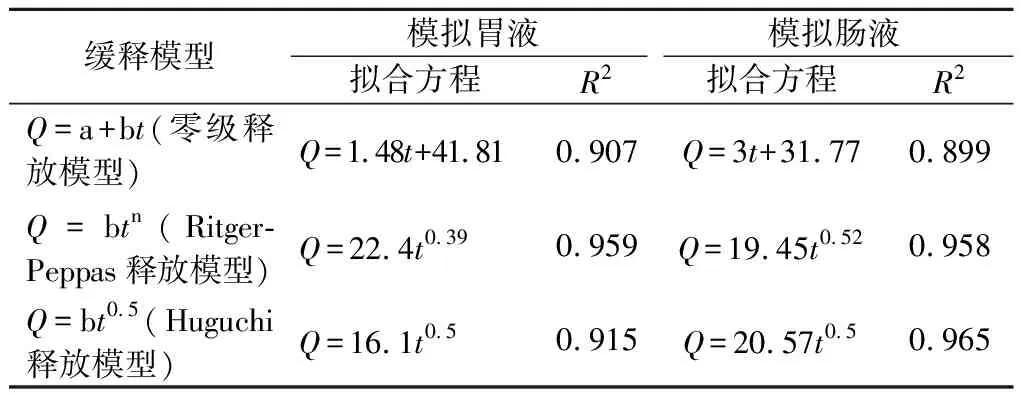
表2 椰子油微胶囊释放动力学拟合结果Table 2 The release kinetics fitting results of coconut oil microcapsule
3 结论
本实验以阿拉伯胶和麦芽糊精为壁材,初榨椰子油为芯材,利用复凝聚法制备椰子油纳米微胶囊作为椰香添加剂。FTIR结果表明微胶囊制备成功,SEM、粒度分析表明微胶囊呈多球形不规则、多核无定边结构,平均粒径约为378.07 nm。热重分析、差示热量扫描分析以及货架期预测结果表明椰子油微胶囊有较好的热稳定性,货架期为5.43年。体外缓释性能分析表明,芯材具有短时快速释放的特点,椰子油纳米微胶囊在胃液的释放为Fickian自由扩散机制,在肠液中符合Huguchi释放模型,为凝胶层扩散和骨架溶蚀释放机制。理化性质和体外缓释表明,该实验制备的椰子油纳米微胶囊具有开发应用的前景,可以为椰子产品加工在天然、健康的椰香味添加剂方面提供更为健康的选择。
