经导管肾上腺消融术治疗原发性醛固酮增多症相关 高血压:现状与展望
2022-09-16祝之明
祝之明
原发性醛固酮增多症(primary aldosteronism,PA)是常见的继发性高血压,其罹患率在难治性高血压患者中可达15%~20%,但国内外高血压患者中PA的筛查率不足1%,大量PA患者仍按普通高血压治疗[1-3]。PA易导致难治性高血压,如诊断与治疗不及时,将显著增加远期卒中、心肌梗死、心房颤动和心力衰竭的风险[3-6]。PA的主要治疗措施有药物治疗与肾上腺手术切除,但临床常有药物疗效不佳或不能耐受药物的不良反应、不愿手术或无手术适应证的PA患者,有些PA患者即使做过手术,但手术疗效不佳。因此,对传统治疗效果不好或失败,应采用何种适宜的措施控制PA是临床亟待解决的问题。近年来国内外探索肾上腺消融治疗PA取得了一些成效[7],为PA治疗开辟了新的路径。为此,本文侧重介绍肾上腺消融治疗PA的临床现状及发展前景。
1 PA分型及现有治疗的局限性
PA根据病因的不同可分为六型,即醛固酮瘤、特发性醛固酮增多症(特醛症)、原发性肾上腺皮质增生、家族性醛固酮增多症、醛固酮癌和异位醛固酮分泌瘤,临床上醛固酮瘤约占35%,而特醛症约占60%[3]。1957年美国密歇根大学的Baum医师开展了世界上首例开腹醛固酮瘤切除术,开创了PA患者的手术治疗[8]。1958年醛固酮受体拮抗剂螺内酯问世,随即用于治疗PA[9]。上世纪七十至九十年代陆续有个案和小样本临床试验釆用经导管化学消融治疗醛固酮瘤。进入二十一世纪,随着影像技术的发展,在计算机断层显像(computer tomography,CT)、超声、核磁共振成像(magnetic resonance imaging,MRI)引导下经皮穿刺的物理消融术治疗醛固酮瘤逐渐增多,并引起临床关注[10-11]。但总的来说,逾半个世纪PA治疗进展滞缓,药物干预与腹腔镜微创手术仍为PA治疗的主流。目前临床上对PA的治疗措施选择主要依据肾上腺CT影像学分型,判断为腺瘤或增生/结节,对经 肾上腺静脉取血(adrenal venous sampling,AVS)明确肾上腺有优势分泌的PA患者,推荐手术;对无优势分泌者建议醛固酮受体拮抗剂治疗[1-2]。国外调查发现,只有13%的临床中心按PA诊治指南流程进行术前AVS检查[12],而国内的比例更低。大多数中心主要依据肾上腺CT影像学结果决定治疗方案,荟萃分析表明:肾上腺CT与AVS的符合率仅为50%,只依据CT结果确定治疗方案,将导致37.8%的PA患者误诊误治,其中14.6%患者做了不必要的手术,19.1%患者本该手术却没做,3.9%的患者手术误切[13]。一项国际多中心1 625例PA患者的回顾性队列分析显示,经AVS证实醛固酮瘤和单侧肾上腺增生存在优势分泌的PA患者,手术治疗可使其高血压完全缓解率明显高于未经AVS、仅依据影像学结果而直接手术者(40.0%比30.5%,P=0.027)[14]。多项临床试验证实外科手术在减少远期心脑肾血管事件、降低血醛固酮水平、减少药物的用量方面优于醛固酮受体拮抗剂[15-17]。目前国内外指南对PA患者是否行AVS检查的推荐是患者有无手术意愿。显然患者自身很难做出决定,主要听取医师建议。而未行AVS时,医师也无法判断有无优势分泌。因此,指南的这种推荐似乎是一种鸡与蛋谁先有的悖论。现国外的一些内分泌学者建议,凡无禁忌或特殊情况,均可建议PA患者行AVS检查[14,16-17]。因AVS操作有一定技术难度,结果解释缺乏统一标准,故仅在少数临床中心开展,这限制了PA的精准诊治[18]。
国外多中心大系列研究显示,手术治疗可使约37%PA患者的高血压达到临床治愈,但仍有相当一部分PA患者经手术治疗后仍有高血压,这可能与合并原发性高血压、心脑肾损伤严重、老年、合并代谢紊乱等因素相关[6]。虽然外科手术安全有效,是功能性肾上腺瘤首选的治疗措施,但新近对上百例PA患者的术后分析表明,出现肾上腺皮质功能减退者达27%,其中重度为13%,中度为14%,1%发生肾上腺危象,上述患者中70%需激素替代治疗[19]。PA的药物治疗也有诸多问题:(1)缺乏长期大系列有关醛固酮受体拮抗剂的前瞻性随机对照试验,且其降压效果弱[3-4];(2)国外对长期醛固酮受体拮抗剂治疗的PA患者回顾性随访发现,其远期重大心血管事件的风险为原发性高血压组的两倍,且全因死亡率更高,尤其治疗后PA仍存在肾素抑制者[5];(3)要解除肾素抑制状态,需长期高剂量的螺内酯干预,但药物可产生一系列不良反应,如高血钾(尤其在肾功能不全时)、胃肠道反应、男性乳房发育及性功能减退、女性月经紊乱、乳腺刺痛及中枢神经症状等[3-4],导致患者更改治疗方案;(4)醛固酮受体拮抗剂仅在受体水平阻断其作用,因而不能减少血醛固酮水平,且醛固酮尚有受体非依赖的作用,上述因素造成了醛固酮受体拮抗剂的临床应用依从性不理想。
2 经导管肾上腺消融术治疗PA的病理生理基础
PA最重要的病理生理特征为肾上腺皮质病理性分泌过量醛固酮,且这种高醛固酮分泌不被盐反馈性减少,从而使机体肾素-血管紧张素系统活性受到抑制,导致体内水钠潴留、排钾增多、血容量增加,产生高血压和低钾血症[3]。因此,PA治疗的主要目标为消除高醛固酮血症及其相关高血压和生化异常[18]。除传统药物干预和手术治疗外,近年来在影像学技术引导下,先后推出经皮导管化学栓塞、射频、微波、激光、冷冻等物理消融技术治疗醛固酮瘤[7,10-11,20]。例如,已完成及正在进行中的醛固酮瘤射频消融临床试验(NCT02756754,NCT03405025)。各种消融技术的基本原理是利用物理产热或制冷使组织温度快速变化,从而损毁组织和细胞,或化学溶剂侵蚀凝固蛋白导致细胞的死亡和溶解,从而减少醛固酮的分泌。消融治疗与药物治疗相比,最大的优点是能减少血醛固酮的水平及药物用量,如术前结合AVS功能定位则术后疗效更佳[7,10-11,20]。影像引导下经皮细针穿刺的物理消融的主要局限性有:手术需要全麻,只能针对比较大的腺瘤,较小的腺瘤存在定位和穿刺困难,消融部位受毗邻组织的限制,尤其邻近大血管,可能会导致腹膜后血肿等不良事件[7,10-11,20]。经导管化学消融术的主要难点在于肾上腺动脉的寻找,因血管较细,时有解剖变异,操作有一定难度。另外,消融剂的选择,有报道用栓塞剂和组织破坏药物,但综合比较无水乙醇多用,也更物美价廉[11,21]。有学者将经导管化学消融术称为肾上腺动脉栓塞术。但笔者认为无水乙醇不仅引起肾上腺供血动脉栓塞,随血流分布还会导致一定范围的组织损毁,因此,称之肾上腺动脉消融术或经导管肾上腺消融术更贴切。
3 经导管肾上腺消融术治疗PA的适应证、禁忌证与方法
肾上腺消融术适合于经药物治疗无效,或不能耐受药物不良反应、不愿外科手术、或有手术风险、或无手术适应证或手术失败的PA患者,在患者充分知情同意情况下,且术前完成AVS分型定位,明确存在单侧优势分泌者,方可行肾上腺消融术[18]。PA常见的临床亚型有醛固酮瘤和特醛症,罕见亚型为家族性醛固酮增多症和醛固酮癌等[3-4],肾上腺消融适用于前二者。虽然肾上腺优势分泌更常见于醛固酮瘤患者,但国外及本高血压与代谢病中心在肾上腺无影像学变化的特醛症患者中,经AVS检测出19%~38%有优势分泌。因此,下述情况PA患者不行AVS可能会造成误诊误治:双侧肾上腺无影像学变化,但一侧高分泌; 一侧影像学改变,但对侧高分泌;双侧均有影像学变化,但仅有一侧高分泌,这些PA患者仅用药物治疗消除不了高醛固酮血症[22-23]。经导管肾上腺消融术的禁忌证主要包括:对比剂或栓塞剂过敏,严重肾功能不全[估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<45 ml/(min.1.73 m2)],严重心功能不全[纽约心脏病协会(New York Heart Assdciation,NYHA)心功能分级Ⅲ~Ⅳ级],脑血管结构异常有出血风险,血压>180/110 mmHg(1 mmHg=0.133 kPa),凝血功能障碍,妊娠期或哺乳期妇女。肾上腺消融术的大致流程为:导管经桡或股动脉路径,随后以超滑导丝引导送入导管,于12胸椎及第1腰椎水平行血管造影了解病变肾上腺的主要供血动脉的分布走向,肾上腺一般由肾上腺上、中、下三支动脉供血,但时有解剖变异,操作时应注意区分膈下动脉及脊髓动脉。确认病变肾上腺动脉血管走行后,以导丝配合微导管超选择性肾上腺动脉,经微导管造影确保微导管头端选择性置于病变部位的肾上腺动脉内并已阻塞进入靶部位的动脉血流。经整体交换型球囊的输送导管直接推注无水乙醇。栓塞后5 min左右肾上腺动脉造影复查,如肾上腺动脉内无前向对比剂通过表明该供血动脉栓塞成功,如仍有前向对比剂通过,需重复之前的操作再次行栓塞治疗,直至目标肾上腺动脉无血流通过[11,18,21]。由于无水乙醇的刺激、疼痛应激,及肾上腺组织破坏释放儿茶酚胺等因素,术中血压升高、心率增快常见,为避免高血压危象及脑病,术前应控制好高血压,如术中血压剧烈升高,应及时处理。少数患者术中可能因疼痛引起的迷走神经张力增高导致血压和心率降低,可静脉推注或肌内注射阿托品,如血压仍低可用多巴胺静脉滴注。术后不良反应主要有胃肠道反应,如恶心、呕吐、腹胀,及短时腰背部疼痛等,予对症处理[11,18,21]。
4 PA相关高血压经导管肾上腺消融治疗的临床证据
目前国际上已有评估PA手术疗效的原醛症外科手术效果(primary aldosteronism surgical outcome,PASO)标准,即:完全缓解,治疗后停服降压药,血压与生化(血钾、醛固酮及血醛固酮与肾素比值)正常;部分缓解,相同血压下所需降压药减少,或维持原有治疗药物时血压及生化明显改善;无缓解,与治疗前相比血压与生化无改善,或治疗药物增加,并建议术后6、12个月评估上述指标[6]。经导管肾上腺消融术可依此标准评估疗效。
2020年我们团队对40例PA患者行经导管肾上腺消融术,其中36例为特醛症,4例为外科醛固酮瘤切除复发者。依PASO标准,特醛症患者术后9例(25.0%)达到高血压完全缓解,13例(36.1%)达到高血压部分缓解;16例(44.4%)达到生化完全缓解;消融术后6个月,诊室血压和平均动态血压分别降低17/7 mmHg和11/2 mmHg[24]。经导管肾上腺消融术的疗效是否优于传统药物治疗尚未明确,为此我们开展了随机对照试验,入选60例PA患者,随机分为螺内酯(20~60 mg/d)为基础的药物治疗组和肾上腺消融组。结果表明,治疗第一个月肾上腺消融组的血压下降幅度大于药物治疗组,随访6个月,两组诊室和动态血压的变化值差异无统计学意义,但血醛固酮水平与降压药物限定日剂量在肾上腺消融组明显减少,而药物治疗组有所增加;肾素抑制解除率在肾上腺消融组也优于药物治疗组(60%比30%,P<0.05)。依PASO评估标准,肾上腺消融组血压和生化的完全和部分缓解率均达到81%,值得关注的是药物治疗组52%患者发生药物相关的不良反应[25]。2021年Dong等[26]也报道了39例特醛症患者经超选择性肾上腺动脉化学消融治疗,随访1年,获得良好的疗效。最近荟萃分析比较了肾上腺消融术与微创腹腔镜术治疗醛固酮瘤的疗效,结果显示肾上腺消融术的高血压缓解率与外科手术相当,但可明显缩短手术及住院时间,及减少手术出血量[27]。近年经导管去肾交感神经(renal denervation,RDN)治疗难治性高血压颇受关注,也有许多临床研究报道,R D N主要通过射频、超声或注射乙醇,阻断肾交感神经的激活,减少交感神经对肾血管阻力、肾素释放和肾小管钠离子的重吸收,达到降压效应。虽然已有大量RDN降压疗效的临床证据,但尚未被国内外重要的高血压防治指南所推荐,RDN也主要针对原发性难治性高血压[28],而肾上腺消融则适宜于继发性难治性高血压,且尚在临床证据积累阶段,需要开展多中心随机对照临床试验,提供更多有效性、安全性的证据,明确其对远期心脑血管事件的作用,二者的临床治疗特点见表1。
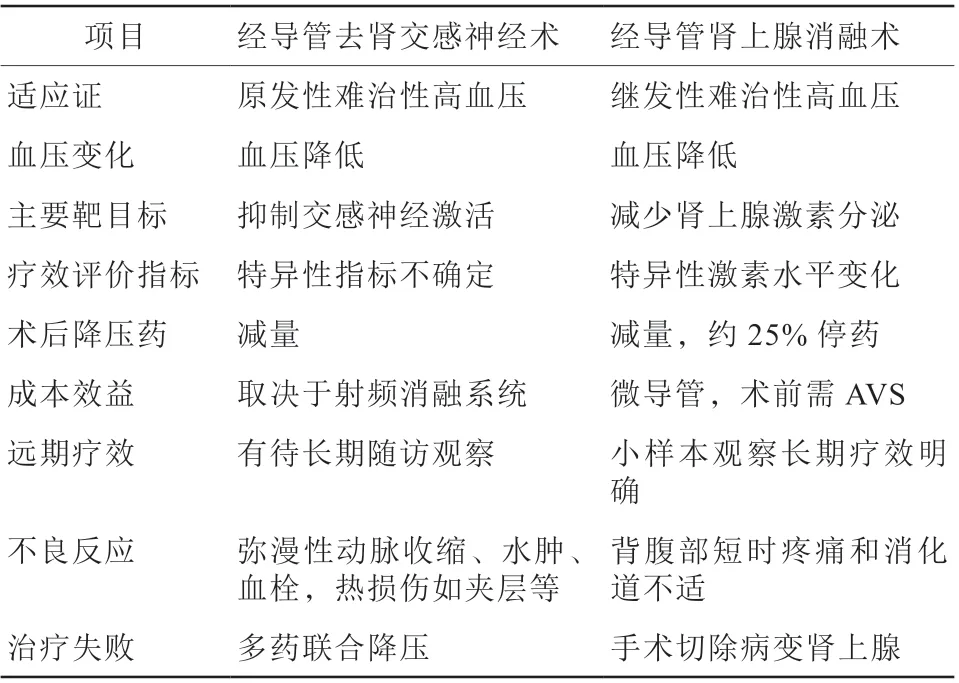
表1 经导管去肾交感神经术与经导管肾上腺消融术治疗高血压的比较
5 存在问题及临床应用展望
目前的临床证据和经验提示,经导管肾上腺消融术治疗PA是对传统药物和外科手术治疗的一种重要补充,并非替代现有PA的药物及外科手术治疗。尤其值得指出的是,经导管肾上腺消融术仅适用于传统治疗失败或不接受传统治疗的PA患者,不宜盲目扩大治疗适应证。经导管肾上腺消融术具有安全及不良反应少、疗效确切的特点,对肾上腺消融术后疗效不佳者,可推荐进一步手术治疗。目前,肾上腺消融术多由介入科、心内科或高血压科独立开展,但PA属内分泌疾病,其诊断处理原则仍必须遵循PA的临床实践指南,需内分泌代谢科医师积极参与,甚至主导。国内外已报道的一些肾上腺消融研究结果显示,由于受专业限制,PA筛查流程不规范,一些重要的检查结果缺如,如术前AVS和术后激素的复查,这将影响PA的精准治疗[18]。2020年意大利高血压实践指南已将肾上腺消融术治疗PA作为临床Ⅱ类推荐,证据水平为B级[29],表明这类新的PA治疗方法正逐步获得临床的认可。美国临床内分泌协会、欧洲内分泌学学会及中国成人肾上腺皮质肿瘤治疗临床实践专家共识或指南建议对不适合手术治疗的肾上腺肿瘤患者,局部消融治疗也是一种选择[30-32]。
利益冲突作者声明不存在利益冲突
