生防菌D25与嘧环·咯菌腈复配对番茄灰霉病防治的增效作用
2022-09-16郑丽宁顾学虎许煊炜王迎春
黄 鑫,郑丽宁,顾学虎,许煊炜,张 浩*,王迎春
(1. 吉林农业大学植物保护学院,长春 130118;2. 农业农村部人参鹿茸监督检验测试中心,长春 130118;3. 吉林省白城市农业科学院,白城 137000)
番茄灰霉病是由半知菌亚门灰葡萄孢Botrytis cinerea引起的一种真菌性病害。灰霉病菌致病能力较强,一旦侵入番茄组织就会迅速让植株产生病状并能够快速产生新的分生孢子进行多次侵染[1]。低温、高湿有利于该病害的发生[2],在春冬季节易发生、甚至暴发,可导致果实减产 20%~30%,病害发生严重时可减产 50%~60%[3]。该病害在番茄产后贮存和运输过程中依然可以发生,一旦条件适宜,番茄灰霉病菌就会大量繁殖导致果实腐烂,进而造成严重的经济损失[4]。
目前,喷施化学农药是防治番茄灰霉病的主要方法[5],但长期大量使用杀菌剂会产生一系列问题,如危害人类健康、破坏生态环境、使灰霉病菌产生抗药性等。纪明山等[6]报道从辽宁省田间采集的番茄灰霉病菌对腐霉利的抗性频率已经达到84.84%,对嘧霉胺的抗性频率已高达100%;冯宝珍等[7]报道山西运城地区的番茄灰霉病对啶酰菌胺的抗性频率已经达到77.14%。筛选高效、低毒防治药剂和防治方法成为目前生产中防治番茄灰霉病急需解决的问题[8]。生防菌具有低毒、高效等特点,目前已经被广泛研究,但因其受环境影响较大,防治效果不稳定,使得其在农业生产中的应用受到限制[9];部分杀菌剂对真菌的抑制作用强,对细菌几乎无抑制作用,因而采用生防细菌与杀菌剂复配可能是一种有效防治番茄灰霉病的措施[10]。前人研究表明部分化学杀菌剂与生防菌联合使用可在降低农药使用量的同时提高防效,如王兵[11]报道以25%氰烯菌酯与绿色木霉LZT-3联合使用防治水稻恶苗病、以25%嘧菌酯与长枝木霉CZT-2联合使用防治纹枯病、以 50%醚菌酯与枯草芽胞杆菌 ZKC-1联合使用防治胡麻斑病和稻瘟病有明显的增效效果,其抑菌率分别可达94.96%、86.82%和95.00%;陈美云[12]将枯草芽胞杆菌LV与99%噁霉灵联合使用对生姜茎基腐病的防病效果可达到77.32%,同时具有一定的促生作用;张萌等[13]使用荧光假单胞菌YG-1与啶酰菌胺联合使用防治番茄灰霉病,可减少一半施药量且防效可达 71.31%,较啶酰菌胺单剂提高了 22.45%;Ji等[14]将氟醚菌酰胺与甲基营养型芽胞杆菌TA-1联合使用,使田间番茄灰霉病发病率降低20%左右。生防菌和化学杀菌剂复配在一定程度上解决了用药量过多导致病原菌抗药性急剧增长和生防菌见效慢的问题。
生防菌D25是从番茄根际土壤中分离得到的菌株,属于泛菌属,对番茄灰霉病有较强防治作用[15]。为了减少化学杀菌剂用量,同时提高生防菌的防治效果,本研究从12种杀菌剂中筛选出与生防菌D25具有较好生物相容性的杀菌剂,明确了复配的最适配比及其防病效果,为番茄灰霉病的科学防治提供依据。
1 材料与方法
1.1 试验材料
供试菌株:番茄灰霉病菌Botrytis cinerea和泛菌Pantoea jilinensisD25,由吉林农业大学农药生测实验室分离保存。
PDA培养基:马铃薯200.0 g、葡萄糖 20.0 g、琼脂20.0 g、蒸馏水1000 mL。LB培养基:胰蛋白胨10.0 g、酵母浸粉5.0 g、氯化钠 10.0 g、琼脂15.0~20.0 g、蒸馏水1000 mL。
供试番茄品种:京丹绿宝石2号,由吉林农业大学植物保护学院提供。
供试杀菌剂见表1。
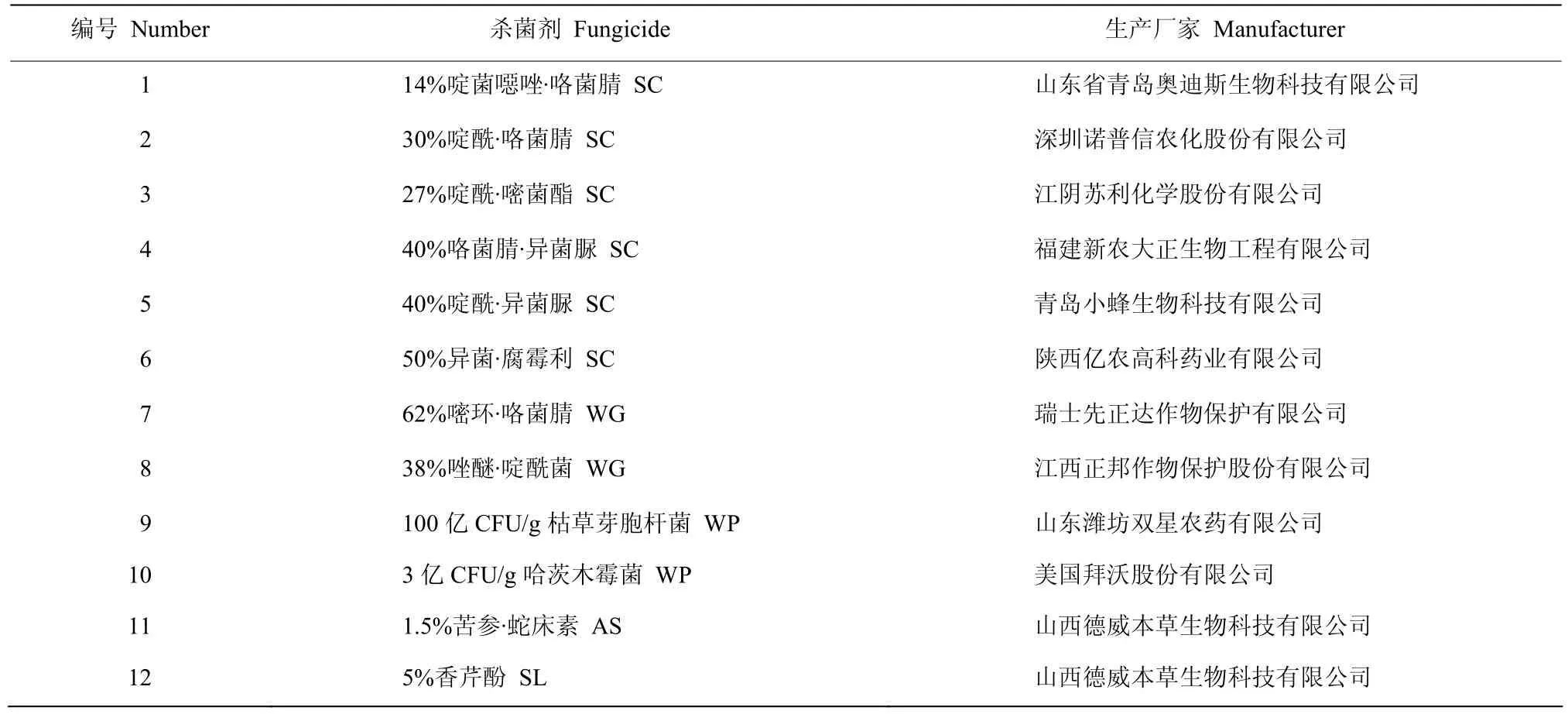
表1 供试杀菌剂Table 1 The tested fungicides
1.2 试验方法
1.2.1 不同杀菌剂对番茄灰霉病菌的室内毒力测定 采用含毒介质法[16],测定 12种杀菌剂对番茄灰霉病菌的抑制率。向冷却至50 ℃的PDA培养基中加入配制好的不同浓度梯度的药液(表2),混合均匀后倒板,对照组平板使用无菌水制备。将直径为5.0 mm的番茄灰霉病菌饼接种在制备好的含药PDA平板中央,每个浓度重复3次,于25 ℃黑暗条件下培养5~7 d后测量真菌菌落直径,计算抑菌率[17,18]。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。

表2 杀菌剂的浓度梯度Table 2 The concentration gradient of fungicide
1.2.2 泛菌D25与杀菌剂相容性测定 对番茄灰霉病菌毒力较高的杀菌剂,测定其与泛菌D25的相容性。采用混和平板法测定微生物杀菌剂与泛菌D25的相容性[19]。具体方法如下:向已冷却至50℃左右的90 mL PDA培养基中加入10 mL OD600=1.48的泛菌D25菌悬液,混和均匀后倒板,然后分别吸取配置好的10 μL枯草芽胞杆菌和哈茨木霉菌菌液点在平板中央,28 ℃黑暗条件下进行培养,48 h后观察有无抑菌圈出现。采用平板计数法测定泛菌D25与化学杀菌剂的相容性。在LB平板中加入化学杀菌剂,使其终浓度为50、100、150、200、250 mg/L;将1 mL OD600=1.48的泛菌D25菌液进行10倍系列稀释6次,取100 μL稀释后的菌悬液均匀涂布于LB平板上,以无菌水为对照,28 ℃黑暗条件下培养,48 h后测定泛菌D25的菌落数,计算每毫升菌液D25的存活量,每组重复3次。采用DPS软件统计分析生物相容性。
1.2.3 泛菌D25与杀菌剂复配比例筛选 根据12种杀菌剂的室内毒力测定结果以及泛菌D25与杀菌剂间的相容性试验结果,选择对番茄灰霉病菌毒力最高且对泛菌 D25菌体生长影响最小的嘧环·咯菌腈与泛菌D25进行复配,为能够清晰地看出复配剂对番茄灰霉病菌的影响,嘧环·咯菌腈的浓度以EC50=0.043 mg/L进行配制,泛菌D25浓度同样选择对番茄灰霉病菌抑制率在50%左右的浓度(7.0×104CFU/mL)。按照嘧环·咯菌腈与D25的体积比V:V=10:0、9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9、0:10进行复配比例的筛选。根据张萌等[13]方法计算毒性比率。
1.2.4 盆栽试验 将直径为5.0 mm的番茄灰霉病菌菌饼接种在制备好的PDA培养基中央,于25 ℃黑暗条件下培养5~7 d后,向培养皿中加入10 mL 0.5%的吐温80,静置2 min,然后将其菌丝和孢子刮下,用4层纱布过滤,获得孢子悬液,采用血细胞仪计数法将浓度调至5×106孢子/mL,备用[20]。
番茄种子用0.5%次氯酸钠溶液消毒1 min,然后用无菌水冲洗干净,置于两层湿滤纸间,于28 ℃培养4 d,发芽后播种至9 cm×10 cm花盆中,每盆装有0.8 Kg灭菌土(V蛭石:V土壤=1:5)。所有花盆放置在25 ℃~30 ℃、光照14 h/d、相对湿度70%左右的温室中,定期浇水,待番茄幼苗长至6叶期进行防病试验。分别设置一组治疗处理和一组预防处理,探究杀菌剂与泛菌 D25复配后的效果。在治疗处理中,先将20 mL浓度为5×106孢子/mL的番茄灰霉病孢子悬液均匀喷施在番茄幼苗叶片上直至径流;48 h后,分别喷施10 mL嘧环·咯菌腈和泛菌D25菌液的复配剂(体积比5:5)、10 mL嘧环·咯菌腈和10 mL泛菌D25,各处理中嘧环·咯菌腈浓度为0.043 mg/L,D25菌液浓度为7×104CFU/mL。预防处理组则先将复配剂、嘧环·咯菌腈和泛菌D25单剂分别喷施在番茄幼苗叶片上,48 h后喷施浓度为 5×106孢子/mL的番茄灰霉病孢子悬液,各药剂浓度及用量同治疗组,对照组用清水进行处理。每个处理选取9盆番茄,每盆中3株番茄苗,共设3次重复。接种5~7 d后调查植株发病情况,病害分级标准参照GB/T 17980.28-2000。0级:无病斑;1级:单叶片有病斑3个;3级:单叶片有病斑4~6个;5级:单叶片有病斑7~10个;7级:单叶片有病斑11~20个,部分密集成片;9级:单叶片有病斑密集占叶面积四分之一以上。采用DPS软件统计分析防治效果。病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
2 结果与分析
2.1 12种杀菌剂对番茄灰霉病的毒力分析
12种杀菌剂的室内毒力见表3。其中枯草芽胞杆菌和哈茨木霉菌两种微生物菌剂表现出较高的抑菌活性,EC50值分别为4.564×10-5与0.021 mg/L;嘧环·咯菌腈、啶酰·咯菌腈和啶菌噁唑·咯菌腈3种化学杀菌剂有较高的抑菌活性,EC50值分别为0.043、0.081和0.093 mg/L,均小于0.1 mg/L。而香芹酚和苦参·蛇床素两种植物源杀菌剂的抑菌活性较低,其EC50值分别为12.469和19.220 mg/L。所以选择枯草芽胞杆菌、哈茨木霉菌、嘧环·咯菌腈、啶酰·咯菌腈和啶菌噁唑·咯菌腈与泛菌D25进行生物相容性的测定。
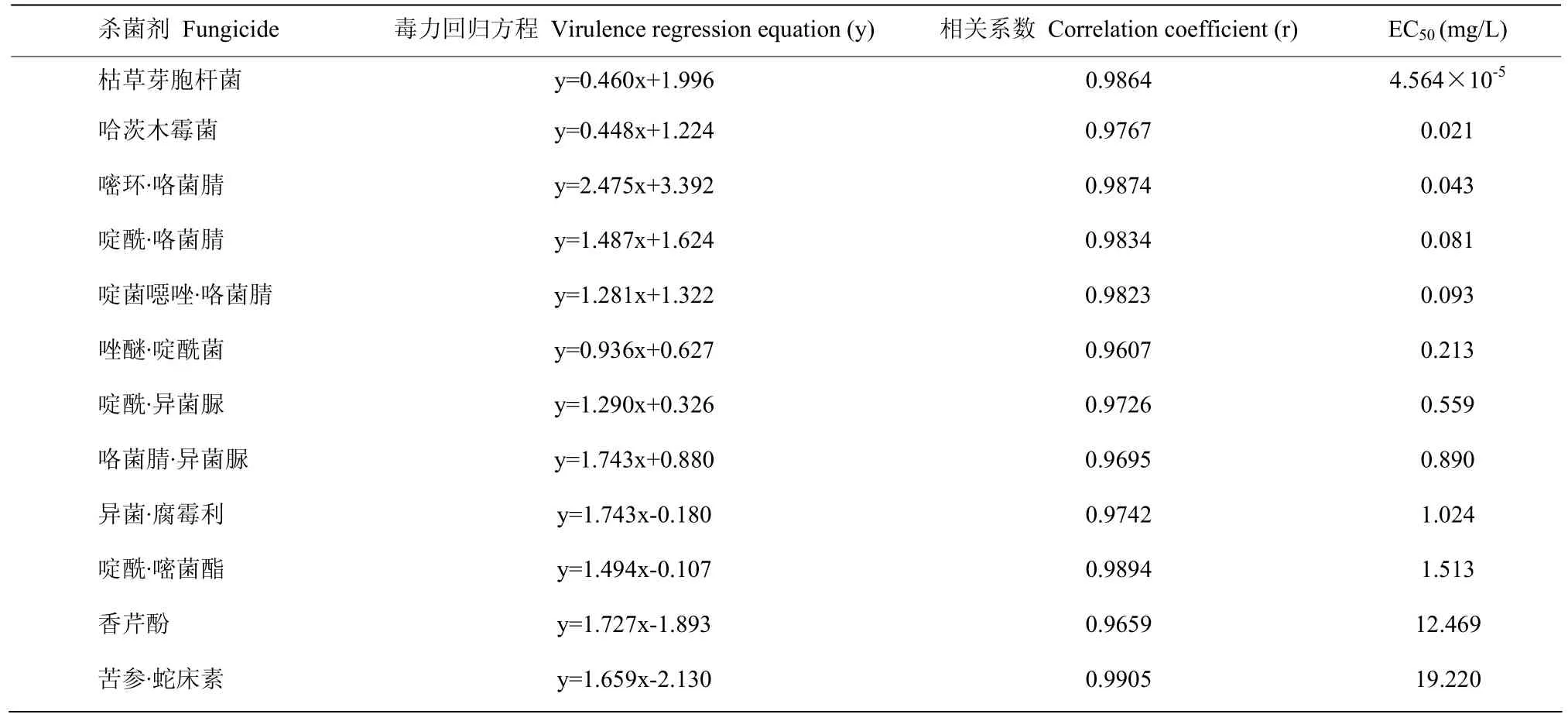
表3 十二种杀菌剂对番茄灰霉病毒力测定结果Table 3 Toxicity of twelve fungicides to B. cinerea
2.2 泛菌D25与杀菌剂的相容性分析
微生物杀菌剂与泛菌D25相容性测定结果表明,枯草芽胞杆菌和哈茨木霉菌对泛菌D25的生长有抑制作用,生物相容性不佳。化学杀菌剂与D25相容性测定结果表明,在浓度为50 mg/L的异菌脲·腐霉利和啶酰·咯菌腈的平板上,D25的活菌量分别为1.14×109和1.22×109CFU/mL,显著低于对照组活菌量(P<0.05);但在浓度为50 mg/L的嘧环·咯菌腈的平板上,泛菌D25的活菌量为1.67×109CFU/mL,与对照无显著差异(表4),表明嘧环·咯菌腈与泛菌D25具有较好的生物相容性。
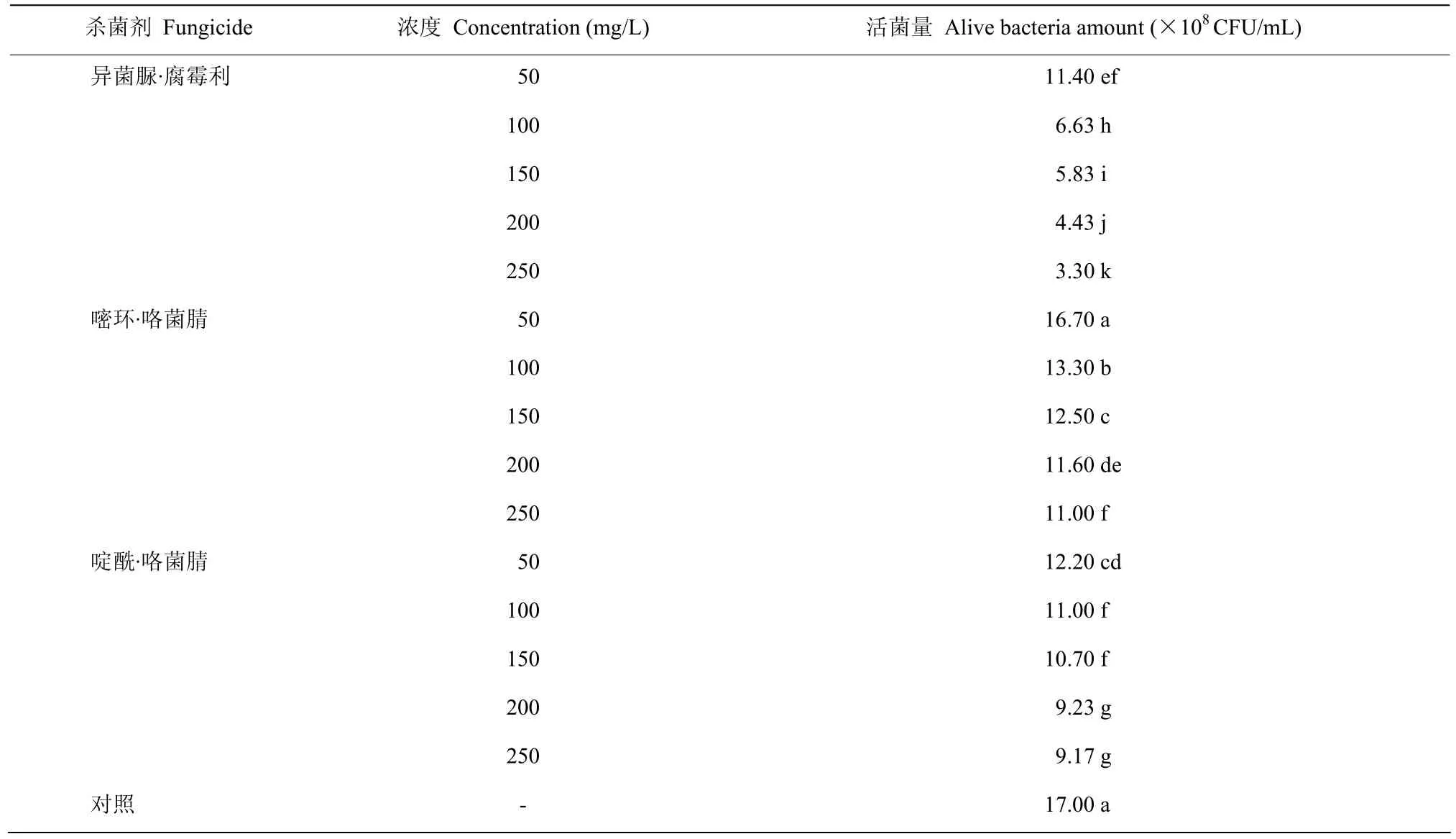
表4 三种杀菌剂对泛菌D25菌体生长的影响Table 4 Effects of three fungicides on the growth of P. jilinensis D25
2.3 不同比例的嘧环·咯菌腈与泛菌D25复配对番茄灰霉病菌的抑制作用
嘧环·咯菌腈与泛菌D25不同比例复配对番茄灰霉病菌的抑制效果见表5。结果表明当嘧环·咯菌腈与泛菌D25体积比为9:1、8:2、2:8和1:9时,毒性比率在0.8858~0.9567之间,均小于1,表现为拮抗作用,而7:3、6:4、5:5、4:6、3:7五个比例的毒性比率在1.2224~1.3943之间,均大于1,表现为增效作用,其中比例5:5的毒性比率最大可达1.3943,说明在此比例下嘧环·咯菌腈与泛菌D25的协同作用最强,防治效果最好。
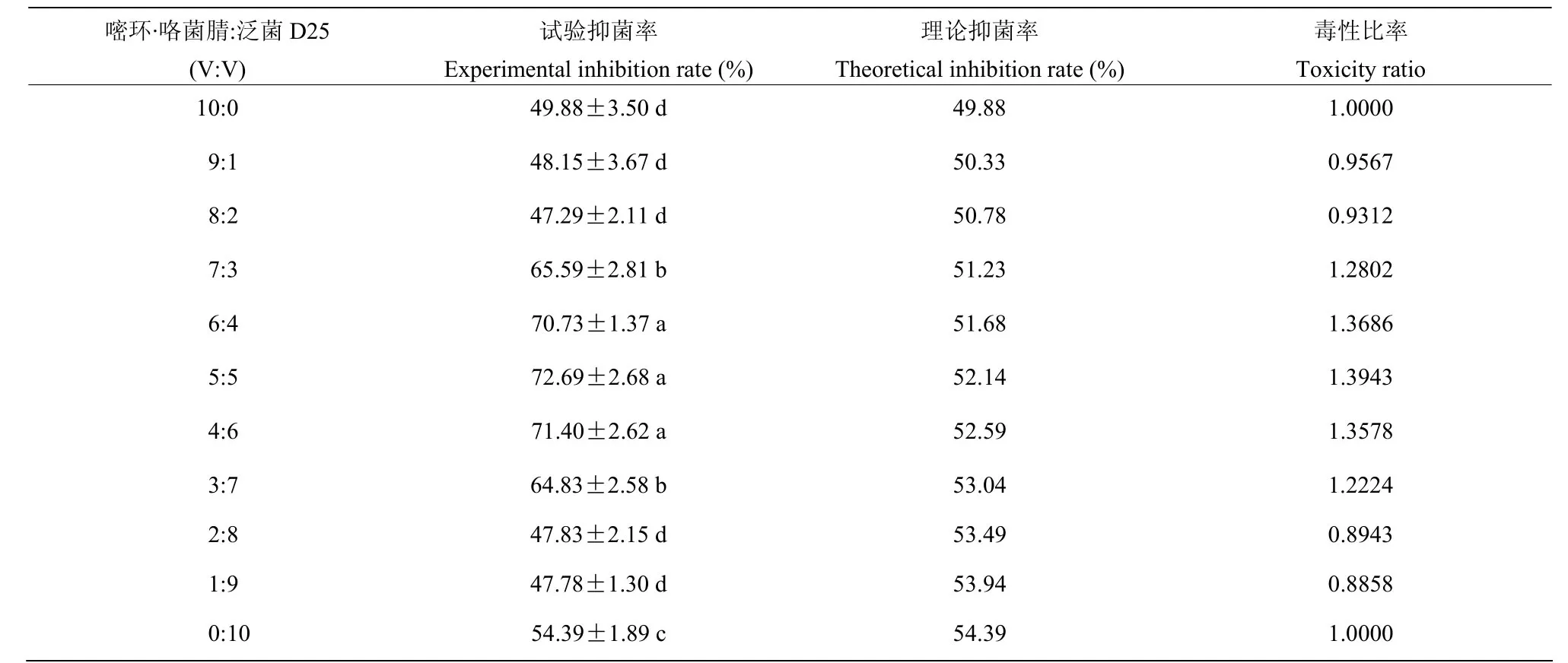
表5 嘧环·咯菌腈与泛菌D25复配对番茄灰霉病的抑制作用Table 5 Inhibition of the cyprodinil·fludioxonil and P. jilinensis D25 complex on B. cinerea growth
2.4 盆栽试验结果
将0.043 mg/L的嘧环·咯菌腈与7×104CFU/mL泛菌D25按体积比5:5复配,进行盆栽试验,测定其预防和治疗效果。结果(表6)表明,预防处理组中,泛菌D25和嘧环·咯菌腈单剂对番茄灰霉病的防治效果分别为43.00%和53.03%,而复配剂可使病情指数降低至12.82,防治效果可达72.29%;治疗处理组中,泛菌D25和嘧环·咯菌腈单剂的防治效果略低,分别为40.34%和46.17%,复配剂可使病情指数降低至17.78,防治效果可达61.57%。上述结果说明,嘧环·咯菌腈和泛菌D25复配剂对番茄灰霉病菌的抑制效果最强,复配剂对番茄灰霉病的预防和治疗效果无明显差异。

表6 复配剂对番茄灰霉病的盆栽防治效果Table 6 Efficacy of cyprodinil·fludioxonil and D25 complex on the control of tomato gray mold in pot experiment
3 讨论
化学药剂和生物药剂复配防治植物病害已经在实际生产中得到应用,如纪兆林等[21]连续3年使用咪鲜胺单剂防治桃枝枯病,发现药后35 d防效从55.22%下降至15.74%,而与地衣芽胞杆菌W10复配使用的防治效果能够稳定在30%以上;陈长卿等[22]利用甲基营养型芽胞杆菌NJ13分别与嘧菌环胺和苯醚甲环唑复配对田间人参黑斑病菌的防治效果可达80.39%和89.33%;谷春艳等[23]利用芽胞杆菌WH1G与氟啶胺复配防治草莓灰霉病的田间防效可达69.79%。近年多项研究发现辽宁、山西等地的灰霉病菌对生产中常用杀菌剂已经产生抗药性[6,7],因此减少化学杀菌剂用药量、提高防效成为生产中亟需解决的问题,但该方面研究非常匮乏。本研究在前期获得新的生防菌D25[15]基础上,研究了该菌与常用杀菌剂的复配毒力和温室防效,明确了复配制剂比例,为番茄灰霉病的防治提供了新的药剂。
明确杀菌剂的毒力以及杀菌剂与生防菌的相容性是筛选复配制剂的重要指标。本研究测定的2种微生物杀菌剂对番茄灰霉病菌的EC50值最低,杀菌作用强,但是两种微生物杀菌剂在PDA培养基中抑制泛菌 D25的生长,可能与两种微生物杀菌剂产生的抗菌代谢物同时具有杀真菌和杀细菌作用[24]有关,因而不适合与泛菌 D25混和使用。植物源杀菌剂具有环境友好、对非靶标生物安全、不易产生抗药性等优点,但试验中使用的香芹酚和苦参·蛇床素的EC50值较高,对番茄灰霉病菌的抑制作用不强,需要使用高剂量才有可能达到较为可观的防治效果。由于植物源杀菌剂通常以天然植物提取物、稀有植物和高毒植物为材料[25],产量有限[26],因而也不适合与泛菌D25联合使用。8种化学杀菌剂中,嘧环·咯菌腈的EC50值最低,并与泛菌D25有较好的生物相容性,室内毒力和盆栽试验结果表明嘧环·咯菌腈的用药量在减少50%情况下,复配制剂的防效显著高于两种单剂,具有很大应用潜力,但仍需在田间进行药效评价。
化学杀菌剂是防治番茄灰霉病的主要药剂,但药剂的选择作用容易导致番茄灰霉病菌产生抗药性,并逐渐成为田间流行的优势群体,从而使常用的杀菌剂防效下降甚至完全失效[27,28]。为能够实现番茄灰霉病的绿色防治,需要不断推出科学的防治方案。生防菌 D25与杀菌剂嘧环·咯菌腈复配制剂的获得,对番茄灰霉病的有效防控具有重要意义,有望降低杀菌剂用量和成本,达到农药减施增效的目的。
