我国葡萄灰霉病菌对四霉素和啶酰菌胺的敏感性测定
2022-09-16周连柱黄晓庆孔繁芳王忠跃甄志先
田 秀,周连柱,黄晓庆,孔繁芳,王忠跃,甄志先,3*,张 昊*
(1. 河北农业大学林学院,保定 071000;2. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193;3. 河北省林木种质资源与森林保护重点实验室,保定 071000)
葡萄是世界上广泛种植的水果之一,由灰葡萄孢Botrytis cinerea侵染引起的灰霉病是葡萄生产上的主要病害,严重影响葡萄果实的品质和产量[1]。近年来,随着设施栽培的推广和应用,葡萄灰霉病日趋严重,一般损失在20%左右,发病严重时病穗率可达40%以上,有些地区或品种甚至造成绝收[2]。目前,化学防治是灰霉病田间防治的主要手段。但随着杀菌剂的大量和高频次使用,葡萄灰霉病菌对杀菌剂的抗性日趋严重。据报道,目前该病原菌已对苯并咪唑类、二甲酰亚胺类、烟酰胺类以及咪唑类等多种杀菌剂产生了抗性[3-5],亟需筛选高效安全的葡萄灰霉病防治药剂。
啶酰菌胺属于琥珀酸脱氢酶抑制剂类杀菌剂,于 2008年在我国登记注册,已广泛用于防治蔬菜、果树等作物的灰霉病等[6],这类药剂主要通过抑制病原菌琥珀酸脱氢酶的活性,阻碍其能量代谢,从而抑制病原菌的生长[7]。但由于其作用位点单一,长期广泛地使用容易产生田间抗性菌株,国际杀菌剂抗性委员会(Fungicide Resistance Action Committee,FRAC)已将其归为中等至高抗性风险杀菌剂[8]。啶酰菌胺是此类杀菌剂中的重要产品,故其抗性风险备受关注。目前,已有部分地区的灰霉病菌对啶酰菌胺产生了抗性[9]。明确不同葡萄产区灰霉病菌对啶酰菌胺的敏感性,对于指导科学用药具有重要意义。
随着无公害、绿色和有机食品的发展,生物农药逐渐成为未来农药的发展方向之一。四霉素又称梧宁霉素,是一种广谱且高效低毒的农用抗生素类杀菌剂。四霉素不仅可以有效防治子囊菌、担子菌和半知菌引起的病害[10],还可以诱导寄主体内苯丙氨酸解氨酶、过氧化物酶和多酚氧化酶等防御酶系活性升高[11],从而提高寄主植物对病原菌的抗性。该药剂在我国于 2016年登记用于防治水稻立枯病、小麦白粉病和赤霉病、杨树溃疡病等[12]。目前,已发现四霉素对蔬菜菌核病菌[13]、番茄叶霉病菌[14]及辣椒疫霉病菌[15]等具有较好的抑菌活性及防治效果。但对灰霉病菌的防治效果报道较少,Song等[16]研究表明四霉素对草莓及黄瓜灰霉病均具有较好的预防和治疗效果。由于不同寄主植物上的灰葡萄孢病菌存在遗传分化[17],四霉素对葡萄灰霉病菌的抑制活性尚不明确。
云南省宾川县、湖北省武汉市和辽宁省北镇市分别位于我国西南地区、长江中游地区和环渤海湾地区,是我国重要葡萄栽培区[18]。葡萄灰霉病是各地的主要防治对象之一。随着灰霉病菌抗药性问题日益突出,高效安全杀菌剂的筛选对葡萄灰霉病的田间防控具有重要指导意义。为此,本试验分别采用菌丝生长速率法和孢子萌发法,检测上述地区葡萄灰霉病菌对四霉素和啶酰菌胺的敏感性,并分析两种药剂之间的交互抗性关系。以期为四霉素和啶酰菌胺在防治葡萄灰霉病上的应用提供理论依据,减少灰霉病造成的经济损失。
1 材料与方法
1.1 供试材料
1.1.1 供试病原菌 本试验所用葡萄灰霉病菌为2016-2017年采集自我国云南省宾川县、湖北省武汉市和辽宁省北镇市的葡萄主产区并保存在中国农业科学院植物保护研究所葡萄病害创新任务实验室的菌株,共60株(表1)。

表1 不同地区葡萄灰霉病菌对四霉素的敏感性Table 1 Sensitivity to tetramycin of B. cinerea in different areas
1.1.2 供试药剂 四霉素:0.3%的四霉素水剂,由辽宁微科生物工程股份有限公司提供。啶酰菌胺:中国农业科学院植物保护研究所农药中心提供的98.5%原药,溶于100%的甲醇,配制成10 mg/mL的母液。
1.1.3 培养基 马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA):将马铃薯去皮、洗净吸干水分称取200 g,切成1 cm的土豆块放入1 L 去离子水中煮至熟透,用纱布过滤掉马铃薯,加入20 g葡萄糖,20 g琼脂,加热并搅拌至全部溶解,加ddH2O定容至1 L,用锥形瓶分装后于121 ℃灭菌20 min;2%水琼脂培养基(Water Agar,WA):20 g琼脂,加ddH2O定容至1 L,用锥形瓶分装后于121 ℃灭菌20 min。
1.2 试验方法
1.2.1 葡萄灰霉病菌对四霉素的敏感性测定 采用菌丝生长速率法测定葡萄灰霉病菌对四霉素的敏感性。四霉素敏感性检测浓度为0.025、0.1、0.2、0.4、0.8和1 μg/mL。将供试药剂分别按上述比例与经高温灭菌的PDA培养基混合制成所需浓度的含药PDA平板。将已活化的灰霉菌接种于普通PDA平板上,22 ℃下培养3 d,用直径5 mm的打孔器沿菌落边缘打取菌饼,表面朝下接种于含药PDA平板上,以无药PDA为对照,置于22 ℃的恒温培养箱培养,每个处理重复3次。3 d后待对照组菌落直径达到平板的3/4时,采用十字交叉法测量菌落直径,并计算抑制率、有效抑制中浓度(EC50)及EC50变异系数(Variation factor,VF)。其中抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100,EC50变异系数=最大EC50值/最小 EC50值。
1.2.2 葡萄灰霉病菌对啶酰菌胺的敏感性测定 采用孢子萌发法测定葡萄灰霉病菌对啶酰菌胺的敏感性。将活化好的灰霉菌株接种到PDA平板上培养10 d,待其产孢后,使用无菌水将孢子洗脱,双层纱布对孢子悬浮液进行过滤,并使用血球计数板在光学显微镜下将孢子悬浮液浓度调至1×106孢子/mL。将啶酰菌胺按比例与WA培养基充分混匀后缓慢倒入60 mm培养皿中制成含药平板,啶酰菌胺浓度分别设置为0.25、0.5、1、5、10和20 µg/mL。在不同浓度的含药平板上,吸取40 µL孢子悬浮液均匀涂布开,以无药平板为对照,每个处理重复3次。在22 ℃恒温培养箱培养10 h后,用显微镜观察并统计孢子的萌发情况,当孢子的芽管长度大于孢子短半径时视为萌发,每个平板观察100个孢子。按计算孢子萌发率,抑制率,EC50值及其变异系数。其中,萌发率(%)=萌发孢子数/观察孢子总数×100,抑制率(%)=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100,变异系数=最大EC50值/最小EC50值。
根据建立的葡萄灰霉病菌对啶酰菌胺的敏感基线,分析上述葡萄灰霉病菌对啶酰菌胺的抗性频率与抗性水平,其中抗性频率(%)=抗性菌株个数/菌株总数×100;抗性因子(Resistance Factor,RF)=菌株EC50/敏感基线。抗性分级标准[19]如下:RF<5为敏感(S);5≤RF<20为低抗 ;20≤RF<100为中抗;RF≥100为高抗。
1.2.3 葡萄灰霉病菌对四霉素和啶酰菌胺的交互抗性关系 将上述60株葡萄灰霉病菌对四霉素和啶酰菌胺的EC50对数值进行相关性分析,根据相关系数r与P的值确定四霉素与啶酰菌胺之间是否存在交互抗性关系。
1.2.4 数据处理 使用SPSS 25.0软件进行下列数据分析;分别计算四霉素及啶酰菌胺对灰霉病菌菌丝生长及孢子萌发的有效抑制中浓度(EC50);采用Fisher最小显著差检验比较不同地区间的平均EC50之间的差异,P<0.05存在显著差异;将啶酰菌胺和四霉素EC50值转换成lgEC50后,采用皮尔逊相关性分析评估二者之间的交互抗性。
2 结果与分析
2.1 葡萄灰霉病菌对四霉素的敏感性
采用菌丝生长速率法测定了60株葡萄灰霉病菌对四霉素的敏感性(表1),其中四霉素抑制菌丝生长的EC50值范围为0.075~0.433 μg/mL,平均EC50值为(0.245±0.065)μg/mL。变异系数(VF)为5.773,病菌的EC50值整体呈一条单峰曲线(图1),正态性检验结果表明供试的60株葡萄灰霉病菌对四霉素的EC50值符合正态分布。因此,该病菌群体的 EC50均值可作为葡萄灰霉病菌对四霉素的敏感基线。不同地区间葡萄灰霉病菌对四霉素的EC50值无显著差异(P>0.05,表1)。

图1 四霉素对60株葡萄灰霉病菌对的EC50值分布Fig. 1 Distribution of EC50 values for tetramycin against 60 B.cinerea isolates
2.2 葡萄灰霉病菌对啶酰菌胺的敏感性情况
采用孢子萌发法测定了60株葡萄灰霉病菌对啶酰菌胺的敏感性(表2),其中啶酰菌胺抑制孢子萌发的EC50值范围为0.249~11.876 μg/mL,变异系数(VF)为47.695,病菌的EC50值整体呈非连续性分布,表明葡萄灰霉病菌对啶酰菌胺的敏感性存在一定分化,部分菌株已产生抗药性。通过对灰霉病菌EC50值分布频率进行分析,发现灰霉病菌的EC50值主要分布在0.25~2.64 µg/mL,且在该区间其敏感性频率分布符合正态分布(图2),通过对这一区间内的菌株提取得到41株,通过计算求得其平均EC50值为(1.115±0.579)µg/mL,以此平均值作为葡萄灰霉病菌对啶酰菌胺的敏感基线。并且,不同地区间葡萄灰霉病菌对啶酰菌胺的EC50值无显著差异(P>0.05)。
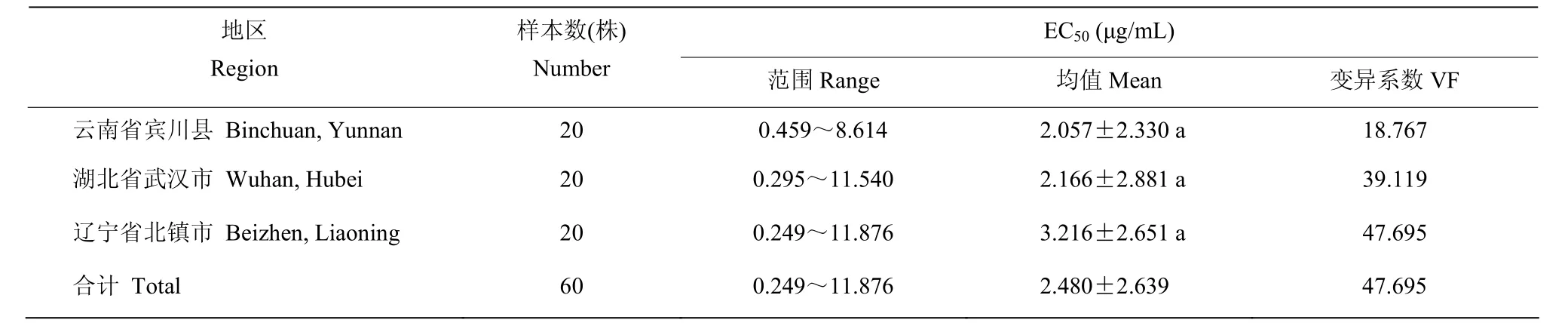
表2 不同地区葡萄灰霉病菌对啶酰菌胺的敏感性Table 2 Sensitivity to boscalid of B. cinerea in different areas

图2 啶酰菌胺对41株葡萄灰霉病菌的EC50值分布Fig. 2 Distribution of EC50 values for Boscalid against41 B.cinerea isolates
根据建立的啶酰菌胺敏感基线,发现上述3个地区的60株葡萄灰霉病菌中共有7株抗性菌株,总体抗性频率为11.7%,且全部为低抗菌株。其中云南宾川县共有3株低抗菌株,抗性频率为15%,其他两个地区均发现了2株低抗菌株,抗性频率为10%,表明整体抗性水平较低(表3)。

表3 不同地区葡萄灰霉病菌啶酰菌胺抗性菌株的分布和数量Table 3 Distribution and number of Boscalid-resistant B. cinerea from different areas
2.3 葡萄灰霉病菌对四霉素和啶酰菌胺的交互抗性分析
将上述灰霉病菌对四霉素的lgEC50值与啶酰菌胺的lgEC50值进行皮尔逊相关分析(图3),结果显示皮尔逊相关系数r为-0.040(P>0.05),表明四霉素与啶酰菌胺的相关性未达到显著水平,二者之间不存在交互抗性关系。

图3 葡萄灰霉病菌对四霉素和啶酰菌胺的交互抗性Fig. 3 Cross resistance of B. cinerea to tetramycin and boscalid
3 讨论
葡萄灰霉病是世界上葡萄重要病害之一,该病原菌在葡萄的生长期和贮藏期均能进行侵染,低温高湿环境下容易大面积发生,造成的经济损失高达50%[2]。在农业生产中灰霉病的防治主要以化学防治为主,由于灰葡萄孢菌具有遗传变异大、繁殖速率快和适合度高等特点,在连续多年单一使用某一种杀菌剂后,极易使病原菌产生抗药性及交互抗性[20]。研究发现,我国很多地区的葡萄灰霉病菌已对多菌灵、腐霉利、乙霉威和嘧霉胺等产生了抗药性,甚至出现了“双抗”甚至“多抗”灰霉菌菌株[3-5]。如 2021年贾爽爽等[5]发现黑龙江省和云南省葡萄灰霉病菌对多菌灵的抗性频率接近 100%,抑菌脲以及对两种杀菌剂的多药抗性频率平均也达到70%以上。因此,该病害高效、无公害药剂的筛选工作也就显得尤其重要。
本研究表明,葡萄灰霉病菌对啶酰菌胺的敏感性基线为1.115±0.579 μg/mL,并且云南省、湖北省和辽宁省等3个地区灰霉菌株对啶酰菌胺的敏感性无显著差异,表明啶酰菌胺对葡萄灰霉病菌具有较高的抑菌活性,可作为后续田间抗药性检测的依据。本研究建立的葡萄灰霉病菌对啶酰菌胺的敏感基线低于魏佳爽等[21]测定的番茄灰霉病菌的敏感基线(2.56 μg/mL),这可能与不同作物上的灰霉病菌存在变异有关。尽管本研究测定的大多数菌株对啶酰菌胺仍表现敏感,但田间抗药性菌株的出现表明采用该药剂防治葡萄灰霉病具有一定的风险性。2019年,宋昱菲[22]检测了山东省灰霉病菌对啶酰菌胺、吡唑萘菌胺、氟唑菌酰胺、苯并烯氟菌唑、氟吡菌酰羟胺和氟吡菌酰胺6种琥珀酸脱氢酶抑制剂的抗性情况,发现除了啶酰菌胺之外,灰霉病菌对其他5种琥珀酸脱氢酶抑制剂也存在不同程度的抗性,各药剂之间存在显著的交互抗性。因此,田间使用时应注意限制同一生长季的用药次数,并与不同作用机制的杀菌剂交替或混合使用,以减小对田间种群的选择性压力,延缓病原菌对该类药剂的抗性发展。
四霉素对灰霉病菌的毒力试验结果显示,四霉素抑制菌丝生长的EC50值范围为0.075~0.433 μg/mL,平均EC50值为0.245±0.065 μg/mL,变异系数为5.773,表明四霉素对灰霉病菌的敏感性范围窄[23],这可能与该类药剂在葡萄灰霉病防治中未正式使用有关。宋莹莹等[24]测定了黄瓜、草莓及葡萄等不同作物上灰霉病菌对四霉素的敏感性,也得到了相似的结果(敏感基线0.35±0.20 μg/mL),表明葡萄灰霉病菌对四霉素表现出较高的敏感性。并且我们发现其与啶酰菌胺之间不存在交互抗性。因此,四霉素作为一种低毒对环境安全的生物源农药,用于防治葡萄灰霉病具有很大的应用潜力,可作为候选药剂单独或与啶酰菌胺等其它类型的药剂混配使用,以避免或延缓病菌抗药性的产生,提高防治效果。后续将进一步通过田间药效试验验证四霉素的防治效果,为该药剂用于葡萄灰霉病田间防治提供科学依据。
