苁归益肾胶囊对DKD大鼠血管内皮损伤的保护作用及VCAM-1、Bcl-2、Bax、Caspase-3表达的影响
2022-09-16刘俊峰孙晓娟朱梦燕方朝晖
刘俊峰,孙晓娟,吴 迪,朱梦燕,方朝晖*
(安徽中医药大学1研究生院,2第一附属医院内分泌科,合肥 230012)
糖尿病(DM)是常见的慢性非传染性疾病,目前认为是由胰岛素功能障碍引起的代谢紊乱综合征,具有病程长,难治愈的特点,临床上以T2DM多见,占DM的90%左右[1]。祖国传统医学认为T2DM属于“消渴”病,其病变机理主要是阴虚燥热。病程日久,迁延不愈,阴损及阳,肾阳衰微,加之机体阴虚燥热,耗液伤津,逐渐发展为脉络瘀阻。西医则认为,持久的高血糖可导致血管斑块、动脉粥样硬化及血管壁点状钙化等血管病变。有研究发现T2DM患者的死亡约50%是血管并发症引起的,作为T2DM常见的血管并发症之一的糖尿病肾病(DKD)是由糖尿病引起的肾脏微血管病变[2-3]。糖代谢紊乱与内环境高糖状态是DKD发病的主要病因,细胞凋亡参与了DKD发生的整个过程。苁归益肾胶囊是安徽中医药大学第一附属医院研制的具有温阳益肾、活血调脂之功效的中药复方制剂,前期研究发现苁归益肾胶囊能改善血糖血脂、改善肾功能及胰岛素抵抗,减轻机体凋亡反应[4-5]。本研究从氧化应激和细胞凋亡角度阐述苁归益肾胶囊对DKD大鼠血管内皮损伤、肾组织结构的保护作用及VCAM-1、Bcl-2、Bax、Caspase-3表达的影响。
1 材料与方法
1.1 动物50只8周龄健康的SPF级雄性Wistar大鼠,体重(220.7±3.5)g,购于安徽医科大学实验动物中心,动物生产许可证编号:SCXK-(皖)2018-002。动物房饲养,保持温度22~25℃,相对湿度45%~60%,黑暗和光照交替,各12 h。本实验经过安徽中医药大学实验动物伦理委员会审查批准[AHUCM(rals)2018009]。
1.2 药物和仪器苁归益肾胶囊组成药物为(肉苁蓉15 g、当归12 g、山茱萸12 g、淫羊藿9 g、泽泻9 g、丹皮12 g),安徽中医药大学第一附属医院(安徽省中医院院内制剂,批号20130925)。链脲佐菌素(STZ,美国Sigma公司),盐酸吡格列酮片(天津武田药品有限公司),NO、MDA、T-AOC、SOD、GSH-Px试剂盒(南京建成生物工程研究所),ET、VCAM-1、MCP-I、OxLDL、AGEs ELISA试剂盒(武汉博士德生物有限公司),转膜仪(美国Biorad公司),凝胶成像分析仪(美国Biorad公司),透射电子显微镜(日本日立公司H-7500)。
1.3 饲料标准饲料以及高糖高脂饲料(0.25%胆酸钠、1.5%胆固醇、10%猪油、5%蔗糖、普通大鼠饲料83.25%)由安徽医科大学实验动物中心配制。
1.4 方法
1.4.1 造模 随机选取健康雄性SPF级Wistar大鼠40只予以高糖高脂饲料喂食,适应性喂养1月后,按大鼠体重,一次性腹腔注射STZ 60 mg/kg,注射72 h后尾静脉取血,并收集大鼠24 h内的尿液,检测各组大鼠空腹血糖及24 h尿蛋白定量,以连续3次血糖达到并超过16.7 mmol/L,24 h尿蛋白定量>30 mg为建模成功[6]。
1.4.2 分组及给药方法 将40只建模成功的DKD大鼠分为模型组、吡格列酮组、苁归低剂量组、苁归高剂量组,每组各10只,继续高糖高脂喂养;10只正常大鼠作为对照组,予以普通动物饲料喂养。予以苁归低剂量组0.54 g·kg-1·d-1和高剂量组大鼠1.08 g·kg-1·d-1苁归粉末溶液灌胃,对照组和模型组大鼠则给予等容量的生理盐水灌胃,吡格列酮组大鼠给予吡格列酮片10 mg·kg-1·d-1灌胃治疗,喂养8周。
1.4.3 取材 第8周末,各组大鼠灌胃后禁食12 h,全部予以腹腔注射10%浓度的水合氯醛溶液麻醉,剂量为3 mg/kg。固定后迅速取出腔静脉血,离心血清,-20℃保存。置于液氮保存大鼠肾脏组织,用以制备检测细胞间黏附因子-1(VCAM-1)、bcl-2相关的X基因(Bax)、B淋巴细胞瘤-2(Bcl-2)、半胱天冬酶(Caspase-3)蛋白的表达。浸于4%甲醛溶液中固定大鼠肾脏组织,室温下保存,以备HE染色法观察。
1.5 检测指标
1.5.1 血管内皮功能、氧化应激及炎症等指标检测 硝酸盐还原酶法测定血清一氧化氮(NO)含量,酶联免疫吸附法(ELISA)测定血清内皮素(ET)、氧化低密度脂蛋白(oxLDL)、晚期糖基化终末产物(AGEs)、血管内皮细胞黏附分子-1(VCAM-1)、MCP-1含量,硫代巴比妥酸分光光度法测定丙二醛(MDA)、总抗氧化能力(TAOC)水平,黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性,紫外分光光度法测定谷胱甘肽过氧化物酶(GSH-Px)活性。
1.5.2 肾脏组织蛋白表达的检测 应用Western-blot法,提取肾脏组织VCAM-1、Bax、Bcl-2、Caspase-3蛋白进行检测,电泳分离,转膜,一抗并5℃冰箱内过夜,二抗孵育1h后显色曝光,图像分析。
1.6 统计学处理采用SPSS 23.0软件包进行数据分析,满足正态分布与方差齐性采用独立样本t检验,多重比较采用单因素LDS检验,计量资料以均数±标准差(±s)表示,不满足正态分布则应用非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血管内皮功能变化与模型组比较,对照组、吡格列酮组、苁归低剂量组、苁归高剂量组血清NO均升高(P<0.05)、ET均降低(P<0.05);与对照组比较,模型组、吡格列酮组、苁归低剂量组、苁归高剂量组NO、ET差异均有统计学意义(P<0.05);与苁归高剂量组比较,模型组、吡格列酮组、苁归低剂量组NO、ET差异均有统计学意义(P<0.05)。见表1。
表1 各组大鼠血清NO、ET水平比较/(±s )

表1 各组大鼠血清NO、ET水平比较/(±s )
注:与模型组比较,*P<0.05;与苁归高剂量组比较,#P<0.05;与对照组比较,▲P<0.05。
分组对照组模型组吡格列酮组苁归低剂量组苁归高剂量组F P n 10 10 10 10 10 NO/(μmol/L)82.1±10.31*28.25±11.11#▲52.94±12.04*#▲45.52±9.60*#▲63.10±10.90*▲31.36<0.01 ET/(ng/L)104.78±20.51*220.77±20.86#▲145.85±22.93*#▲148.23±20.77*#▲115.57±16.90*▲42.30<0.01
2.2 各组大鼠肾脏组织病理的形态学改变对照组肾组织结构正常,基底膜无增生、纤维化,毛细血管腔清晰。模型组肾基底膜增厚,肾小管上皮细胞肿胀甚至坏死。细胞质内可见红色颗粒、空泡改变、轻度间质纤维化和炎性细胞浸润。与模型组比较,苁归低、高剂量组大鼠肾小管上皮细胞变性、模糊、肿胀,毛细血管轻度狭窄,但炎性细胞浸润明显减少。见图1。

图1 光镜下观察各组大鼠肾脏组织病理改变(×200)
2.3各组大鼠血清氧化应激指标变化与模型组大鼠比较,对照组、吡格列酮组、苁归低剂量组、苁归高剂量组MDA、oxLDL、AGEs水平降低(P<0.05),T-AOC、SOD、CSH-Px水平升高(P<0.05);与对照组比较,模型组、吡格列酮组、苁归低剂量组、苁归高剂量组MDA、oxLDL、AGEs、T-AOC、SOD、CSH-Px差异均有统计学意义(P<0.05);与苁归高剂量组比较,吡格列酮组、苁归低剂量组、模型组MDA、oxLDL、AGEs、TAOC、SOD、CSH-Px差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠氧化应激指标水平比较/(±s )
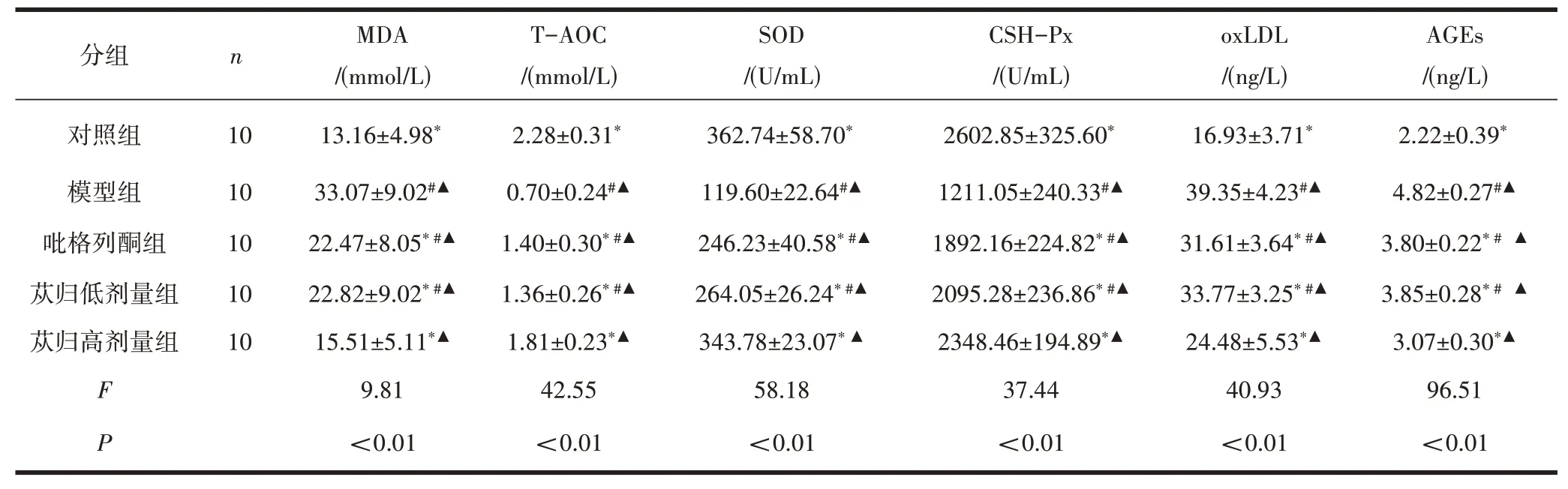
表2 各组大鼠氧化应激指标水平比较/(±s )
注:与模型组比较,*P<0.01;与苁归高剂量组比较,#P<0.05;与对照组比较,▲P<0.05。
分组对照组模型组吡格列酮组苁归低剂量组苁归高剂量组F P n 10 10 10 10 10 MDA/(mmol/L)13.16±4.98*33.07±9.02#▲22.47±8.05*#▲22.82±9.02*#▲15.51±5.11*▲9.81<0.01 T-AOC/(mmol/L)2.28±0.31*0.70±0.24#▲1.40±0.30*#▲1.36±0.26*#▲1.81±0.23*▲42.55<0.01 SOD/(U/mL)362.74±58.70*119.60±22.64#▲246.23±40.58*#▲264.05±26.24*#▲343.78±23.07*▲58.18<0.01 CSH-Px/(U/mL)2602.85±325.60*1211.05±240.33#▲1892.16±224.82*#▲2095.28±236.86*#▲2348.46±194.89*▲37.44<0.01 oxLDL/(ng/L)16.93±3.71*39.35±4.23#▲31.61±3.64*#▲33.77±3.25*#▲24.48±5.53*▲40.93<0.01 AGEs/(ng/L)2.22±0.39*4.82±0.27#▲3.80±0.22*#▲3.85±0.28*#▲3.07±0.30*▲96.51<0.01
2.4 各组大鼠血清VCAM-1、MCP-1变化与模型组比较,对照组、吡格列酮组、苁归低剂量组、苁归高剂量组血清VCAM-1、MCP-1均显著降低(P<0.05);与对照组比较,模型组、吡格列酮组、苁归低剂量组、苁归高剂量组VCAM-1、MCP-1差异均有统计学意义(P<0.05);与苁归高剂量组比较,对照组、吡格列酮组、苁归低剂量组、模型组血清VCAM-1、MCP-1差异均有统计学意义(P<0.05)。见表3。
表3 各组大鼠血清VCAM-1、MCP-1水平比较/(ng/L,±s )

表3 各组大鼠血清VCAM-1、MCP-1水平比较/(ng/L,±s )
注:与模型组比较,*P<0.05;与苁归高剂量组比较,#P<0.05;与对照组比较,▲P<0.05。。
分组对照组模型组吡格列酮组苁归低剂量组苁归高剂量组F P n 10 10 10 10 10 VCAM-1 53.32±6.08*#85.38±4.14#▲73.43±4.27*#▲69.70±2.91*#▲65.14±6.21*▲51.20<0.01 MCP-1 43.12±4.76*#68.38±5.50#▲58.75±4.03*#▲57.87±2.02*#▲53.55±5.04*▲39.72<0.01
2.5 各组大鼠肾脏组织Bcl-2、Bax、Caspase-3蛋白表达情况与模型组比较,对照组、吡格列酮组、苁归低剂量组、苁归高剂量组Bcl-2、Bax、Caspase-3蛋白表达差异均有统计学意义(P<0.05);与对照组比较,模型组、吡格列酮组、苁归低剂量组、苁归高剂量组Bcl-2、Bax、Caspase-3蛋白表达差异均有统计学意义(P<0.05);与苁归高剂量组比较,对照组、模型组、吡格列酮组、苁归低剂量组Bcl-2、Bax、Caspase-3蛋白表达差异均有统计学意义(P<0.05)。见表4、图2。
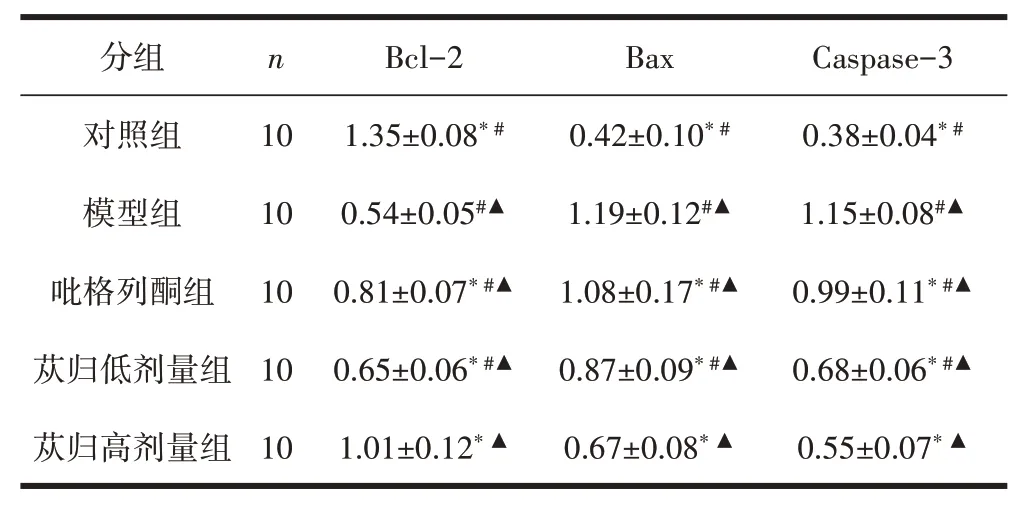
表4 各组大鼠肾脏组织Bcl-2、Bax、Caspase-3蛋白表达情况比较

图2 各组大鼠肾脏组织Bcl-2、Bax、Caspase-3蛋白表达
3 讨论
DKD是糖尿病常见的并发症,其本质是一种糖尿病微血管病变,DKD患者往往伴有血清cys-c、ACR及血脂TC、TG、LDL-C等指标异常,大约40%的DKD患者在漫长的糖尿病病程中可能发展成为肾衰竭[7]。苁归益肾胶囊选用当归、肉苁蓉、山茱萸、桂枝、牡丹皮和泽泻,是根据中医基础理论及现代药理学理论研制出来的成果。此方中以当归、肉苁蓉共同为君药,其意在肉苁蓉可以补肾温阳、助气行血,当归补血活血。桂枝、山茱萸为臣药,意在桂枝温通补肾阳,助气行血化瘀,山茱萸性温,具有补肝益肾的功效,同时又可助当归、肉苁蓉益气活血升阳。丹皮、泽泻为方中佐药,意在二者皆性寒凉,可制约君药及臣药的温热之性。
DKD患者最终多死于大血管病变。NO和ET是反映血管内皮功能的重要指标,ET是一种强烈的缩血管肽,可促进细胞外基质合成及细胞增殖,参与机体因缺血、缺氧等导致的血管内皮细胞损伤过程,NO有舒张血管的作用,NO和ET是血管内皮损伤的重要标志物,一般情况下两者处于动态平衡状态,一旦二者之间失去平衡,必然会导致血管内皮损伤[8-9]。本研究显示,与模型组比较,苁归低剂量组、苁归高剂量组血清NO均升高、ET均降低。提示苁归益肾胶囊能够减轻血管内皮损伤。
氧化应激是内皮细胞损伤的重要机制,也是DM的重要致病因素[10]。氧化应激的发生与多种因素有关,高糖、高脂、低氧、oxLDL因子等直接或间接的作用于内皮细胞,导致SOD活性下降,抗氧化能力损伤,过氧化物生成增多[11-12]]。本研究发现,苁归高剂量组大鼠肾脏组织相较于模型组大鼠,肾脏损伤程度较轻,肾脏炎症因子表达也明显降低。提示,苁归益肾胶囊可以加强DKD大鼠体内的抗氧化能力,调节DKD大鼠体内氧化应激反应,达到保护DKD早期大血管内皮损伤、减轻高血糖带来的肾脏损伤。
已有研究表明,DKD的发生发展及修复过程都伴随着细胞凋亡[13]。凋亡是是受基因调控的一种细胞死亡。DKD早期,机体通过细胞凋亡清除多余增生细胞,对糖尿病肾脏有修复的作用;后期随细胞凋亡数增多,机体无法清除更多的增生细胞时会造成肾脏损伤。Bax是拮抗Bcl-2的促凋亡因子,Bax的上调会加速细胞死亡,Bcl-2上调有助于细胞存活[14]。Caspase-3高糖情况下被激活,Caspase-3最后执行凋亡,起着十分关键的作用[15]。本研究发现,与模型组比较,苁归高、低剂量组DKD大鼠Bax和caspase-3表达降低,Bcl-2表达升高。提示,苁归益肾胶囊可通过抑制DKD大鼠肾脏组织细胞凋亡,下调促凋亡的Bax、Caspase-3蛋白水平,上调抑制凋亡的Bcl-2蛋白水平,减少了肾脏细胞凋亡,减轻肾脏损伤,达到保护肾脏的效果。
综上,苁归益肾胶囊对DKD血管内皮损伤具有保护作用,其作用机制可能与抑制VCAM-1、Bcl-2、Bax、Caspase-3表达有关。本研究因研究时间及场地设施的限制,研究的动物模型数量较少,且没有开展相关临床试验,没有深入研究电镜下DKD大鼠模型的肾脏组织细胞病理超微结构的改变;此外,未对苁归益肾胶囊的药物的各有效成分进一步分析,这些不足有望后期研究进一步完善。
