沙地榆DSE真菌的分离鉴定和抑菌活性
2022-09-15田慧敏王秀艳李晓兰
田慧敏,王秀艳,李晓兰
沙地榆DSE真菌的分离鉴定和抑菌活性
田慧敏,王秀艳,李晓兰
(赤峰学院化学与生命科学学院,内蒙古 赤峰 024000)
为了研究沙地榆深色有隔内生真菌DSE(dark septate endophytes)的种类及抑菌作用,寻找潜在的可开发利用的生防菌,采用组织分离法从沙地榆分离DSE真菌,运用形态学与ITS测序方法进行鉴定,以常见病害灰霉病(灰葡萄孢)瓜类枯萎病(尖刀镰孢菌黄瓜转化型f. sp.)和炭疽病(胶孢炭疽菌)的病原菌为指示菌,采用对峙培养菌丝生长速率法测定其抑菌活性。结果表明:从沙地榆须根筛选到1株具有较高抑菌活性的DSE真菌(编号Upr105),该菌初期菌落呈白色绒毛状、稀疏、菌落背面呈浅橘色,随着菌落扩大加厚,背面渐呈亮橘色,后期菌落变为深褐色,培养后期菌落可形成不明显的“环形带”结构;显微特征为菌丝棕色、具隔膜,不形成有性或无性繁殖结构,显微形态呈形态各异的“念珠状”膨大细胞;根据形态学特征和rDNA–ITS测序鉴定其为薄毛盘菌(sp.)。抑菌试验结果发现,该菌对3种指示菌有不同程度的抑制作用,从接种第2天开始抑菌率逐渐上升,培养至第7天时对灰葡萄孢尖刀镰孢菌黄瓜专化型f. sp.和胶孢炭疽菌的抑菌率达到最大值,分别为68.6%、61.5% 和42.9%,对3种菌的平均抑菌率分别为52.8%、44.5%和22.8%,说明该菌株具有较强的抑菌活性,是枯萎病、灰霉病和青枯病防治的潜在生防菌。
沙地榆;深色有隔内生真菌;分离鉴定;抑菌活性
深色有隔内生真菌(dark septate endophytes,DSE)主要定殖于植物根表皮、皮层以及维管组织细胞内或细胞间隙,能够在植物组织内形成菌丝网络、胞间菌丝和“微菌核”等结构,但不会在植物根组织内表现由病原真菌所引起的病理学特征[1]。DSE真菌不是1个分类单元,而是1个可能涵盖了众多形态学种的分类群,在子囊菌、接合菌、担子菌、半知菌类都有分布,以子囊菌为主[2–3]。该类真菌具有类似菌根的潜在生态功能,可促进宿主矿质元素和有机养分的吸收,提高宿主抗逆性和抗病性[4–6]。DSE真菌能在不利于菌根生长的胁迫环境中分布并大量存在,且可在培养基上分离培养,易于获得,在胁迫生境的生态保护和修复、植被的恢复和重建、植物病虫害生物防治等多个领域具有潜在的应用价值[3]。然而,DSE真菌在培养基上大多以无形态形式存在,而且大部分DSE真菌不产孢,只有少数种可诱导产孢,这给该类真菌的形态鉴定带来了很大的困难。随着分子生物技术的发展,分子标记技术在DSE真菌的研究应用逐渐增多,如简单序列间重复(ISSR)、限制性片段长度多态性(RFLP)、核糖体DNA基因内转录间隔区(rDNA–ITS)等均可作为DSE真菌鉴定的辅助手段[7]。真菌rDNA–ITS区域遗传信息非常丰富,已经成为公认的鉴定菌物的通用条形码,成为了DSE真菌的分子鉴定最常见的方法之一,并大量应用于DSE真菌物种多样性和亲缘关系的研究[8–11]。
沙地榆(var.)是白榆()的1个变种,属榆科(Ulmaceae)榆属()落叶乔木,主要分布在浑善达克沙地、科尔沁沙地和吉林西部松嫩平原等沙漠地带,可经受风沙侵袭、霜寒雪冻等各种自然灾害,是防风固沙的先锋树种。以沙地榆为核心组成的榆树疏林是沙地环境中最稳定、适应性最强的群落,具有较高的抗逆性和抗病性,是干旱地区不可缺少的树种[12–13]。本研究从沙地榆侧根内分离到1株不产孢的DSE真菌,运用形态学和ITS测序鉴定技术对其进行鉴定,以常见重要病原菌为指示菌进行抑菌活性研究,旨在为DSE真菌的基础研究提供参考,为生防菌株的筛选提供理论依据。
1 材料和方法
1.1 供试材料
供试样品采自内蒙古自治区赤峰市巴林右旗前进村沙地。在榆树疏林内设置3块样地,每块样地内选取胸径大于20 cm的植株,水平方向选取4个不同半径(以样株为中心,半径分别为1、3、5、7 m)样环,在5~30 cm深处顺着宿主植物主根进行挖掘,采集带有细根的根系,保证所取根系与所选植物的主根相连,并尽量采取带根尖的根段,将样品装入塑料袋密封后带回实验室,备用。
1.2 供试菌株的分离和纯化
将采回的样品用自来水冲洗干净、晾干,用0.1%氯化汞漂洗10~30 s,然后用无菌水反复冲洗,再用75 %乙醇漂洗0.5~1 min,最后用无菌水冲洗数次。将处理后的须根在无菌状态下切成0.1~0.2 cm的薄片,切口置于PDA培养基上,每皿接种3个须根薄片,置于26 ℃条件下黑暗培养3~7 d。观察培养皿中材料切口处长出的菌落,挑取切口处菌落边缘菌丝转接到新的PDA平板上,经2~3次纯化,得到纯化的菌株并编号(CFSZUpr105)保存。
1.3 供试菌株的形态学鉴定
观察内生真菌在PDA培养基上的培养特征,包括菌落形态、颜色、纹饰、质地、边缘形状以及菌落背面颜色、形态等特征。
挑取纯化培养后的菌株,做徒手切片,镜检菌株的产孢结构,如分生孢子梗、分生孢子形态及大小等。根据有无菌核、菌核特征、菌丝结构、菌落形态特征等指标,鉴定非产孢内生真菌的属类。DSE真菌菌落颜色较深,一般为棕色或黑色,形成菌核或微菌核,显微镜下观察菌丝为深色,具隔膜[14–15]。
1.4 供试菌株的rDNA–ITS鉴定
将纯培养菌丝加入液氮,充分研磨至粉末,取菌丝粉末约30 mg,用真菌基因组提取试剂盒提取基因组DNA,用天根生化科技(北京)有限公司Pfu PCRmix(Pfu DNA聚合酶链反应预混液)进行PCR扩增,引物为ITS1F/ITS4R (TCCgTAggTgAACCTg Cgg/TCCTCCgCTTATTgATATgC),对所得PCR产物进行切胶、纯化、回收(DNA凝胶纯化试剂盒,AXYGEN),委托北京奥科生物技术有限公司完成测序,所得序列用DNAMAN 6.0进行处理。
1.5 抑菌试验
1.5.1指示菌
病原菌灰葡萄孢菌Pers.(灰霉病)、黄瓜尖镰孢菌f. sp.J.H.Owen(黄瓜枯萎病)、胶孢炭疽菌(Penz.)Penz.& Sacc.(芍药炭疽病)来自赤峰学院微生物实验室;灰葡萄孢菌(灰霉病)菌株来自赤峰学院菌物实验室。
1.5.2试验方法
采用对峙培养法测量菌丝生长速率[16]。在无菌超净操作台上将指示菌菌块(直径约0.6 mm)接种于PDA培养基(直径为10 cm)中心,作为对照CK;在培养基中央接种指示菌(病原菌)菌块后,周围用3点接种法接种供试菌株,每个处理3次重复。全部处理于24 ℃倒置培养,在培养2、4、7 d时测量菌落直径,根据公式(1)计算其抑菌率。
=(CK-X)/CK×100% (1)
式中:为抑菌率;CK为对照病原菌菌落直径;X为对峙培养后本病原菌菌落直径。
1.6 数据处理
采用Excel 2017进行数据处理。测得的ITS序列拼接后运用BLAST程序在NCBI(美国国立生物技术信息中心)的GenBank数据库进行检索比对,从结果中挑选出同源性较高的DNA序列,查找相似性最高的物种,运用MEGA 5.01并按照最大似然法构建系统进化树,确定分离菌株的分类地位。发育树每个分支的统计学显著性分析重复次数为1000次。
2 结果与分析
2.1 DSE真菌菌株的鉴定
2.1.1Upr105菌落的形态鉴定
菌株Upr105在PDA培养基上经24 ℃黑暗培养,初期菌落呈白色绒毛状,稀疏,菌落背面呈浅橘色(图1–A、图1–B);后期菌落扩大加厚(图1–C),背面渐呈亮橘色(图1–D);培养第10天,菌落变为深褐色,菌落形成不明显的“环形带”结构(图1–E),背面呈灰褐色(图1–F)。

A 培养3 d后PDA上菌落形态;B 培养3 d后PDA上菌落背面形态;C 培养5 d后PDA上菌落形态;D 培养5 d后PDA上菌落背面形态;E 培养10 d后PDA上菌落形态;F 培养10 d后PDA上菌落背面形态。
2.1.2菌株Upr105的显微形态结构
从图2–A可以看出,菌株Upr105在人工培养基上不产生无性繁殖结构(如分生孢子、分生孢子梗等),菌丝浅棕色、厚壁、有隔膜,直径5.2~7.8 μm,有时会在菌丝侧面产生念珠状细胞,有时堆积在一起呈孢子堆状,孢子堆由膨大的孢子球组成,孢子球成熟后大小为(16.8~27.6) μm×(14.4~21.6) μm,单个细胞直径7.7~12 μm。内含油滴,淡棕色,念珠状细胞膨大后会破裂,产生分支(图2–B,图2–C)。
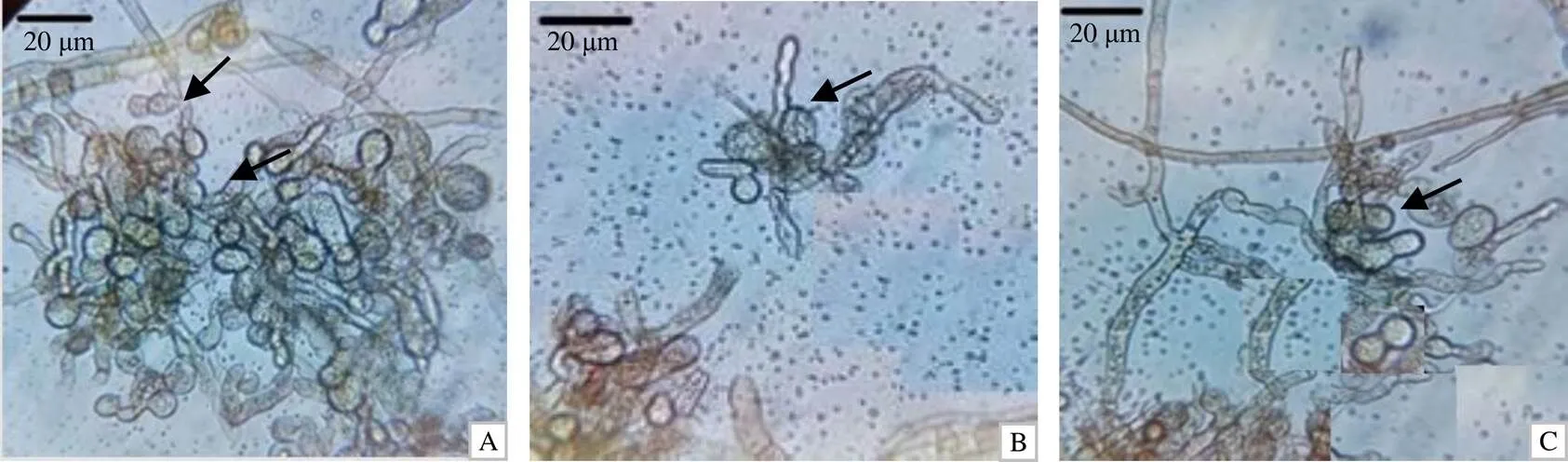
A 球形念珠状细胞形成孢子堆;B 念珠状细胞从菌丝侧面长出;C 孢子球成熟脱落后单细胞内含油滴。
2.1.3供试样品rDNA-ITS序列比对结果
将供试Upr105测得的ITS序列经NCBI GenBank数据库检索比对,获得了19个与供试菌株ITS序列具有较高相似度的物种。结果(表1)表明,供试菌株与3株黄毛薄盘菌相似度最高,分别为99.82%、99.05%和98.94%。与2个sp.序列相似度为98.56%和98.16%,与属其他序列相似度均在95%以上。
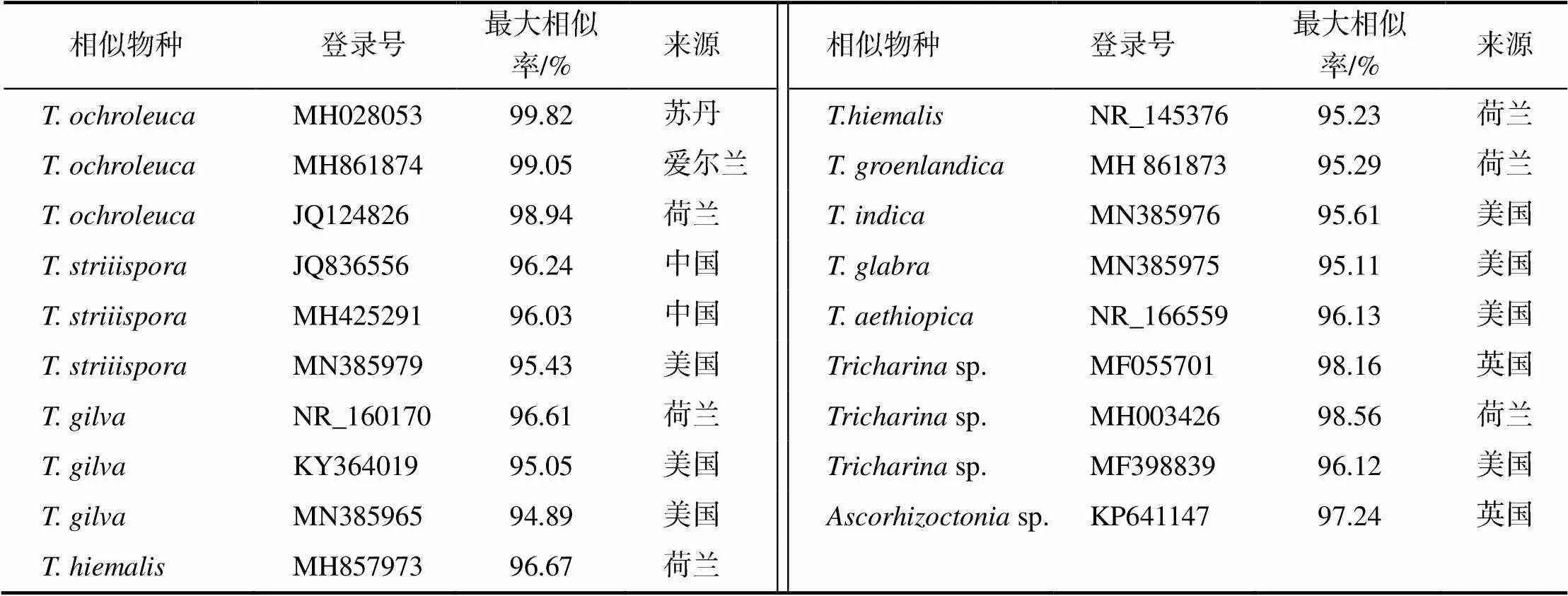
表1 与供试菌株Upr105序列相似的物种
2.1.4基于rDNA-ITS构建系统发育分析
以作为外群,将菌株Upr105的ITS序列与相似度较高的火丝菌科19个序列构建系统发育树。结果(图3)表明,Upr105与薄毛盘菌属多个种(spp.)的序列聚在一起,亲缘关系较近,且相似度均在95%以上。结合测序分析结果,将Upr105鉴定为薄毛盘菌的一个种(sp.)。

图3 菌株Upr105与相似物种的ITS序列构建的NJ系统发育树
2.2 Upr105的抑菌效应
用Upr105对黄瓜尖镰孢菌(f. sp.)、胶孢炭疽菌()、灰葡萄孢菌(Pers.)进行抑菌试验。结果(表2、图4)表明,菌株Upr105对病原菌均具有不同程度的抑制作用。
随着接种天数的增加,菌株Upr105对3种病原菌的抑菌率不断提高,培养第4 天时,抑制作用明显;培养7 d后,对3种病原菌的抑菌率达到最大值,菌丝已铺满培养基。对灰葡萄孢菌、尖刀镰孢菌、胶孢炭疽菌的最大抑菌率分别达68.6%、61.5%、42.9%;对灰葡萄孢菌、尖刀镰孢菌、胶孢炭疽菌的平均抑菌率分别为52.8%、44.5%、22.8%。对抑菌率进行方差分析,结果发现,接菌第2 天,菌株Upr105对3种病原菌的抑菌率差异显著(<0.05),对灰葡萄孢抑菌率、尖刀镰孢菌、胶孢炭疽菌的抑菌率依次降低。接种第4 天和第7 天,菌株Upr105对灰葡萄孢菌和尖刀镰孢菌的抑制作用差异不明显,但均高于对胶孢炭疽菌的抑制作用。

表2 供试菌株Upr105对3种病原菌的抑制率
同列数据后不同字母表示处理间的差异具有统计学意义(<0.05)。

A、B分别为Upr105对灰葡萄孢菌的正面、背面抑菌效果;C、D分别为Upr105对尖刀镰孢菌的正面、背面抑菌效果;E Upr105对胶孢炭疽菌的正面抑菌效果。
3 结论与讨论
本研究从沙地榆须根分离到1株DSE真菌并进行鉴定,结合培养特性、形态学特征和ITS序列分析及系统发育树结果,将其鉴定为薄毛盘菌(sp.)。根据文献[17–18]记载,中国薄毛盘菌属()真菌有8种,本研究结果是该属真菌物种鉴定、资源分布的补充。鉴别薄毛盘菌属的主要依据是子囊盘、子囊、子囊孢子、侧丝等有性繁殖结构的形态、大小、颜色等,但本研究中未发现有性子实体。EGGER等[19]运用限制性片段多样性(RFLP)方法对大量菌根菌进行了研究,证实除了少数变种外,绝大部分真菌从子实体提取的DNA序列与从宿主分离的纯培养物中提取的DNA序列相似度较高。PERRY等[20]研究了火丝菌科Pyronemataceae的系统发育树,发现包括薄毛盘菌属()在内的11个属许多种的非单系菌株DNA序列都是从宿主根部分离的纯培养物中获得TROCHA等[21]从云杉()幼苗分离到定殖于根部的菌根菌中的子囊菌,包括黄薄毛盘菌、威氏盘菌、土生空团菌、群集垫盘菌和芬兰瓶霉等。说明亦为云杉的内生菌。本研究从沙地榆须根分离到一株DSE真菌菌株Upr105,结合Yang等[14–15]描述的薄毛盘菌属()及子囊丝核菌()特征,将其初步鉴定为一种薄毛盘菌(sp.)。本研究主要根据Upr105菌株的无性结构,如菌落特征、菌丝及变态细胞、孢子球等的结构形态、颜色和大小进行形态特征的鉴定,发现该菌株的无性态与无性态高度相似[22],形态学鉴定结果可靠。根据BLAST结果显示,Upr105菌株与薄毛盘菌属多个种(spp.)相似度均在95%以上,与相似度高达99.82%,综合以上特征将其鉴定为薄毛盘菌属(sp)。
大量研究[3,6,10]表明,DSE真菌对植物病害具有生防作用。Chu等[23]将DSE真菌菊拟茎点霉()回接到松(spp.)幼苗中,发现该菌大大降低了松枯萎病的严重度。陈思杰等[24]从枸杞根部分离出的DSE真菌枝孢样枝孢霉()和交链孢菌()对枸杞根腐病菌()抑制率达91.45%。胡利杰[25]从枸杞()分离到的DSE真菌镰刀菌属(sp.)和蓝状菌属(sp.)真菌对胶孢炭疽菌()抑制率最高可达93%。显微结构观察发现,这些DSE真菌能缠绕并穿透胶孢炭疽菌菌丝,使其菌丝膨胀崩解。本研究中,Upr105菌株对黄瓜尖刀镰孢菌(f. sp.)、灰葡萄孢菌()和胶孢炭疽菌()表现出不同程度的抑制作用,对灰葡萄孢菌的抑制率达68.6%,抑菌效果较强,但其生防作用还须进一步做回接试验加以补充证明。由于该菌易于分离培养,适生性和抗逆性强,可以作为潜在的促生和生防菌剂进行进一步研究。
[1] JUMPPONEN A,TRAPPE J M.Dark septate endophytes:a review of facultative biotrophic root- colonizing fungi[J].The New Phytologist,1998,140(2):295–310.
[2] 郭良栋.内生真菌研究进展[J].菌物系统,2001,20(1):148–152.
[3] 刘茂军,张兴涛,赵之伟.深色有隔内生真菌(DSE)研究进展[J].菌物学报,2009,28(6):888–894.
[4] ROBINSON C H,WOOKEY P A,PARKER T C. Root-associated fungi and carbon storage in Arctic ecosystems[J].The New Phytologist,2020,226(1):8–10.
[5] RUOTSALAINEN A L,KAUPPINEN M,WÄLI P R,et al.Dark septate endophytes:mutualism from by-products? [J].Trends in Plant Science,2022,27(3):247–254.
[6] 代梦雪,张光群,范旭杪,等.胁迫生境深色有隔内生真菌生态分布与功能研究进展[J].应用与环境生物学报,2020,26(3):722–729.
[7] GRÜNIG C R,SIEBER T N.Molecular and phenotypic description of the widespread root symbiontgen. et sp.Nov.,formerly known as dark-septate endophyte type 1[J].Mycologia,2005,97(3):628–640.
[8] SANTOS M,CESANELLI I,DIÁNEZ F,et al.Advances in the role of dark septate endophytes in the plant resistance to abiotic and biotic stresses[J].Journal of Fungi (Basel),2021,7(11):939.
[9] 赵昕.荒漠梭梭DSE真菌物种多样性及其生态响应研究[D].保定:河北大学,2021.
[10] 伍晓丽,韩娟,刘飞,等.健康/根腐病黄连深色有隔内生真菌多样性研究及定殖调查[J].微生物学杂志,2021,41(4):55–63.
[11] 石经新.西北荒漠黑枸杞深色有隔内生真菌时空分布和促生抗旱研究[D].保定:河北大学,2021.
[12] 史宇飞,金永焕,金兰淑.国内榆树疏林研究现状[J].水土保持应用技术,2011(2):32–35.
[13] 杨艳成.沙地榆树疏林的土壤空间变异特征分析[J].农业与技术,2018,38(2):186.
[14] Yang C S,Korf R P.A monograph of the genusand of a new segregate genus,(Pezizales)[J].Mycotaxon,1985,24:467–531.
[15] Yang C S,Korf R P.gen.nov.andemend.,two genera for anamorphs of species assigned to(Discomycetes)[J]. Mycotaxon,1985,23:457–487.
[16] 田书鑫,刘南南,王桂清.对峙培养法在生防菌抑制效果研究中的应用[J].河南农业科学,2019,48(8):1–6.
[17] 张天宇.中国真菌志(第五十一卷):土壤中的暗色丝孢菌[M].北京:科学出版社,2019.
[18] 庄文颖.中国真菌志(第四十八卷):火丝菌科[M].北京:科学出版社,2014.
[19] EGGER K N,FORTIN J A.Identification of taxa of E-strain mycorrhizal fungi by restriction fragment analysis[J].Canadian Journal of Botany,1990,68(7):1482–1488.
[20] PERRY B A,HANSEN K R,PFISTER D H.A phylogenetic overview of the family(,)[J].Mycological Research,2007,111(5):549–571.
[21] Trocha LK,Rudawska M,Leski T,et alGenetic diversity of naturally established ectomycorrhizal fungi on Norway spruce seedlings under nursery conditions[J]. Microbial Ecology,2006,52(3):418–425.
[22] 袁志林,王佳莹,章初龙,等.一株植物内生无孢“类丝核菌”的鉴定方法[J].生物技术,2013,23(6):80–86.
[23] CHU H L,WANG H H,ZHANG Y N,et al.Inoculation with ectomycorrhizal fungi and dark septate endophytes contributes to the resistance ofspp.to pine wilt disease[J].Frontiers in Microbiology,2021,12:687304.
[24] 陈思杰,张涛,贾宝森,等.深色有隔内生真菌对枸杞根腐病菌抑菌活性[J].园艺学报,2022,49(7):1519–1531.
[25] 胡丽杰.宁夏枸杞深色有隔内生真菌的多样性及生防作用研究[D].银川:宁夏大学,2019.
Isolation, identification of a dark septate endophytes fromL. and function examination of antagonism to plant pathogenic fungi
TIAN Huimin,WANG Xiuyan,LI Xiaolan
(Chemical and Life Science of Chifeng University, Chifeng, Inner Mongolia 024000, China)
In order to develop new and cultivable fungi isolates with biocontrol function, we performed isolation, identification and antagonism of special dark septate endophytes(DSE) from fibrous roots ofby tissue isolation, morphology and ITS sequencing methods. Then the antagonism were tested by inhibition rates to the pathogens of common and important diseases such as fusarium wilt(f. sp.), gray mold() and plant anthracnose()by mycelial growth rate assay. The results showed that one DSE fungi(Upr105) was obtained fromroot. The colony was white fluffy, sparse, and light orange in the back, as the colony expanded and thickened, the back gradually became bright orange, and then turned dark brown and formed an inconspicuous “ring band” structure in the later stage on the medium, characterized by brown hyphae with a septum, showing “candida” enlarged cells in different shapes and not having sexual or asexual structure under the microscope. It was identified assp according to morphology and ITS sequencing, which taxonomically belonged toPyronemataceae and Pezizales. The results of the antagonism test found that this isolate had different levels of inhibitory effects on the three indicating isolates, at the second day after inoculation. The inhibitory rates to,f. sp.andwere gradually increasing and reached the highest level 68.6%, 61.5% and 42.9% until the seventh days on, with average inhibitory rate respectively 52.8%, 44.5% and 22.8%The screened isolates featured separatable, cultivate characters, with high inhibition rates to the indicative isolates. These isolates could serve as potential developable biocontrol fungus on common plant diseases.
; dark septate endophytes; isolation and identification; antagonism
Q939.5
A
1007-1032(2022)04-0416-07
田慧敏,王秀艳,李晓兰.沙地榆DSE真菌的分离鉴定和抑菌活性[J].湖南农业大学学报(自然科学版),2022,48(4):416–422.
TIAN H M,WANG X Y,LI X L.Isolation,identification of a dark septate endophytes fromL. and function examination of antagonism to plant pathogenic fungi[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):416–422.
http://xb.hunau.edu.cn

2021–12–29
2022–06–28
内蒙古自然科学基金项目(2021LHMS3001);赤峰学院重点实验室建设项目(CFXYZD202001);蒙东生物资源开发创新团队项目(cfxykycxtd202008)
田慧敏(1980—),女,内蒙古呼和浩特市人,硕士,副教授,主要从事菌物多样性资源调查、鉴定及开发利用研究,tiancfxy2009@ 126.com
责任编辑:毛友纯
英文编辑:柳正
