日粮添加白酒糟酿酒酵母培养物对断奶仔猪生长和肠道结构及功能的影响
2022-09-15张大城洪玲玲刘碧凡苏云李斌曹立红冯泽猛印遇龙
张大城,洪玲玲,刘碧凡,苏云,李斌,曹立红,冯泽猛,印遇龙
日粮添加白酒糟酿酒酵母培养物对断奶仔猪生长和肠道结构及功能的影响
张大城1,5,洪玲玲1,2,刘碧凡1,2,苏云1,3,李斌4,曹立红4,冯泽猛1*,印遇龙1
(1.中国科学院亚热带农业生态研究所,湖南 长沙 410125;2.湖南农业大学动物科技学院,湖南 长沙 410128;3.湖南师范大学生命科学学院,湖南 长沙 410081;4.安徽东方新新生物技术有限公司,安徽 亳州 236800;5.中国科学院大学现代农业科学学院,北京 100049)
选取12头体质量相近的健康断奶仔猪随机分为2组,对照组(CON组)和试验组(SDGS组)分别饲喂依据NRC(2012)仔猪营养需要标准配制的等氮等能基础日粮与4%白酒糟酿酒酵母培养物添加日粮,每组6个重复,预饲7 d后试验28 d,探索日粮添加白酒糟酿酒酵母培养物对断奶仔猪生长性能、器官指数、血清生化指标及肠道形态、肠黏膜紧密连接蛋白(TJ)和细胞因子mRNA相对表达量的影响,综合评价日粮添加白酒糟酿酒酵母培养物在断奶仔猪上的饲喂效果。结果表明:SDGS组的平均日增质量显著(<0.05)高于CON组的,平均日采食量和料重比则无显著(>0.05)变化;SDGS组的肝脏指数显著(<0.05)低于CON组的,脾脏、心脏、胰脏、肾脏的器官指数则无显著(>0.05)变化;血清生化指标(总蛋白、尿素、葡萄糖、免疫球蛋白M、免疫球蛋白G)在两组间的差异均无统计学意义(>0.05);与CON组相比,SDGS组的肠道形态更完整、排列整齐,但空肠和回肠隐窝深度显著(<0.05)增加,空肠绒毛高度显著(<0.05)降低,空肠和回肠绒毛高度与隐窝深度比值均显著(<0.01)降低,十二指肠隐窝深度有增加趋势(=0.081),十二指肠绒毛高度、绒毛高度与隐窝深度比值则无显著(>0.05)变化;SDGS组空肠黏膜TJ蛋白中闭合蛋白–3(Claudin–3)的mRNA相对表达量有降低趋势(=0.091),空肠黏膜TJ蛋白中闭合小环蛋白–1(ZO–1)、闭锁蛋白(occludin)与十二指肠和回肠黏膜TJ蛋白Claudin–3、occludin、ZO–1的mRNA相对表达量则均无显著(>0.05)变化;SDGS组十二指肠和回肠黏膜细胞因子白细胞介素–6(IL–6)的mRNA相对表达量显著(<0.05)降低,回肠黏膜细胞因子白细胞介素–10(IL–10)的mRNA相对表达量有降低趋势(=0.068),十二指肠黏膜细胞因子白细胞介素–1β(IL–1β)、IL–10,空肠黏膜细胞因子IL–6、IL–1β、IL–10和回肠黏膜细胞因子IL–1β的mRNA相对表达量则无显著(>0.05)变化。总之,依照NRC(2012)仔猪营养需要标准,添加4%白酒糟酿酒酵母培养物配制的等氮等能日粮可显著提高断奶仔猪平均日增质量,显著降低肝脏指数,改善肠道的免疫功能,且不会破坏肠道屏障结构,肠黏膜结构更完整,但肠道形态却向消化吸收能力降低的方向发展。可见,白酒糟酿酒酵母培养物可作为断奶仔猪配合日粮的原料,但使用时需要注意肠道健康的保护。
断奶仔猪;白酒糟酿酒酵母培养物;生长性能;血清生化指标;器官指数;肠道形态;紧密连接蛋白;细胞因子
中国是白酒生产大国。据国家统计局数据,2019年全国规模化白酒企业的酿酒总量达7.86×107L,并产生大量白酒糟。白酒糟的主要营养成分为粗蛋白、粗脂肪及残留的淀粉,检测发现其粗蛋白含量为13%~30%,粗脂肪含量为2.5%~8.0%,粗纤维含量为14%~35%,此外还含有微生物自溶产生的各类嘧啶、嘌呤、酵母菌细胞壁多糖、类脂化合物等物质[1]。中国饲料原料资源短缺,开发白酒糟为饲料原料可弥补缺口,但鲜白酒糟中水和中性洗涤纤维含量均较高,难于保存和利用,其中的鞣酸、草酸、植酸等抗营养因子还会降低适口性和营养物质利用率[2]。酵母发酵可提升饲料原料品质。酵母培养物是农业部饲料添加剂品种目录(2008)中列出的饲料添加剂,能为牲畜提供丰富的营养物质,同时也具有增强牲畜免疫力、保持牲畜健康状态的功效[3]。鲜白酒糟经酵母发酵后能提高总能和粗蛋白、氨基酸、细胞壁多糖、B族维生素含量及干物质、粗蛋白、粗纤维的消化率,且氨基酸的种类更丰富[4–5]。发酵白酒糟已广泛应用于猪、牛、羊、产蛋鸡和肉鸡的日粮中,用于制作高蛋白和高必需氨基酸含量的菌体饲料,具有提高动物生产性能和免疫能力、改善动物健康状态、增强动物肠道消化吸收能力的功效[6]。
现代生猪养殖普遍采用早期断奶技术,断奶期营养、环境和生理状态的突变造成的应激反应更为严重[7]。断奶应激会损坏肠道黏膜屏障结构,引起肠道形态变化和通透性增加,对猪的生长性能和健康状态不利[8–9]。发酵白酒糟丰富的营养物质和微生物产物有利于断奶仔猪的生长、降低断奶应激的负面影响,此外它还有特殊的芳香,能诱导采食。研究[10–11]表明,日粮中添加2%的发酵白酒糟可促进断奶仔猪的生长,且不影响饲料干物质、粗灰分、粗脂肪和多数氨基酸的表观消化率,日粮中添加25%发酵白酒糟不影响断奶仔猪的整体生长性能。目前,白酒糟及其深加工产物在畜禽日粮中的营养价值综合评估鲜见报道,也缺少其对畜禽肠道形态、肠黏膜屏障结构和免疫功能的影响研究。本研究中,设计符合NRC(2012)仔猪营养需要标准的等氮等消化能基础日粮和4%白酒糟酿酒酵母培养物添加日粮,探索日粮添加白酒糟酿酒酵母培养物对断奶仔猪生长性能、血清生化指标、器官指数、肠道形态、肠黏膜屏障结构和免疫功能的影响,综合评价其对断奶仔猪的饲喂效果,旨在为白酒糟酿酒酵母培养物在断奶仔猪日粮中的应用提供依据。
1 材料与方法
1.1 供试材料
12头初始体质量为(5.29±0.61) kg的21日龄健康杜×长×大断奶仔猪,购买自湖南正虹科技发展股份有限公司。供试白酒糟酿酒酵母培养物由安徽东方新新生物技术有限公司提供。其加工方法为:利用选育的酿酒酵母(, 2.3×108cfu/g)固体发酵安徽古井集团生产的白酒糟,待白酒糟的pH提高到适宜枯草芽孢杆菌生长的水平时,继续通过枯草芽孢杆菌(2.8×109cfu/g)固体发酵白酒糟生成酵母培养物,发酵结束后低温烘干并去除稻壳,最终得到白酒糟酿酒酵母培养物。该培养物的总能为19.53 MJ/kg,粗蛋白质、粗灰分、粗纤维、粗脂肪质量分数分别为31.12%、13.46%、11.00%、5.00%[4]。
1.2 试验设计
试验在中国科学院亚热带农业生态研究所动物实验室进行。将试验猪随机分为2组(CON组、SDGS组),每组6个重复。试验猪的初始体质量组间差异无统计学意义(>0.05)。参照文献[5]测定的白酒糟酿酒酵母培养物营养成分和消化率,依据NRC(2012)仔猪营养需要标准配制等氮等消化能基础日粮(CON组)和4%白酒糟酿酒酵母培养物添加日粮(SDGS组),分别饲喂2组试验猪。试验日粮的组成及营养成分列于表1。预试期7 d,正试期28 d。断奶仔猪于经过清洗和消毒的全漏粪猪舍中单栏饲养,其间每日对试验猪舍进行清扫,自然通风,并按照猪场标准管理程序对断奶仔猪驱虫和免疫。试验期间自由饮水和采食。
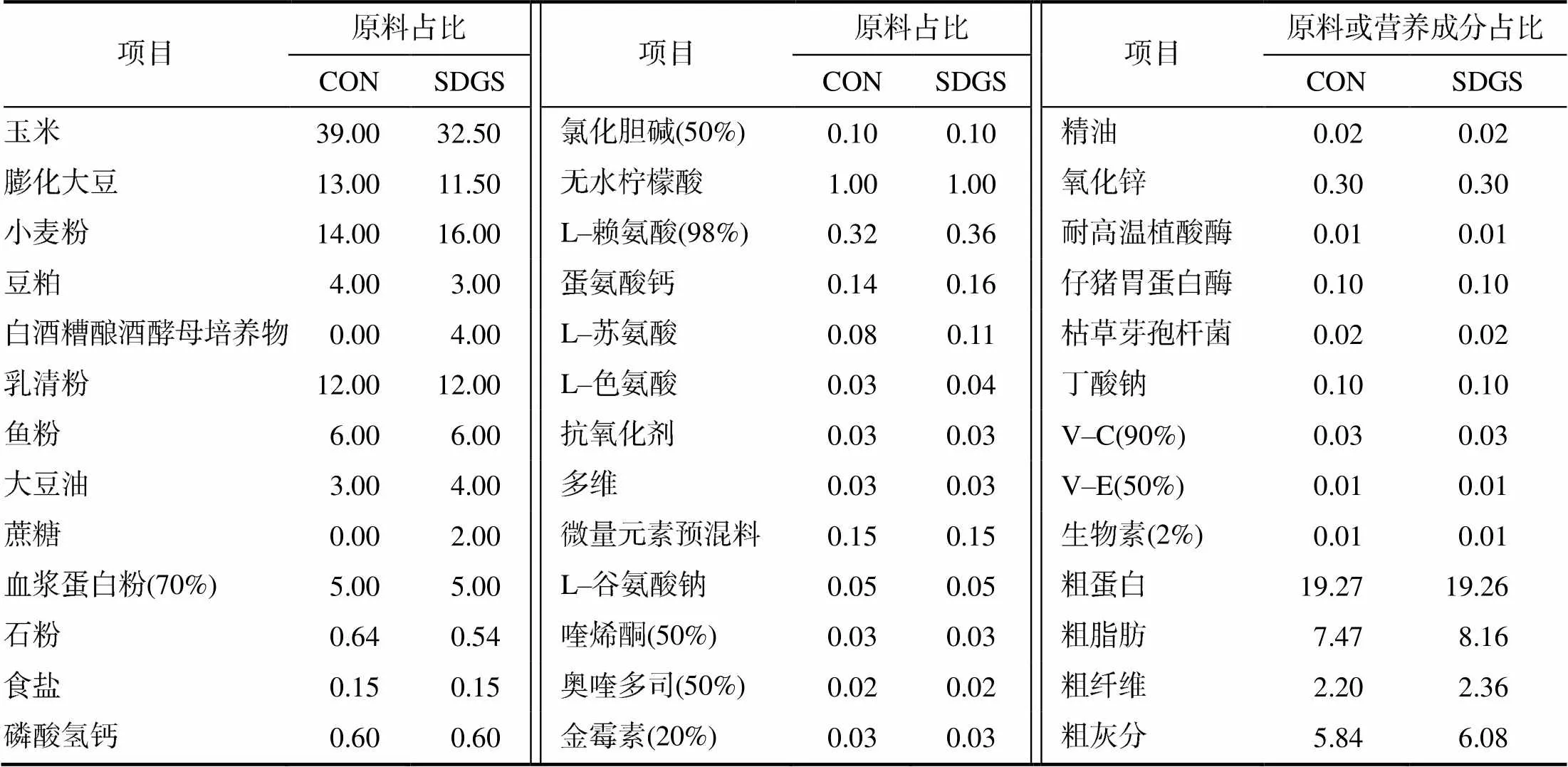
表1 试验日粮组成与营养水平(风干基础)
多维为每kg日粮提供核黄素12 mg、烟酸40 mg、泛酸25 mg、生物素0.25 mg、叶酸1.6 mg、硫胺素3.0 mg、V–B62.25 mg、V–A 10 000 IU、V–D31000 IU、V–E 80 IU、V–K32.0 mg、V–B120.03 mg;微量元素预混料为每kg日粮提供Fe (FeSO4) 150 mg、Zn (ZnO) 100 mg、Mn (MnSO4) 30 mg,Cu (CuSO4) 25 mg,I (KIO3) 0.5 mg,Co (CoSO4) 0.3 mg,Se (Na2SeO3) 0.3 mg,抗氧化剂4.0 mg;CON和SDGS组日粮的消化能分别为15 073.4、15 105.33 kJ/kg(计算值)。
1.3 测定指标及方法
1.3.1生长性能指标的计算
断奶仔猪在试验第1天和第29天08:00于空腹状态下逐头称取体质量,计算试验期的总增质量及平均日增质量(ADG)。每日记录单栏的喂料量和剩余料量,其差值为单栏断奶仔猪的日采食量,并结合试验天数计算平均日采食量(ADFI)。料重比(/)由ADG和ADFI的比值计算得出。
1.3.2器官指数的测定
屠宰、解剖试验猪后立即采集心脏、脾脏、胰脏、肝脏和肾脏,并使用吸水纸吸干脏器的表面水分,然后称取器官鲜质量,结合仔猪质量计算器官指数。
1.3.3血清生化指标的测定
饲养试验最后1日禁食过夜,并在结束当日08:00以前腔静脉采血的方式采集血样10 mL,肝素钠抗凝,4 ℃静置过夜,再离心(4 ℃、3000、10 min)取上清液(血清)于–20 ℃保存,待测。按照试剂盒(Roche)说明书的步骤,采用全自动生化分析仪(Cobas,C311)检测血清总蛋白(TP)、尿素(Urea)、葡萄糖(GLU)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)的浓度。
1.3.4肠道形态观察及其指标的测定
解剖试验猪后采集十二指肠、空肠、回肠肠段,并立即使用福尔马林溶液固定,用石蜡包埋再切片(5 μm),然后选用苏木精–伊红(HE)染色,中性树脂玻片封片后在计算机辅助显微镜(Micrometrics TM,Nikon Eclipse E200)下观察,测定绒毛高度和隐窝深度,计算绒毛高度与隐窝深度比值(/)。
1.3.5肠道黏膜紧密连接蛋白和细胞因子mRNA相对表达量的测定
主要测定黏膜紧密连接(TJ)蛋白中闭合蛋白–3 (Claudin–3)、闭合小环蛋白–1(ZO–1)、闭锁蛋白(occludin)和黏膜细胞因子中白细胞介素–1β (IL–1β)、白细胞介素–6(IL–6)、白细胞介素–10 (IL–10)的mRNA相对表达量。解剖试验猪后用载玻片轻轻刮取十二指肠、空肠和回肠的肠黏膜,并立即用液氮速冻后转–80℃保存。使用试剂盒(TRIZol)提取十二指肠、空肠和回肠的黏膜总RNA,并溶解于焦碳酸二乙酯(DEPC)溶液中,再运用微量分光光度计(NanoDrop ND2000)测定RNA的纯度和浓度。按照试剂盒(Prime–Script TM RT Reagent Kit with gDNA Eraser,TaKa–Ra)的操作步骤,取1 μg样品反转录合成cDNA。按照试剂盒(SYBR Premix ExII)的说明构建反应体系。荧光定量PCR的反应条件为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火延伸30 s,共进行40次循环。熔解曲线的制作严格依照荧光定量PCR仪(Roche 480 II)的操作说明书进行。以–肌蛋白为内参基因(),引物列于表2。引物序列从美国国家生物技术信息中心(Bethesda,MD)下载并由上海生工生物工程有限公司合成。
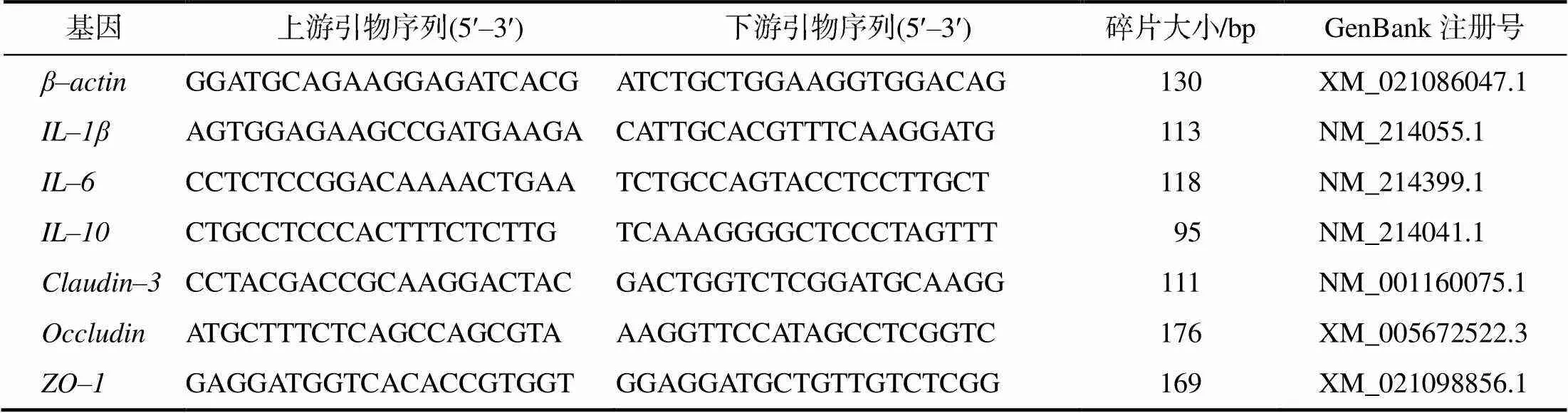
表2 引物序列信息
1.4 数据统计与处理
采用Excel 2016对所有试验数据进行归纳整理,运用SPSS 22.0中的独立样本检验进行统计分析。
2 结果与分析
2.1 白酒糟酿酒酵母培养物对断奶仔猪生长性能的影响
由表3可知,SDGS组断奶仔猪的ADG显著(<0.05)高于CON组的;ADFI和/两组间的差异无统计学意义(>0.05),但与CON组相比,SDGS组断奶仔猪的ADFI增加,/降低。可见,SDGS组断奶仔猪的生长性能得到提升。

表3 供试断奶仔猪的生长性能
2.2 白酒糟酿酒酵母培养物对断奶仔猪器官指数的影响
由表4可知,SDGS组断奶仔猪的肝脏指数显著(<0.05)低于CON组的;脾脏指数、心脏指数、肾脏指数、胰脏指数则无显著(>0.05)变化。
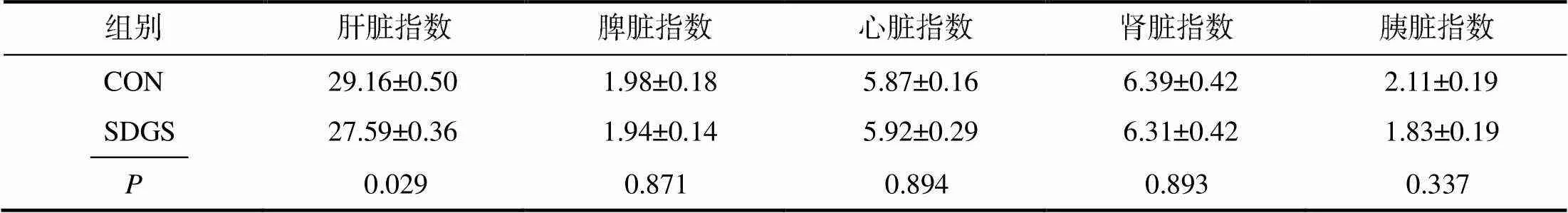
表4 供试断奶仔猪的器官指数
2.3 白酒糟酿酒酵母培养物对断奶仔猪血清生化指标的影响
由表5可知,断奶仔猪血清Urea、GLU浓度和TP、IgG、IgM质量浓度在两组间的差异均无统计学意义(>0.05)。
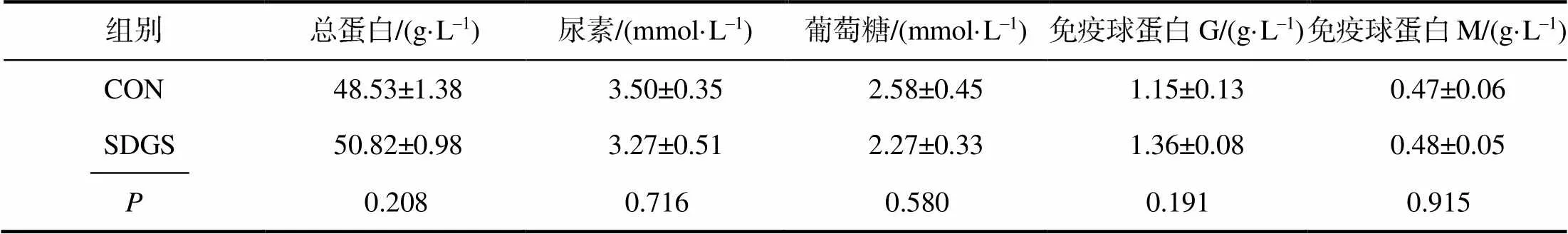
表5 供试断奶仔猪的血清生化指标
2.4 白酒糟酿酒酵母培养物对断奶仔猪肠道形态的影响
从图1可以看出,CON组的肠道绒毛排列杂乱、变形扭曲、顶端呈平顶状且上皮细胞有脱落现象;SDGS组的肠道绒毛完整、排列整齐,更加密集。由表6可知,与CON组相比,SDGS组断奶仔猪的十二指肠隐窝深度有降低趋势(=0.081),空肠和回肠的隐窝深度显著(<0.05)增加;空肠的绒毛高度显著(<0.05)降低;空肠和回肠的/均显著(<0.05)降低;十二指肠的绒毛高度、/和回肠绒毛的高度均无显著(>0.05)变化。
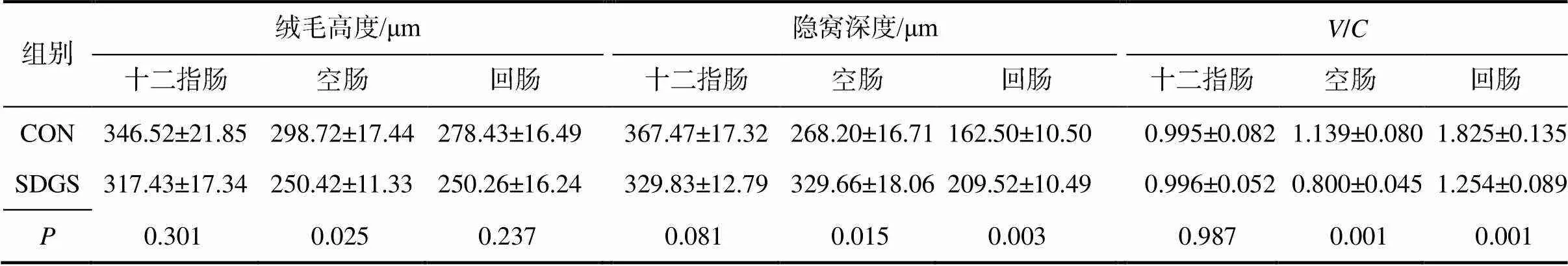
表6 供试断奶仔猪的肠道形态指标
2.5 白酒糟酿酒酵母培养物对断奶仔猪肠道黏膜紧密连接蛋白mRNA相对表达量的影响
由表7可知,与CON组相比,SDGS组断奶仔猪空肠黏膜紧密连接蛋白claudin–3的mRNA相对表达量有降低趋势(=0.091);其他所测黏膜紧密连接蛋白的mRNA相对表达量则无显著(>0.05)变化。
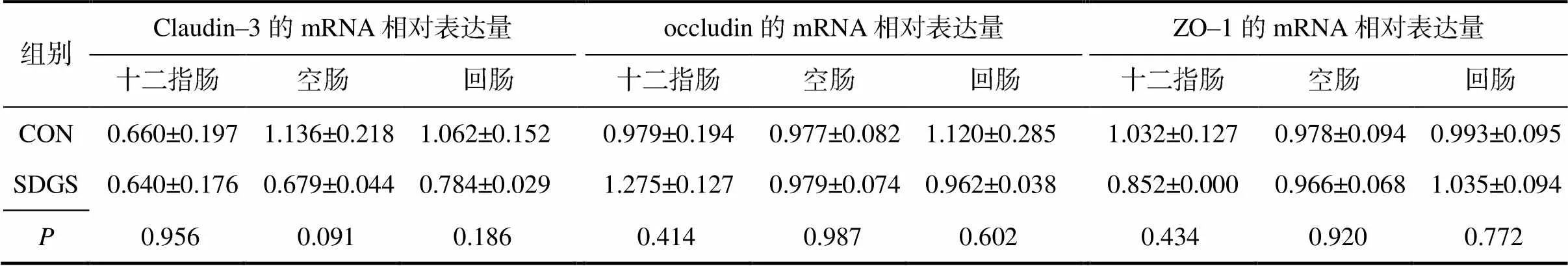
表7 供试断奶仔猪肠道黏膜紧密连接蛋白的mRNA相对表达量
2.6 白酒糟酿酒酵母培养物对断奶仔猪肠道黏膜细胞因子mRNA相对表达量的影响
由表8可知,与CON组相比,SDGS组断奶仔猪十二指肠和回肠黏膜的细胞因子IL–6的mRNA相对表达量显著(<0.05)降低;回肠黏膜细胞因子IL–10的mRNA相对表达量有降低趋势(=0.068);其他所测黏膜细胞因子的mRNA的相对表达量则无显著(>0.05)变化。
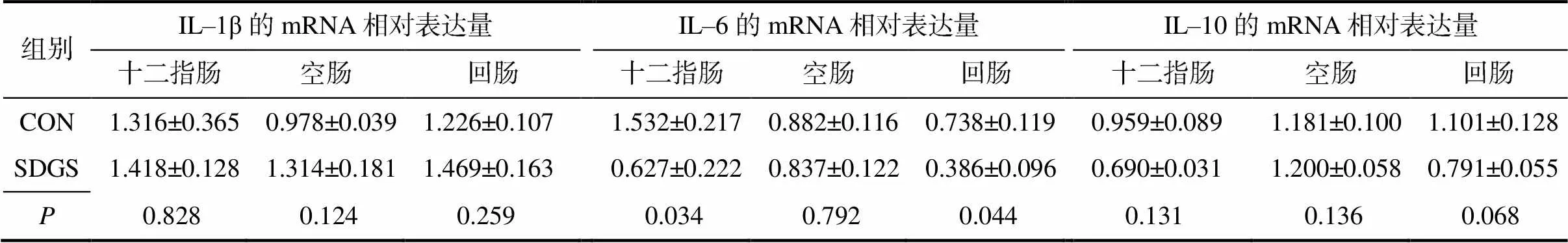
表8 供试断奶仔猪肠道黏膜细胞因子的mRNA相对表达量
3 结论与讨论
发酵能改善饲料营养成分并提高消化率,生成益生元、有益菌及其代谢产物[12–13]。酿酒酵母发酵白酒糟后,发酵白酒糟的粗纤维含量下降,蛋白质、氨基酸、酵母菌代谢物含量升高,产生丰富的具有改善肠道微生物菌群、增强免疫力作用的甘露寡糖和–葡聚糖,同时纤维素酶等活性增强,更利于消化吸收[4,14–16]。周建民等[17]研究显示,肉仔鸡日粮添加1%白酒糟酵母培养物可显著降低生长后期的料重比,同时平均日增质量也有增高趋势。本研究中,与CON组相比,SDGS组断奶仔猪的ADG显著增加,ADFI和/则无显著变化,生长性能得到提升。其原因可能是白酒糟酿酒酵母培养物中高活性的纤维素酶和能够优化肠道微生物菌群与提升免疫力的甘露寡糖、–葡聚糖共同作用,使得饲料营养成分利用率增高,带动生长性能提升。
血清TP含量与机体的肝脏蛋白质合成能力相关[18]。Urea含量越低,代表氮利用率越高[19]。血清GLU含量一般是稳定的,只在应激或病理状态下出现大幅波动[20]。IgM是免疫反应最先产生的抗体,IgG是介导体液免疫的抗体,具有抗细菌和病毒的作用,两者都能反映体液免疫能力[21]。本研究中,2组断奶仔猪血清的GLU、Urea浓度和TP、IgG、IgM质量浓度的差异均无统计学意义,表明日粮中添加4%白酒糟酿酒酵母培养物不会对断奶仔猪机体蛋白质合成、氮利用率和病理及应激状态产生负面影响,也不会影响断奶仔猪的体液免疫能力。
肝脏是机体代谢的中枢,在脂肪合成与分解代谢、糖异生上有着重要作用,是机体健康状况的反映器官[22]。MATUR等[23]研究表明,酵母培养物能提高种鸡肝脏消化酶的活性。本研究中,SDGS组的断奶仔猪肝脏指数较CON组的显著降低,这可能得益于白酒糟酿酒酵母中的丰富纤维素及半纤维素等非淀粉多糖成分,能够促进肝脏脂肪排除,同时酿酒酵母培养物本身能增强肝脏消化酶的活性,两者共同作用下肝脏负担减轻,从而使得肝脏指数降低[14]。此外,日粮中添加4%白酒糟酿酒酵母培养物不会对断奶仔猪心脏、胰脏、脾脏等器官指数产生显著影响。
小肠黏膜表皮有大量绒毛,每个绒毛都是营养物质消化、吸收和转运的基本单位,绒毛高度、隐窝深度及其比值是衡量小肠消化吸收功能的主要指标[24]。绒毛高度下降会导致绒毛表面积变小,消化吸收功能受损;隐窝深度反映细胞生成率,隐窝深度变小,表示细胞成熟度更好,分泌功能更强;小肠功能可由/综合评价,其下降意味着绒毛高度降低或者隐窝深度增高,伴随着肠道形态和功能受损,消化吸收功能变差[25]。周建民等[17]研究表明,日粮中添加1%白酒糟酿酒酵母培养物可显著提高产蛋鸡空肠的绒毛高度和隐窝深度,空肠/有增加趋势,但添加2%白酒糟酿酒酵母培养物则对产蛋鸡空肠的绒毛高度、隐窝深度及/均无显著影响。KUMAR等[26]研究发现,日粮中添加活性酿酒酵母可显著提高仔猪小肠肠道的绒毛高度和/。本研究中,日粮中添加4%白酒糟酿酒酵母培养物会影响断奶仔猪空肠和回肠的肠道形态,空肠绒毛高度显著降低、隐窝深度显著增加、/显著降低;回肠隐窝深度显著增加,/显著降低;十二指肠的隐窝深度有增加趋势,但肠道黏膜完整性却得到改善。肠黏膜细胞增殖会使隐窝深度增加,肠黏膜细胞凋亡则导致绒毛高度下降;膳食纤维具有诱导肠黏膜细胞增殖和凋亡的作用,导致肠黏膜细胞更新速度变快,引起/下降[27]。白酒糟酿酒酵母培养物中大量的纤维素和半纤维素等膳食纤维,可能是引起断奶仔猪空肠和回肠肠黏膜/降低的原因。SDGS组更加完整的肠黏膜结构则可能与日粮中丰富的甘露寡糖和–葡聚糖有关,这2种糖类物质具有改善肠道微生物菌群的功效,可减轻断奶期间肠道微生物菌群的紊乱对肠黏膜的破坏作用[15]。
肠道上皮细胞之间的紧密连接在肠道机械屏障中发挥着重要作用,它以箍状形式紧紧地包围小肠上皮细胞,由50多种结构和功能蛋白构成,结构蛋白claudin、occludin用于构成紧密连接的结构骨架,功能蛋白ZO–1连接细胞及膜蛋白并传递信号[28]。本研究中,十二指肠、空肠、回肠黏膜的紧密连接蛋白claudin–3、occludin、ZO–1相对表达量在两组间的差异均无统计学意义,表明日粮中添加4%白酒糟酿酒酵母培养物不会对断奶仔猪肠道屏障产生不良影响。
炎性细胞因子是一类具有介导细胞免疫功能的内源性多肽,主要包括肿瘤坏死因子(TNF–α)、IL–1β、IL–6、IL–10等[29]。IL–1β能刺激APC和T细胞活化,促进B细胞合成分泌抗体,增强机体免疫力[30]。IL–6可使B细胞前体细胞产生合成抗体的能力,IL–10同时具有免疫抑制和刺激作用[31]。LI等[32]研究表明,日粮中添加酿酒酵母可降低断奶仔猪血浆IL–6含量,提高IL–10水平,促炎细胞因子减少,抗炎细胞因子增加,提高了猪的体液免疫能力,调节了细胞免疫功能。ZANELLO等[33]研究发现,酿酒酵母可降低大肠埃希菌介导的小肠上皮细胞IL–1β和IL–6的mRNA相对表达量。本研究中,SDGS组断奶仔猪十二指肠和回肠黏膜IL–6的mRNA相对表达量显著降低,回肠黏膜IL–10的mRNA相对表达量有下降趋势。可能的原因是白酒糟酿酒酵母培养物中含有丰富的β–葡聚糖,可促进促炎因子受体拮抗剂的分泌,抑制促炎因子IL–6的mRNA表达,肠道体液免疫能力改善,防止了断奶应激下仔猪肠道过度产生促炎因子导致的炎症,调节了肠道免疫能力,有益于断奶仔猪肠道健康和生长性能的提升。
相对于基础日粮,添加4%白酒糟酿酒酵母培养物替代部分原料制作的等氮等消化能日粮,可显著提高断奶仔猪平均日增质量,显著降低肝脏指数,调节肠道的免疫功能且不会对肠道屏障结构造成破坏,但空肠和回肠的肠道形态有向着消化吸收能力降低的方向改变的趋势。综合考虑,4%白酒糟酿酒酵母培养物可替代部分饲料原料制作等氮等消化能的日粮,但要注意对肠道消化功能的保护。
[1] 刘志云,钟晓霞,姚焰础,等.白酒糟生物饲料及其在猪生产上的应用现状[J].动物营养学报,2020,32(1):15–20.
[2] WANG S J,GUO C H,ZHOU L,et al.Effects of dietary supplementation with epidermal growth factor-expressingon duodenal development in weaned piglets[J].The British Journal of Nutrition,2016,115(9):1509–1520.
[3] XU L P.Yeast culture and its application in feed[J]. Agricultural Science & Technology,2014,15(12):2183–2186.
[4] 陈颀,包显颖,苏云,等.白酒糟酿酒酵母培养物营养成分分析及其在猪饲料中的应用价值评估[J].动物营养学报,2017,29(8):2826–2835.
[5] 张博润,刘玉方,何秀萍,等.发酵白酒糟生产饲料蛋白的培养条件及产物分析[J].微生物学报,1997,37(4):281–285.
[6] 李政一.复合菌种协同发酵混合酒糟制取高蛋白多酶菌体饲料[J].环境科学,2002,23(S1):112–114.
[7] 夏冰,孟庆石,解竞静,等.21日龄断奶对仔猪肠道形态、肠道通透性及肠黏膜屏障的影响[J].动物营养学报,2018,30(6):2097–2108.
[8] HU C H,XIAO K,LUAN Z S,et al.Early weaning increases intestinal permeability,alters expression of cytokine and tight junction proteins,and activates mitogen-activated protein kinases in pigs[J].Journal of Animal Science,2013,91(3):1094–1101.
[9] POHL C S,MEDLAND J E,MACKEY E,et al.Early weaning stress induces chronic functional diarrhea,intestinal barrier defects,and increased mast cell activity in a porcine model of early life adversity[J]. Neurogastroenterology and Motility the Official Journal of the European Gastrointestinal Motility Society,2017,29(11):10.1111/nmo.13118.
[10] 黎智华,张婷,苏家宜,等.发酵白酒糟对断奶仔猪生长性能、消化代谢和氮排放的影响[J].动物营养学报,2018,30(7):2807–2816.
[11] WISEMAN M,MCBRIDE B,LI J,et al.Effects of steeped or fermented distillers dried grains with solubles on growth performance in weanling pigs[J].Journal of Animal Science,2017,95(8):3563–3578.
[12] SHI C,ZHANG Y,YIN Y,et al.Amino acid and phosphorus digestibility of fermented corn-soybean meal mixed feed withandfed to pigs[J].Journal of Animal Science,2017,95(9):3996–4004.
[13] 李成舰,蒋雪,杨大盛,等.混菌发酵对杏鲍菇菌糠营养成分及其体外瘤胃发酵的影响[J].湖南农业大学学报(自然科学版),2020,46(4):443–448.
[14] REN H W,XING J M,LI J P,et al.Combined effect of ultrasound andpretreatments of distillers grains for fermentable sugars by enzymatic hydrolysis[J].Journal of Biobased Materials and Bioenergy,2016,10(6):432–441.
[15] PRICE K L,TOTTY H R,LEE H B,et al.Use offermentation product on growth performance and microbiota of weaned pigs duringinfection[J].Journal of Animal Science,2010,88(12):3896–3908.
[16] 杨东吉,张静静,朱随亮,等.酿酒酵母培养物替代抗生素对断奶仔猪生长性能、养分消化率及盲肠微生物区系的影响[J].动物营养学报,2020,32(1):138–147.
[17] 周建民,马友彪,张海军,等.白酒糟酵母培养物对肉仔鸡生长性能、血清抗氧化指标和肠道形态结构的影响[J].动物营养学报,2019,31(5):2357–2366.
[18] NIETO R,BAREA R,LARA L,et al.Lysine requirement relative to total dietary protein for optimum performance and carcass protein deposition of Iberian piglets[J]. Animal Feed Science and Technology,2015,206:48–56
[19] 魏亚浩,杜鹏飞,张清海,等.壳寡糖复合物肠道营养保健剂对断奶仔猪生长性能、血清生化指标与粪便微生物区系的影响[J].动物营养学报,2019,31(12):5779–5791.
[20] 黎育颖,韩慧,王倩,等.饲粮不同谷氨酸和天冬氨酸水平对仔猪器官指数、血清生化指标和激素含量的影响[J].动物营养学报,2018,30(4):1303–1310.
[21] LAZAREVIC M,SPRING P,SHABANOVIC M,et al.Effect of gut active carbohydrates on plasma IgG concentrations in piglets and calves[J].Animal,2010,4(6):938–943.
[22] BECHMANN L P,HANNIVOORT R A,GERKEN G,et al.The interaction of hepatic lipid and glucose metabolism in liver diseases[J].Journal of Hepatology,2012,56(4):952–964.
[23] MATUR E,ERGUL E,AKYAZI I,et al.The effects ofextract on the weight of some organs,liver,and pancreatic digestive enzyme activity in breeder hens fed diets contaminated with aflatoxins[J]. Poultry Science,2010,89(10):2213–2220.
[24] 杨凤娟,曾祥芳,谯仕彦.罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J].中国农业科学,2014,47(22):4506–4515.
[25] EID Y Z,OHTSUKA A,HAYASHI K.Tea polyphenols reduce glucocorticoid-induced growth inhibition and oxidative stress in broiler chickens[J].British Poultry Science,2003,44(1):127–132.
[26] KUMAR S,VERMA A K,AGARWAL N,et al.Effect ofon growth,nutrient digestibility,faecal quality and intestinal morphology in early-weaned crossbred piglets[J].Animal Nutrition and Feed Technology,2013,13(2):291–302.
[27] JIN L,REYNOLDS L P,REDMER D A,et al.Effects of dietary fiber on intestinal growth,cell proliferation,and morphology in growing pigs[J].Journal of Animal Science,1994,72(9):2270–2278.
[28] 张金卫,林汉杰,韩凌.肠上皮细胞紧密连接的研究进展[J].中国医药导报,2015,12(6):160–163.
[29] STEVEN M,OPAL M D,VERA A,et al.Anti- inflammatory cytokines[J].Chest,2000,117(4):1162–1172.
[30] SHAW M H,KAMADA N,KIM Y G,et al. Microbiota-induced IL-1β,but not IL-6,is critical for the development of steady-state TH17 cells in the intestine[J]. The Journal of Experimental Medicine,2012,209(2):251–258.
[31] 马茂涛,林少伟,殷光文,等.牡蛎多糖锌配合物对脂多糖刺激断奶仔猪生长性能和肠道健康的影响[J].动物营养学报,2017,29(4):1359–1366.
[32] LI J J,XING J,LI D F,et al.Effects of beta-glucan extracted fromon humoral and cellular immunity in weaned piglets[J].Archives of Animal Nutrition,2005,59(5):303–312.
[33] ZANELLO G,MEURENS F,BERRI M,et al.decreases inflammatory responses induced by F4+enterotoxigenicin porcine intestinal epithelial cells[J].Veterinary Immunology and Immunopathology,2011,141(1/2):133–138.
Effects of addingculture from distiller’s grains in diet on growth, intestinal structure and function of weaned piglets
ZHANG Dacheng1,5,HONG Lingling1,2,LIU Bifan1,2,SU Yun1,3, LI Bin4,CAO Lihong4,FENG Zemeng1*,YIN Yulong1
(1.Institute of Subtropical Agricultural Ecology, Chinese Academy of Sciences, Changsha, Hunan 410125, China; 2.College of Animal Science and Technology, Hunan Agricultural University, Changsha, Hunan 410128, China; 3.College of Life Sciences, Hunan Normal University, Changsha, Hunan 410081; 4.Anhui Dongfang Xinxin Biotechnology Co. Ltd, Bozhou, Anhui 236800, China; 5.College of Advanced Agriculture Sciences, University of Chinese Academy of Sciences, Beijing 100049, China)
Twelve healthy weaned piglets with similar body weight were randomly divided into two groups, the control group(CON group) and the experimental group(SDGS group), and fed with an isonitrogenous isoenergetic basal diet formulated according to the NRC(2012) nutritional requirements standard for piglets and the 4% distiller’s grainsculture-supplemented diet, respectively, with six replicates in each group, the last time of the experiment was conducted for 28 days after 7 days of pre-feeding. The effects of dietary supplementation ofculture containing distiller’s grains on growth performance, organ index, serum biochemical indexes, intestinal morphology, and relative mRNA expression levels of intestinal mucosa tight junction(TJ) proteins and cytokines of weaned piglets were collected to comprehensively evaluate the feeding effects of dietary supplementation ofculture containing distiller’s grains on weaned piglets. The results showed that the average daily gain weight of the SDGS group was significant(<0.05) higher than that of the CON group, and the average daily feed intake and feed/weight ratio had no significant(>0.05) changes. The liver index of the SDGS group was significantly(<0.05) lower than that of the CON group, while the organ indexes of spleen, heart, pancreas and kidney showed no significant(>0.05) changes. The differences of serum biochemical indexes(total protein, urea, glucose, immunoglobulin M and immunoglobulin G) between the two groups were not statistically significant(>0.05). Compared with CON group, the intestinal morphology of the SDGS group was more complete and aligned, but the jejunal and ileal crypt depth were significantly(<0.05) increased, and the jejunal villus height was significantly(<0.05) decreased. The ratios of jejunal and ileal villus height to crypt depth were all significantly(<0.05) decreased, while the duodenal crypt depth showed an increasing trend(=0.081), but the duodenal villus height, crypt depth and the ratio of villus height to crypt depth showed no significant(>0.05) changes. In the SDGS group, the mRNA relative expression levels of Claudin-3 in the TJ protein of jejunal mucosa were decreased(=0.091), while the relative mRNA expression levels of closed small loop protein-1(ZO-1) and occludin in the jejunal mucosa TJ protein and the mRNA expression levels of Claudin-3, occludin and ZO-1 in the duodenal and ileal mucosa TJ proteins were not significantly changed(>0.05). In the SDGS group, the mRNA relative expression levels of cytokine IL-6(IL-6) in duodenal and ileal mucosa were significantly(<0.05) decreased, while the mRNA relative expression level of cytokine IL-10 in ileal mucosa was decreased(=0.068), the mRNA relative expression levels of cytokine IL-1β(IL-1β), IL-10, IL-6, IL-1β, IL-10 and IL-1β in jejunum and IL-1β in ileal mucosa were not significant(>0.05). In conclusion, according to the NRC(2012) nutritional requirements standard for piglets, the isonitrogenous isoenergetic diet prepared with the addition of 4% distiller’s grainsculture could significantly improve the average daily gain weight of weaned piglets, significantly reduce liver index, improve intestinal immune function without the intestinal barrier structure damage and showing more complete intestinal mucosa structure, while the intestinal morphology development showed a trend towards the reduction of digestion and absorption capacity. It could be seen that theculture from distiller’s grains could be used as the raw material for the diets of weaned piglets, but attention should be paid to the protection of intestinal health during its usage.
weaned piglet;culture from distillers grain; growth performance; serum biochemistry index; organ index; intestinal morphology; tight junction protein; cytokine
S828.5
A
1007-1032(2022)04-0474-09
张大城,洪玲玲,刘碧凡,苏云,李斌,曹立红,冯泽猛,印遇龙.日粮添加白酒糟酿酒酵母培养物对断奶仔猪生长和肠道结构及功能的影响[J].湖南农业大学学报(自然科学版),2022,48(4):474–482.
ZHANG D C,HONG L L,LIU B F,SU Y,LI B,CAO L H,FENG Z M,YIN Y L.Effects of addingculture from distiller’s grains in diet on growth, intestinal structure and function of weaned piglets[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):474–482.
http://xb.hunau.edu.cn

2020–12–21
2022–07–20
广西重点研发计划项目(2019AB19003);国家“十三五”重点研发计划项目(2016YFD0700200);安徽东方新新生物技术有限公司课题(Y640032100)
张大城(1995—),男,四川绵阳人,硕士研究生,主要从事单胃动物营养与分子生物学研究,320493342@qq.com;*通信作者,冯泽猛,博士,副研究员,主要从事智能养殖研究,fengzemeng@isa.ac.cn
责任编辑:邹慧玲
英文编辑:柳正
