草鱼PepT2基因的克隆及其表达分析
2022-09-15刘金梦秦贝贝黎航航肖调义苏建明
刘金梦,秦贝贝,黎航航,肖调义,苏建明
草鱼基因的克隆及其表达分析
刘金梦1,2,秦贝贝1,2,黎航航2,肖调义1,2,苏建明3*
(1.湖南省特色水产资源利用工程技术研究中心,湖南 长沙 410128;2.湖南农业大学动物科学技术学院,湖南 长沙 410128;3.湖南农业大学动物医学院,湖南 长沙 410128)
采用RT–PCR和cDNA末端快速扩增技术克隆草鱼()II型小肽转运载体()基因全长cDNA序列,对其进行生物信息学和共线性分析,并采用实时荧光定量PCR技术检测分析健康草鱼基因在不同组织中的表达情况。结果表明:草鱼基因的cDNA序列全长为2733 bp,包括开放阅读框2169 bp(编码722个氨基酸残基),5′非编码区82 bp和3′非编码区482 bp;草鱼基因结构含有20个外显子和19个内含子;预测蛋白相对分子质量为8.032×104,等电点为6.01,该蛋白具有与哺乳动物同源蛋白类似的12个螺旋跨膜结构,并且在跨膜区9和10之间有1个大的外环,跨膜区氨基酸高度保守,含有6个蛋白激酶C磷酸化位点和3个N–糖基化位点;预测的PepT2蛋白三级结构包含有18个α–螺旋和21个β–折叠;氨基酸序列同源性分析结果显示,草鱼PepT2氨基酸序列与斑马鱼()的同源性最高,为86.65%,与其他所比较的物种的同源性则为52.83%~68.15%;系统进化树分析表明,草鱼与斑马鱼的亲缘关系最近;与斑马鱼相比,草鱼所在的染色体保留着大多数基因,具有保守的基因块;实时荧光定量表达分析表明,草鱼在肠道中的表达量最高,在肾脏中的表达量次之。
草鱼;小肽转运载体;;克隆;生物信息学分析;共线性分析;组织表达
草鱼()隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)雅罗鱼亚科(Leuciscinae)草鱼属(),是中国产量最大的大宗淡水鱼类养殖品种,其生长速度快、经济效益高,是淡水经济鱼类养殖重要的组成部分。2019年,中国草鱼产量约为5.53×106t[1]。饲料的消化、吸收与利用是影响鱼类养殖生产的主要因素之一。在鱼类饲料中,蛋白质是关键营养物质之一。饲用蛋白质经消化道消化分解为游离氨基酸和小肽,分别由氨基酸转运载体和小肽转运载体吸收转运进入体内[2]。小肽转运载体属于依赖质子的寡肽转运载体(POT)家族成员[3],它们以H+梯度为动力,将肠腔和其他组织中的小肽从胞外转运到胞内,对小肽的吸收起关键作用[4]。1994年,FEI等[5]从兔cDNA文库中克隆了小肽转运载体,并将其命名为Ⅰ型肽转运载体();同年,LIU等[6]在人肾脏cDNA库中发现并克隆了II型小肽转运载体()基因;2006年,ROMANO等[7]在斑马鱼中鉴定出PepT2型肽转运体。研究[5,8]表明,PepT1是低亲和力、高容量的蛋白,主要在肠上皮细胞中表达,对小肽的吸收起重要作用。PepT2是一种高亲和力、低容量的转运蛋白,除能够转运二肽和三肽之外,还转运一些类肽类药物[9–10]。广泛分布于哺乳动物体内,主要在肾脏[11]、大脑[12]、肺[13]及乳腺组织中表达[14],在视网膜、心脏、肝脏、脾脏、胰腺、骨骼肌、结肠、生殖道也有分布[15],并在这些组织中发挥重要作用。PepT2作为小肽转运载体,在哺乳动物中的研究比较广泛,但在鱼类中的报道少见。本研究中,采用RT–PCR和cDNA末端快速扩增技术(RACE)克隆草鱼小肽转运载体基因全长cDNA序列,对其进行生物信息学分析,并采用实时荧光定量PCR技术检测分析健康草鱼基因在不同组织中的表达情况,旨在为小肽转运载体基因功能与结构的关系及其在生物体内转运小肽的分子机理研究提供依据。
1 材料与方法
1.1 供试材料
供试草鱼采自湖南农业大学水产养殖基地,平均体质量为(161±5) g,个体健康,发育良好。随机选取草鱼5尾,用MS–222(50 mg/L)麻醉后解剖,取肝脏、脾脏、肾脏、头肾、鳃、皮肤、肌肉、肠道、脑、心脏等,先用DEPC(焦碳酸二乙酯)处理过的灭菌水清洗,再在液氮中速冻,于–80 ℃冰箱保存,备用。
1.2 主要试剂
总RNA提取试剂(Trizol Reagent)购自Invitrogen;cDNA逆转录试剂盒(RevertAidTMFirst Strand cDNA synthesis Kit)购自Fermentas(MBI);SMARTer RACE cDNA Amplification Kit购自Clontech;DNA琼脂糖凝胶回收试剂盒(QIAquick Gel Extraction Kit)购自Qiagen;pMD19–T、DL2000 Maker、 LA®DRR002A、Premix Ex®Version 2.0聚合酶、SYBR Premix ExTM II(Tli RNaseH Plus)均为大连宝生物工程有限公司产品;其他试剂均为国产分析纯。
1.3 草鱼PepT2基因cDNA全长的克隆及测序
根据已知鱼类基因序列的保守区域分别设计简并引物CiPepT2–F和CiPepT2–R(表1),采用PCR扩增出中间部分片段,经测序、同源比对,利用Primer Premier 5.0设计3ˊRACE特异性引物CiPepT2–3ˊ和5′RACE特异性引物CiPepT2–5ˊ(表1)。参照SMARTerTMRACE cDNA Amplification Kit使用说明书,反转录合成5ˊRACE和3ˊRACE所需的cDNA第一链模板,并进行RACE扩增。扩增程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸3 min,35个循环;72 ℃延伸7 min。RACE扩增产物经1.0%琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的片段,再与pMD19–T载体连接,转化至大肠埃希菌DH5α感受态细胞,然后用氨苄青霉素抗性平板筛选阳性克隆并进行菌液PCR鉴定,最后将阳性克隆送北京六合华大基因科技有限公司进行测序。

表1 草鱼PepT2基因的克隆及表达分析所用的引物
1.4 草鱼PepT2基因序列的生物信息学分析
所获序列经NCBI数据库进行Blast同源性比对确定后,对中间片段序列、正向和反向序列进行剪切拼接,获得草鱼基因全长cDNA序列,运用EditSeq进行开放阅读框(ORF)预测和氨基酸序列翻译。运用ExPASy(http://www.expasy.org/)预测蛋白相对分子质量、等电点理化性质;运用SWISS-MODE (https://www.swissmodel.expasy.org/)预测蛋白质三级结构;运用Gene Structure Display Server 2.0 (http://gsds.gao-lab.org/)分析基因组结构;运用SMART(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测和分析蛋白跨膜域;运用SignalP(http://www. cbs.dtu.dk/services/SignalP/)预测编码蛋白信号肽。通过Blast在线工具查找数据库中的同源序列,运用ClastalW2.1对同源序列进行比对,并以MEGA6.0中的邻接法(Neighbor–joining)构建系统进化树。所用物种包括人(,NM_021082),恒河猴(,NM_001032953),家兔(,NP_001076169),小鼠(,AF111811),原鸡(,KF366604),鹦鹉(,KQK83957),非洲爪蟾(,NM_001086929),海龟(,XP_ 007071949),斑马鱼(,NM_001039828),青鳉(,XP_023806227),大黄鱼(,XP_019108521),北极红点鲑(,XP_023862343)。
1.5 共线性分析
通过NCBI数据库,从草鱼基因组数据中获得基因的上、下游基因序列[16],并从Ensembl数据库获得斑马鱼、红鳍东方鲀、大菱鲆、斑点叉尾鮰的上、下游基因,在UCSC、Vega及Ensemble数据库上比对基因信息,进行及其周边基因的共线性关系的分析。
1.6 草鱼PepT2基因的组织表达分析
根据草鱼基因序列(登录号为M25013.1)设计荧光定量PCR内参引物Ciβ–actin–F、Ciβ– actin–R,根据草鱼基因序列的ORF区序列设计荧光定量特异性引物qCiPepT2–F和qCiPepT2–R (表1)。以正常草鱼肝脏、脾脏、肾脏、头肾、鳃、皮肤、肌肉、肠道、脑、心脏等的组织样品的cDNA为模板,检测基因在各个组织的表达情况。参照SYBR Premix ExTM II的说明书,在Light- Cycler480荧光定量PCR仪上分析基因的组织表达情况。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火40 s,40个循环;65 ℃变温5 s。每个样品进行3次生物学重复。采用2–ΔΔCt法结合SPSS17.0对试验数据进行比较分析。
2 结果与分析
2.1 草鱼PepT2基因序列的分析结果
将获得的片段用SeqMan进行拼接,得到2733 bp的全长cDNA序列(GenBank登录号为MK860203.1),经BLAST和同源比对分析,确认为草鱼基因。该序列包含82 bp的5′端非编码区(UTR)、2169 bp的ORF、482 bp的3′UTR(图1)。
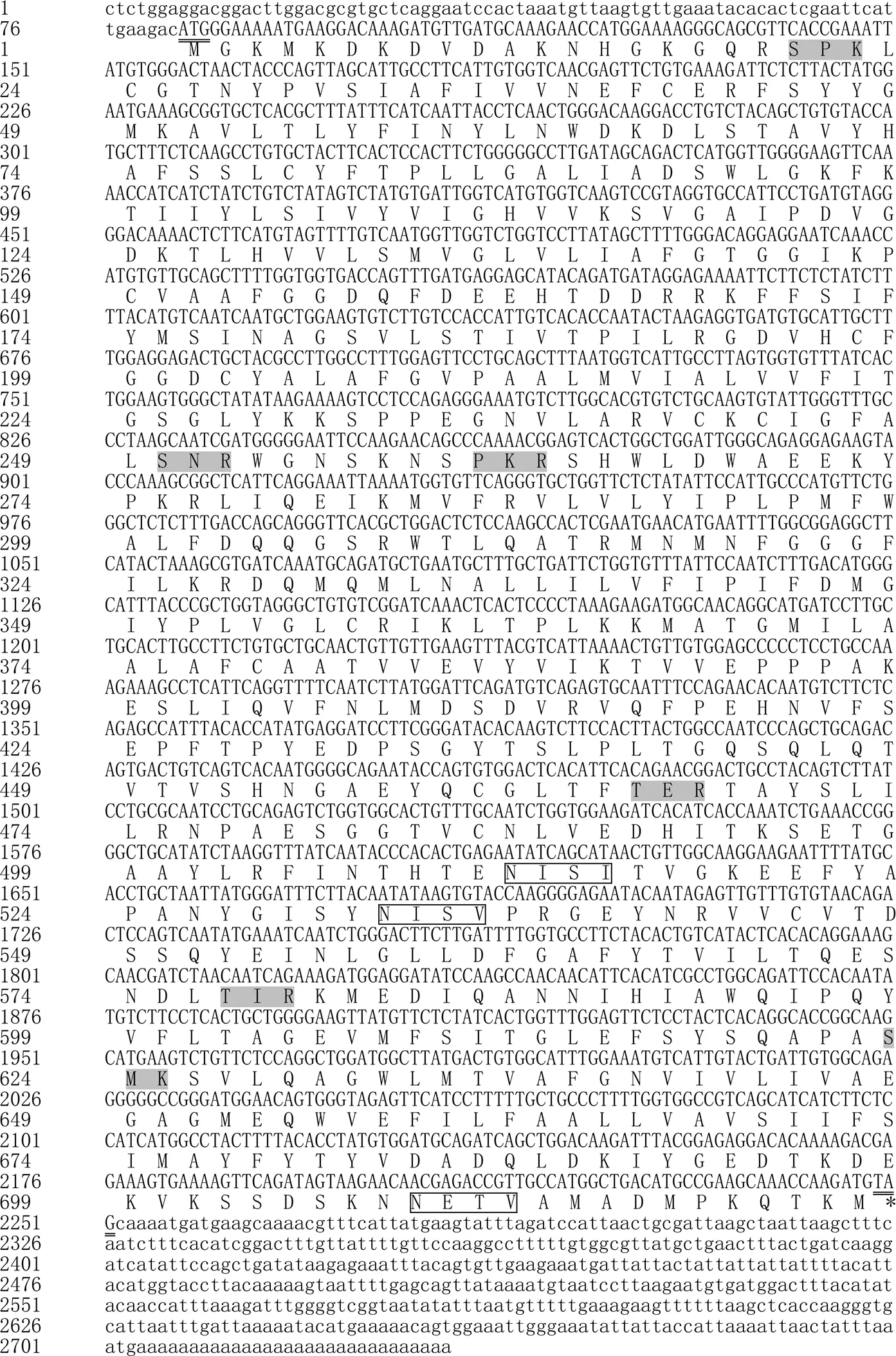
下划线示起始密码子(ATG)和终止密码子(TAG);方框示N–糖基化位点;灰色底纹示蛋白激酶C磷酸化位点。
在3′UTR,有5个RNA不稳定信号ATTTA,但没有典型的polyA加尾信号AATAAA。PepT2的ORF编码722个氨基酸残基,Expasy预测的蛋白相对分子质量约为8.032×104,等电点约为6.01。SignalP分析表明,其不存在信号肽序列;TMHMM分析显示,PepT2蛋白存在12个跨膜区域,且与哺乳动物同源蛋白类似,在跨膜结构9和10之间有1个大细胞外环,跨膜区氨基酸高度保守,含有6个蛋白激酶C磷酸化位点和3个N–糖基化位点(图1)。SMART分析显示,草鱼PepT2蛋白有2个PTR2基序,与斑马鱼相同(图2)。SWISS–MODEL三级结构预测显示,PepT2蛋白有18个α–螺旋和21个β–折叠(图3)。草鱼和斑马鱼基因结构均由外显子和内含子组成,草鱼包含有20个外显子和19个内含子,斑马鱼包含有23个外显子和22个内含子,草鱼与斑马鱼外显子和内含子数量存在差异。
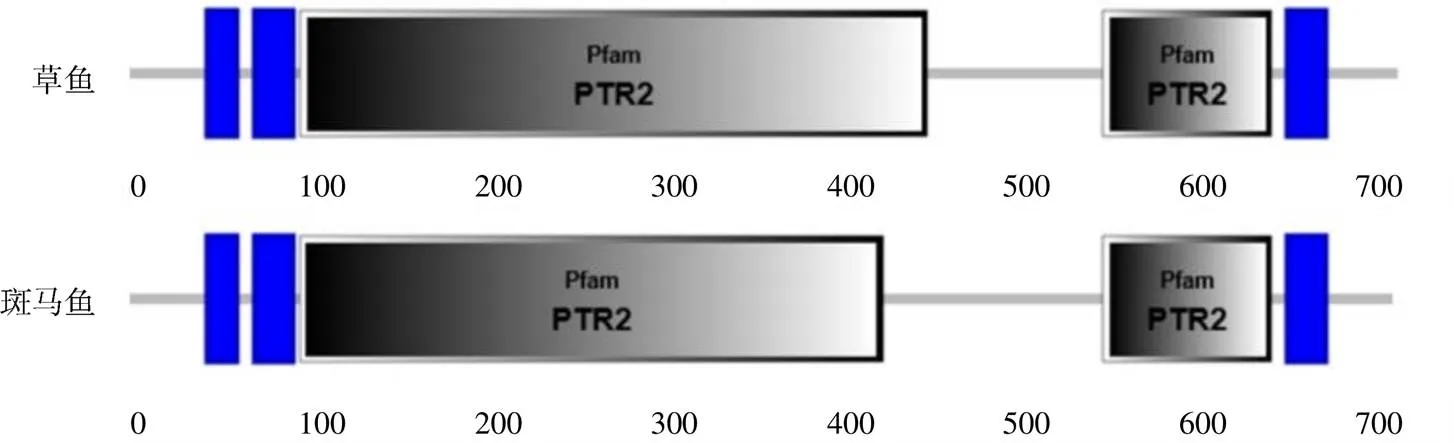
图2 草鱼PepT2蛋白的预测二级结构
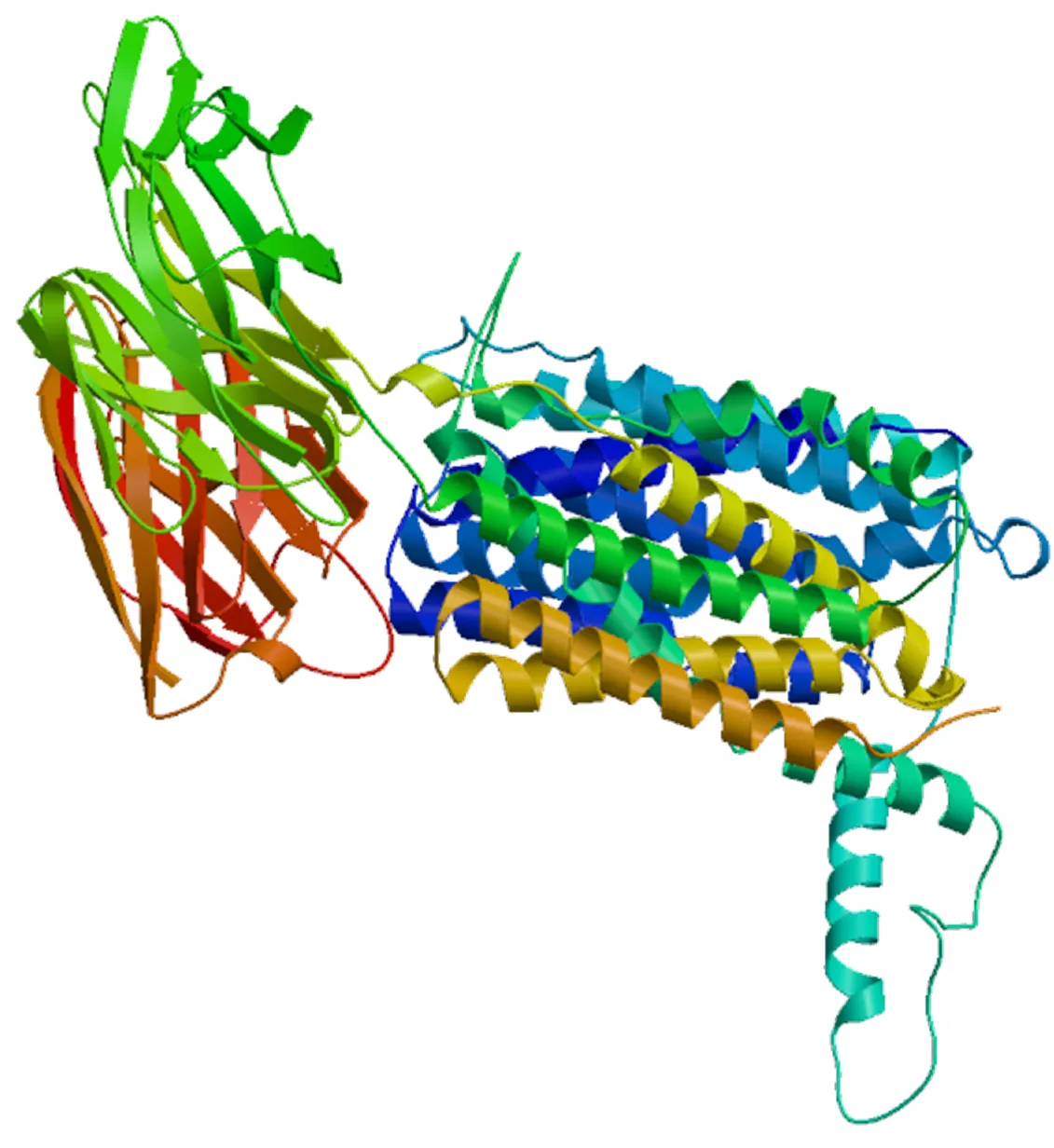
图3 草鱼PepT2蛋白的预测三级结构
2.2 草鱼PepT2氨基酸同源序列比对与进化分析结果
经同源性分析(图4)可知,草鱼PepT2氨基酸序列与斑马鱼、大黄鱼、青鳉的同源性分别为86.65%、68.15%和67.05%;与两栖动物非洲爪蟾和鸟类原鸡的同源性分别为60.27%和59.18%;与哺乳动物小鼠、人类、恒河猴和家兔的同源性分别为52.97%、53.95%、52.83%和53.23%。从图5可知,草鱼PepT2与斑马鱼PepT2亲缘关系最近,与北极红点鲑、大黄鱼、青鳉的亲缘关系较近;进化树中哺乳类、爬行类、鸟类、两栖类、鱼类分支与传统的分类方法所得结果一致。

图4 草鱼与其他脊椎动物的PepT2的氨基酸序列比对分析结果

图5 基于PepT2氨基酸序列构建的系统发育进化树
2.3 PepT2基因共线性分析结果
根据Ensembl数据库获得的nanos2所在区域的基因组序列,绘制了草鱼、斑马鱼、红鳍东方鲀、大菱鲆、斑点叉尾鮰的及其上、下游临近7个基因的共线性图(图6)。从图7可知,草鱼基因定位于第16号染色体上;与斑马鱼相比,草鱼所在的染色体保留着大多数基因,具有保守的基因块。在草鱼基因附近的和基因分别在斑马鱼第9号染色体、红鳍东方鲀第1号染色体、大菱鲆第16号染色体、斑点叉尾鮰第6号染色体上,它们在基因组中的定位呈现高度保守的同线性。斑马鱼缺失了草鱼基因附近的和基因,而和基因在红鳍东方鲀、大菱鲆、斑点叉尾鮰中都缺失,说明不同鱼类在进化过程中存在染色体基因的扩张或丢失现象。
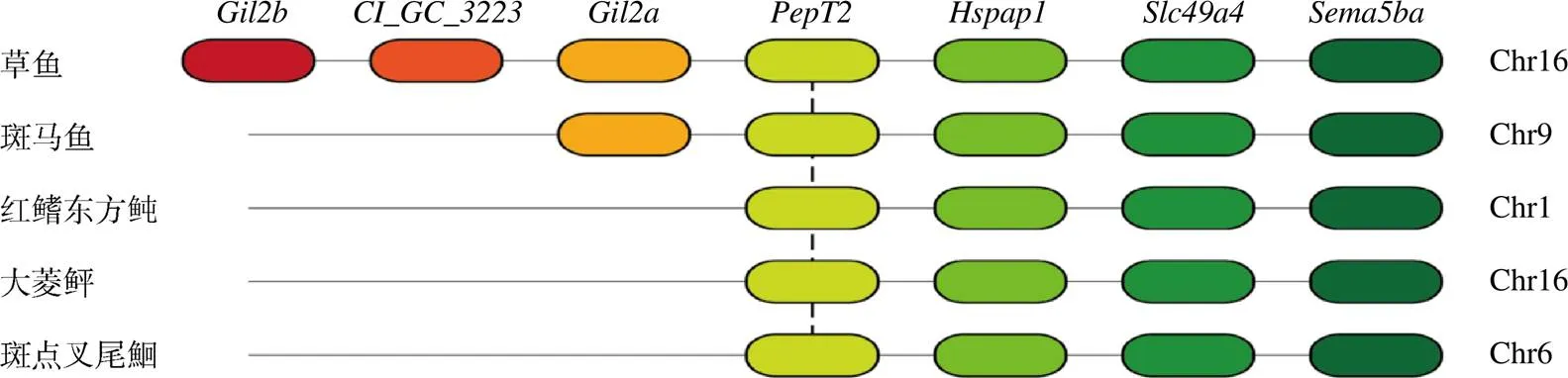
图6 草鱼PepT2基因与其邻近基因保守的共线性关系
2.4 草鱼PepT2基因的组织表达情况
在草鱼被检测的不同组织中均有表达,在肝脏、脾脏、肾脏、头肾、鳃、皮肤、肌肉、肠道、脑、心脏的mRNA相对表达量分别为0.001 176、0.000 436、0.065 178、0.000 190、0.000 468、0.019 108、0.002 598、0.864 026、0.000 686、0.009 064,其中,在肠道中的相对表达量最高,其次是肾脏中的,在肠道和肾脏的组织中的相对表达量显著(<0.05)高于其他组织的,在脾脏、头肾、鳃和脑的组织中表达相对较弱。
3 结论与讨论
本研究中,克隆了草鱼基因全长cDNA序列,并对其氨基酸序列进行了生物信息学分析,结果显示,草鱼PepT2氨基酸序列中含有3个N–糖基化位点、12个跨膜区结构,在跨膜结构9和10之间具有1个大细胞外环,与斑马鱼PepT2氨基酸序列结构类似[4]。在大鼠PepT2中,其转运体也有12个跨膜结构,在第9和10跨膜结构域之间有1个大细胞外环,但大鼠PepT2存在4个N–连接糖基化位点[9]。草鱼PepT2氨基酸序列与斑马鱼、大黄鱼、青鳉的同源性较高;草鱼与鱼类物种聚合相近,这与传统的形态学分类结果一致,说明在不同动物中基因进化相对保守。
草鱼全基因组序列分析结果显示,草鱼全基因含有20个外显子和19个内含子。草鱼基因定位于Chr16号染色体上,基因共线性分析结果显示,在草鱼基因附近的和基因分别在斑马鱼第9号染色体、红鳍东方鲀第1号染色体、大菱鲆第16号染色体、斑点叉尾鮰第6号染色体上,它们在基因组中的定位呈现高度保守的同线性。但在斑马鱼中缺失了草鱼基因附近的和基因,和基因在红鳍东方鲀、大菱鲆、斑点叉尾鮰中都缺失,推测草鱼在进化过程中存在染色体基因的扩张现象。
运用荧光实时定量PCR检测基因在草鱼各组织中的表达情况,结果显示,草鱼基因在各组织中均有表达,但组织之间表达差异明显。在哺乳动物中,主要在肾脏[11]、大脑[12]、肺[13]及乳腺组织表达[14],而草鱼主要在肠道、肾脏中表达,在大脑、脾脏中表达较低。可见,不同物种中基因的表达模式存在较大差异,这可能与物种生存特性有关。在斑马鱼[5]、鲤鱼[17]肠道中表达较高,本研究中在草鱼肠道中的表达情况与其相符。在鱼类肠道中的表达较高,可能与鱼类生活的环境及对营养消化、吸收的特点有关。与哺乳动物相比,水产动物消化道分化简单,消化道较短,消化酶数量较少,肠壁转运氨基酸的载体数量不足,消化吸收功能较弱[18]。水产动物以小肽的形式转运吸收,以弥补消化道分化的不足。在草鱼肠道中表达最高,推测PepT2可能在草鱼肠道中广泛参与了小肽的转移与吸收,后期可进一步阐明PepT2的分子转运机制,对开展小肽营养饲料添加剂或功能活性肽用于水产动物生产具有重要意义。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2020中国渔业统计年鉴[M].北京:中国农业出版社,2020.
[2] 岳华梅,吴金平,陈细华,等.达氏鳇谷氨酸脱氢酶基因的克隆及双低菜粕添加对其表达的影响[J].淡水渔业,2019,49(4):35–41.
[3] PAULSEN I T,SKURRAY R A.The POT family of transport proteins[J].Trends in Biochemical Sciences,1994,19(10):404.
[4] SMITH D E,CLÉMENÇON B,HEDIGER M A. Proton- coupled oligopeptide transporter family SLC15:physio- logical,pharmacological and pathological implications[J]. Molecular Aspects of Medicine,2013,34(2/3):323–336.
[5] FEI Y J,KANAI Y,NUSSBERGER S,et al.Expression cloning of a mammalian proton-coupled oligopeptide transporter[J].Nature,1994,368:563–566.
[6] LIU W,LIANG R,RAMAMOORTHY S,et al. Molecular cloning of PEPT 2,a new member of the H+/peptide cotransporter family,from human kidney[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes,1995,1235(2):461–466.
[7] ROMANO A,KOTTRA G,BARCA A,et al. High- affinity peptide transporter PEPT2(SLC15A2) of the zebrafish:functional properties,genomic organization,and expression analysis[J].Physiological Genomics,2006,24(3):207–217.
[8] LIANG R,FEI Y J,PRASAD P D,et al.Human intestinal H+/peptide cotransporter:cloning,functional expression,and chromosomal localization[J].Journal of Biological Chemistry,1995,270(12):6456–6463.
[9] SAITO H,TERADA T,OKUDA M,et al.Molecular cloning and tissue distribution of rat peptide transporter PEPT2[J].Biochimica et Biophysica Acta(BBA)- Biome- mbranes,1996,1280(2):173–177.
[10] CHEN X M,KEEP R F,LIANG Y,et al.Influence of peptide transporter 2(PEPT2) on the distribution of cefadroxil in mouse brain:a microdialysis study[J]. Biochemical Pharmacology,2017,131:89–97.
[11] SHEN H,SMITH D E,YANG T X,et al.Localization of PEPT1 and PEPT2 proton-coupled oligopeptide transporter mRNA and protein in rat kidney[J].American Journal of Physiology-Renal Physiology,1999,276(5):F658–F665.
[12] SHEN H,SMITH D E,KEEP R F,et al.Immunolocalization of the proton-coupled oligopeptide transporter PEPT2 in developing rat brain[J].Molecular Pharmaceutics,2004,1(4):248–256.
[13] GRONEBERG D A,NICKOLAUS M,SPRINGER J,et al.Localization of the peptide transporter PEPT2 in the lung:implications for pulmonary oligopeptide uptake[J]. The American Journal of Pathology,2001,158(2):707–714.
[14] GRONEBERG D A,DÖRING F,THEIS S,et al.Peptide transport in the mammary gland:expression and distribution of PEPT2 mRNA and protein[J].American Journal of Physiology(Endocrinology and Metabolism),2002,282(5):E1172–E1179.
[15] KAMAL M A,KEEP R F,SMITH D E.Role and relevance of PEPT2 in drug disposition,dynamics,and toxicity[J].Drug Metabolism and Pharmacokinetics,2008,23(4):236–242.
[16] WANG Y P,LU Y,ZHANG Y,et al.The draft genome of the grass carp() provides insights into its evolution and vegetarian adaptation[J]. Nature Genetics,2015,47(6):625–631.
[17] OSTASZEWSKA T,DABROWSKI K,KAMASZEWSKI M,et al.The effect of plant protein-based diet supplemented with dipeptide or free amino acids on digestive tract morphology and PepT1 and PepT2 expressions in common carp(L.)[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Phy- siology,2010,157(2):158–169.
[18] SEKIKAWA S,KAWAI Y,FUJIWARA A,et al. Alterations in hexose,amino acid and peptide transporter expression in intestinal epithelial cells duringinfection in the rat[J]. International Journal for Parasitology,2003,33(12):1419–1426.
Cloning and expression analysis of thegene in
LIU Jinmeng1,2,QIN Beibei1,2,LI Hanghang2,XIAO Tiaoyi1,2,SU Jianming3*
(1.Hunan Province Characteristic Aquatic Resources Utilization Engineering Technology Research Center, Changsha, Hunan 410128, China; 2.College of Animal Science and Technology, Hunan Agricultural University, Changsha, Hunan 410128, China; 3.College of Veterinary Medicine, Hunan Agricultural University, Changsha, Hunan 410128, China)
Type II small peptide transporter(2) gene of thewas cloned using RT-PCR and RACE methods, and analyzed using bioinformatics and collinearity methods. The expression ofgene in different tissues of healthywas detected and analyzed by real-time fluorescence quantitative PCR. The results showed that the full-length cDNA sequence ofhad 2733 bp, including 2169 bp as an open reading frame encoding a 722-amino-acid peptide, 82 bp at 5′UTR and 482 bp at 3′UTR.gene ofcontained 20 exons and 19 introns. The predicted relative molecular mass was 8.032×104and pI at 6.01. The protein had 12 helical transmembrane structures similar to the mammalian homologous proteins, and there was a large outer ring between the transmembrane regions 9 and 10. The transmembrane amino acid region was highly conserved, and contained 6 protein kinase C phosphorylation sites and 3 N-glycosylation sites. The tertiary structure of PepT2 protein was predicted to contain 18 α-helices and 21 β-folds. The amino acid sequence homology analysis results showed that the PepT2 amino acid sequence ofhad the highest homology with(86.65%), and the homology with other species were 52.83%-68.15%. Phylogenetic tree analysis showed thatandwere the most closely related. Compared with, most genes were retained in thechromosome ofwith conserved gene blocks. Real-time fluorescence quantitative expression analysis showed that theexpression level ofwas the highest in the intestinal tract, followed by the kidney.
;small peptide transporter;; clone; bioinformatics analysis; collinearity analysis; tissue expression
S917.4;S965.112;Q786
A
1007-1032(2022)04-0488-08
刘金梦,秦贝贝,黎航航,肖调义,苏建明.草鱼基因的克隆及其表达分析[J].湖南农业大学学报(自然科学版),2022,48(4):488–495.
LIU J M,QIN B B,LI H H,XIAO T Y,SU J M.Cloning and expression analysis of thegene in[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):488–495.
http://xb.hunau.edu.cn

2021–03–01
2022–02–22
国家大宗淡水鱼产业技术体系项目(CARS–45–48)
刘金梦(1995—),女,天津人,硕士研究生,主要从事水产遗传育种与繁殖研究,1559176106@qq.com;*通信作者,苏建明,博士,副教授,主要从事水产动物健康养殖与鱼类遗传育种研究,sjmauhn@hunau.edu.cn
责任编辑:邹慧玲
英文编辑:柳正
