PD-1抑制剂治疗肝细胞癌疗效相关生物标志物的研究现状
2022-09-15刘佳杨道坤王燕平陈宝鑫王新伟综述申娇审校
刘佳 杨道坤 王燕平 陈宝鑫 王新伟 综述 申娇 审校
原发性肝癌包括三种病理组织学类型,其中肝细胞癌(Hpatocellular carcinoma,HCC)占比最大。在中国,HCC是导致癌症死亡的一个重要原因[1]。HCC的治疗方法包括手术、射频消融、经导管动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)、放化疗和分子靶向治疗等,但临床研究证实这些方法效果欠佳。近年,程序性死亡受体1(Programmed cell death-1,PD-1)抑制剂已显示出对晚期肝细胞癌的优越治疗效果[2]。PD-1是T细胞调节器的成员,可以调节免疫系统对自身细胞的反应[3]。在正常情况下,人体T淋巴细胞表达PD-1,正常细胞会表达适量程序性死亡受体-配体1(Programmed cell death-Ligand 1,PD-L1)维持免疫耐受;而HCC患者的肿瘤细胞会表达过量PD-L1,两者结合会导致免疫逃逸。PD-1抑制剂可阻断PD-1和PD-L1间的相互作用,恢复T细胞的活性和个体免疫系统杀伤肿瘤细胞的能力[4](图1)。本文阐述了PD-1抑制剂在HCC治疗中生物标志物的研究进展。
1 肿瘤组织内生物标志物
1.1 PD-L1的表达
国外Feun等[5]研究发现PD-L1阳性组和阴性组在免疫治疗后部分缓解(PR)的数量没有显著差异。然而,Keynote-224研究表明,PD-L1表达率越高,相应患者的客观应答率(Objective response rate,ORR)越高,Checkmate 040等其他研究的结果表明,基线PD-L1表达水平与患者的治疗效益无关[6]。Liu等[7]研究了HCC患者中PD-L1的不同表达模式,结果证实,肿瘤细胞PD-L1的表达与患者的总生存期(Overall survival,OS)和无复发生存期(Recurrence-free survival,RFS)之间呈负相关(P=0.001;P=0.006)。CD68+巨噬细胞上PD-L1的表达与患者的OS呈正相关(P=0.017),这是由于表达PD-L1的巨噬细胞会招募大量CD8+T淋巴细胞,产生更多免疫因子。PD-L1表达的异质性是影响研究结果的重要因素。国外一项研究从存储库中选取HCC样本,结果提示从目标表位多样性、差分检测特异性、抗体亲和力分析,PD-L1的表达存在较大差别[8]。统一PD-L1高表达的临界值以及运用统一抗体进行检测至关重要。因此,目前PD-L1表达的预测意义有待商榷。
1.2 肿瘤突变负荷及微卫星不稳定
肿瘤突变负荷(Tumor mutational burden,TMB)是外源编码区域中碱基的替换和插入/删除突变数量,与肿瘤样本的评估基因有关[9]。高TMB提示更多的免疫新抗原存在[10]。Xu等[11]研究发现,高TMB组比低TMB组的无进展生存期(Progression-free survival,PFS)长(3个月vs.2.1个月,P=0.063),但Huo等[12]研究发现高TMB组患者OS反而较短(P<0.001),且高TMB组的CD8+T淋巴细胞和M0巨噬细胞浸润水平较低。究其原因,可能由于临界值不同或样本量较小所致。微卫星不稳定(Microsatellite instability,MSI)是由于DNA错配修复系统(Mis-match repair,MMR)故障所致[13]。Ang等[14]评估了数百份HCC样本的MSI,发现只有一份样本具有高MSI表达,提示MSI可能不能精准预测HCC免疫治疗的疗效。
1.3 肿瘤浸润免疫细胞
了解肿瘤微环境(Tumor microenvironment,TME)是免疫治疗成功的关键[15]。HCC的TME是一个富集多种免疫细胞的动态系统[16]。HCC中各种肿瘤浸润免疫细胞(Tumor infiltrating immune cells,TIICs)相互作用形成复杂的免疫网络。抑制肿瘤作用:一项研究发现免疫治疗后的HCC患者应答组中CD8+肿瘤浸润淋巴细胞(Tumor infiltrating lymphocyte,TILs)比例较高[17]。CD8+TILs可释放穿孔素、丝氨酸蛋白酶、表达FasL分子等导致肿瘤细胞死亡。一项研究表明[18],耗竭CD8+TILs表达高的患者PFS和OS明显更长(P=0.007;P=0.058),并且发现与耗竭CD8+TILs特征相关的基因具有调节趋化因子表达(CCL5、CXCL9、CXCL13)和激活T细胞和NK细胞的功能。相关研究证实,耗竭TILs虽丧失部分功能,但可通过阻断PD-1/PD-L1通路,实现TILs亚群的增殖[19]。另有一项研究证实了肿瘤组织中CD38+TIICs的免疫组化评分可以预测免疫治疗疗效,高表达组的中位PFS及中位OS均较高(8.21个月vs.1.64个月,P=0.007;19.06个月vs.5.59个月,P=0.030)[20]。这一现象是由于CD38+肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)会诱导IL-6和TNF-α的表达,并导致更多的IFN-γ和细胞因子(CXCL9、CXCL10和CXCL11)的表达[21]。也有研究表明CD4+TILs可上调效应T淋巴细胞(Effector T lymphocytes,TEFFs)并刺激CD8+TILs分泌细胞因子,直接杀伤肿瘤细胞[22]。促肿瘤作用:研究发现[23]FOXP3+TILs/CD4+TILs与DFS(HR=2.50,P=0.009)和OS(HR=4.04,P=0.001)独立相关;对其相关细胞因子和趋化因子基因进行鉴定,结果表明高表达组会促使更多的IL-2、IL-10、IL-35及趋化因子CCL20和CXCL16的产生,招募调节性T细胞(Regulatory cells,Tregs)迁移到肿瘤微环境中,利于肿瘤新生血管的形成[23]。一项荟萃分析显示[24]CD3+TILs的高密度预示较差的OS(HR=1.008;95%CI:1.000~1.015;P=0.037)。另有研究发现HCC组织中CD68+TAMs可诱导Th17的扩增,诱发免疫耐受、分泌TGF-β、IL-6、IL-10等免疫抑制因子导致免疫逃逸[25]。综上,HCC组织中不同表型的TIICs作用各不相同(图2),未来还需详细探索并建立相关免疫评分。
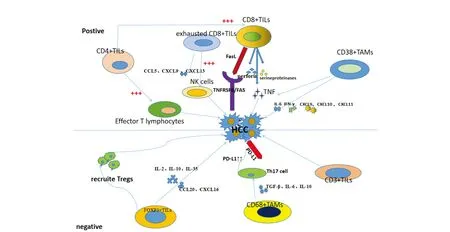
图2 肿瘤浸润免疫细胞在TME中的作用
1.4 外泌体
外泌体是脂质双层包裹的纳米级囊泡[26]。外泌体运输各种生物分子,如蛋白质、信使RNA(mRNA)、微小RNA(miRNA)和长链非编码RNA(lncRNA)[27]。研究发现[28],HCC衍生的外泌体中含有较多的lncRNA TUC339,TUC339可以参与细胞因子受体信号通路和CXCR 趋化因子受体结合通路,刺激巨噬细胞向M2表型极化以促进肿瘤进展。HCC外泌体miR-23a-3p通过STAT3信号通路上调巨噬细胞中PD-L1的表达。HCC来源的其他外泌体还可以通过IL-6-STAT3信号通路抑制树突状细胞的成熟[29]。总之,肿瘤来源的多种类型的外泌体可以通过不同的信号传导通路抑制免疫细胞的增殖,从而介导免疫逃逸。
1.5 特征性基因和通路
1.5.1 m6A修饰相关基因 Khemlina等[30]使用基因组测序的方法,在HCC中发现了一系列基因改变。探讨HCC特征基因改变的研究相继出现。Jiang等[31]研究发现m6A修饰相关基因或许可预测HCC免疫治疗疗效。m6A又叫N6-甲基腺苷,是真核生物中含量最多的修饰型RNA。使用LASSO分析将YTHDF2、YTHDF1、METTL3等m6A相关基因构建风险模型。结果表明,风险评分较低的患者具有更长的OS(HR=3.81,95%CI:1.13~11.08,P=0.03),并且具有较高水平的CD4+TILs及B淋巴细胞;相反风险评分高的患者有较高的M0巨噬细胞及Tregs,导致肿瘤血管生成。结果提示m6A相关修饰基因可能作为生物标志物预测抗PD-1免疫治疗。
1.5.2 CMTM4趋化因子 Chui等[32]发现CMTM4(趋化因子跨膜结构域的家族成员)有望成为标志物之一。研究发现CMTM4在人类HCC中过表达。在构建HCC小鼠模型中,CMTM4低表达的生长速度较慢,它通过网格蛋白依赖性内吞和蛋白酶体途径防止PD-L1降解。通过下调CMTM4可以抑制由IFN-γ驱动的PD-L1表达或其他致癌信号通路,重新激活CD4+、CD8+T淋巴细胞介导的抗肿瘤免疫。
1.5.3 Wnt/β-catenin通路 近来Wnt/β-catenin通路已被确定为免疫逃逸的重要致癌因素。一项研究发现该通路的激活与较低的疾病控制率(Disease control rate,DCR)(0%vs.53%)、较短的中位PFS(2.0个月vs.7.4个月)和较短的中位OS(9.1个月vs.15.2个月)相关。该通路导致树突状细胞和抗原特异性T细胞的缺陷,建立“免疫冷肿瘤”,导致对免疫治疗的耐药,可以作为HCC患者免疫治疗排除的新生物标志物[33]。
2 肿瘤组织外标志物
2.1 外周血标志物
2.1.1 甲胎蛋白(Alpha fetoprotein,AFP)和异常凝血酶原 甲胎蛋白是HCC诊治中常用的生物标志物。国内一项研究证实了早期AFP水平可以作为免疫治疗的标志物,将HCC患者分为早期反应组和无反应组两组(反应组:治疗开始的4周内血清AFP水平较治疗前下降>20%)。结果证实早期AFP反应组的中位OS(28.0个月vs.11.2个月,P=0.048)和中位PFS(15.2个月vs.2.7个月,P=0.002)均较长[34]。异常凝血酶原Ⅱ(Protein induced by vitamin k Absence or Antagonist-II,PIVKA-II)是一种异常的凝血酶原蛋白[35]。有研究发现,血清PIVKA-II水平与患者TNM分期和肿瘤大小呈正相关[36]。研究证实[37],AFP下降>50%和PIVKA-Ⅱ下降>50%分别与更长的OS和PFS相关,两者的综合预测模型评分较低的患者有更长的OS及PFS。
2.1.2 TGF-β 大量研究证实TGF-β在HCC TME中起重要作用[38]。肝窦内皮细胞(Liver sinusoidal endothelial cells,LSECs)和肝星状细胞(Hepatic Stellate Cells,HSCs)产生的TGF-β通过激活SMAD2/3上调Tregs和促炎因子,阻断T细胞抗原受体的信号传导并抑制T细胞增殖和细胞毒性介质的分泌,从而导致T细胞耗竭。有研究显示[5],免疫治疗应答组的TGF-β水平低于无应答组(P=0.003)。另外一项基础实验也论证了TGF-β可以上调T细胞表面PD-1的表达,减弱淋巴细胞杀伤力,但需进一步在人体中验证[39]。
2.1.3 炎症评分 国内一项研究证实了粒细胞淋巴细胞比值(Neutrophil-to-lymphocyte ratio,NLR)和血小板淋巴细胞比值(Platelet-lymphocyte ratio,PLR)较低的患者OS及完全缓解率均较高[40]。还有相关研究指出CAR(CRP与白蛋白比率)、SII(SII=P×N/L)等炎症评分较低的患者具有更长的OS和PFS,同时该研究建立了包括格拉斯哥预后评分(GPS)等在内的炎症评分预测模型,需要进一步探索模型的适用性[41]。有研究表明炎症评分较高提示大量中性粒细胞衍生的IL-18和血管内皮生长因子生成,减弱淋巴细胞杀伤力,增加肿瘤血供,促进肿瘤细胞的存活[42]。
2.2 肠道菌群
Zheng等[43]选取给予帕博利珠单抗治疗的肝细胞癌患者,通过宏基因组测序评估肠道细菌特征的动态变化,结果提示应答组(R组)显示出比无应答组(NR组)更高的分类群丰富度。R组主要富含乳酸杆菌属,可抑制腐败剂的生长,提高宿主免疫能力。NR组中变形杆菌则占据主导地位。另外一项研究表明粪便杆菌属的丰度越高,PFS越高[44]。总之,肠道-微生物种类及丰度的变化可能成为预测HCC免疫治疗的因素,但具体机制及其与免疫环境的关系还需进一步验证。
3 宿主特征
3.1 甲状腺功能减退
Xu等[45]纳入接受免疫治疗的HCC患者,结果证实甲减组的中位PFS(6.27个月)高于非甲减组(5.68个月),且甲状腺功能减退和患者预后相关(P=0.012)。相关研究表明[46],S2域(甲状腺激素结合结构域)可以结合T4和T3,通过磷脂酶C(PLC)和蛋白激酶C(PKCα)激活丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK1/2)通路,从而促进肿瘤细胞增殖。
3.2 营养状况
有研究证实患者的体重指数(BMI)或许可以作为预测因素之一[47]。研究发现BMI>25的患者中位生存期较长(5个月vs.17.5个月,P=0.034)。BMI增加对一些癌症患者有保护作用[48]。与BMI有关的白色脂肪,是一部分趋化因子的来源,会刺激记忆性T淋巴细胞的储存。Mei等[41]研究发现PNI指数(PNI=白蛋白+5×淋巴细胞计数)高的患者生存率较高(24个月总生存率:51.5%vs.25.7%,P<0.001)。PNI指数低提示淋巴细胞减少及白蛋白降低[49],即免疫能力减弱,而营养不良状态会削弱吞噬功能和其他防御机制。
3.3 磁共振HCC结节信号
Aoki等[50]使用钆-乙氧基苄基-二乙烯三胺(Gd-EOB-DTPA)的肝胆期增强磁共振成像(MRI)评估HCC患者对PD-1抑制剂的反应。研究结果证实肝胆期图像上信号较高患者的中位PFS明显较短(2.7个月vs.5.8个月,P=0.007)。Gd-EOB-DTPA是肝细胞通过有机阴离子转运多肽1B3(OATP1B3)摄取MRI的肝脏特异性造影剂。有研究发现具有Wnt/β-catenin改变的HCC患者的OATP1B3表达明显更高。这种高信号的HCC结节可能是一种预测抗PD-1治疗反应不佳的成像生物标志物[51]。
4 其他
一项研究揭示了细胞周期蛋白和HCC患者免疫浸润相关[52]。细胞周期蛋白可以和相关激酶结合调节G2/M期。该研究发现细胞周期蛋白B1(Cyclin B1,CCNB1)、细胞周期蛋白B2(Cyclin B2,CCNB2)、细胞周期蛋白依赖性激酶1(Cyclin-dependentkinase1,CDK1)在HCC组织中高表达,并且可调节多种免疫浸润细胞的表达,将其抑制剂与免疫疗法相结合可能会改善HCC患者的生存时间。赖氨酸特异性脱氧酶可以促进PD-L1的表达,给予该酶的抑制剂后,会增强PD-1抑制剂治疗HCC疗效,诸如此类,还有很多不同层面的标志物都在研究中[53]。
5 小结与展望
以PD-1抑制剂为代表的免疫治疗给晚期不可手术的肝细胞癌患者带来了新希望,但是目前总反应率仍不尽如人意,因此急需探索生物标志物以筛选优势人群。大量查阅国内外相关文献并结合临床应用实际情况,发现很多不同种类的生物标志物都在研究中,但目前尚没有得到国际公认且临床广泛应用的标志物,仍面临取材困难、异质性大和灵敏度差等挑战。但是根据目前的研究热点及发展趋势,肿瘤免疫微环境的特征综合评分及特征基因及通路极有可能会成为未来潜力最大的生物标志物。未来需要建立多种不同层面的综合因素模型,为肝细胞癌的免疫治疗添砖加瓦。
