敲减骨桥蛋白对吉非替尼耐药的非小细胞肺癌PC9细胞凋亡的研究
2022-09-15温晓星刘大海吴学辉王炳平房涛
温晓星 刘大海 吴学辉 王炳平 房涛
肺癌是世界上发病率第二高的肿瘤,其死亡率居所有肿瘤的首位[1]。晚期非小细胞肺癌的治疗仍然是目前肺癌治疗的难点[2]。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是治疗EGFR有义突变的主要靶向药物。但是,大多数患者在接受EGFR-TKI类药物治疗后1年左右会出现药物耐药[3]。EGFR-TKI耐药机制及靶向的研究是目前肺癌耐药主要的研究方向。
骨桥蛋白又被称作分泌型磷酸糖蛋白1(SPP1),在肺癌中异常高表达。有研究发现骨桥蛋白可以促进非小细胞肺癌对顺铂耐药[4]。但骨桥蛋白在吉非替尼耐药中的具体作用存在争议,Wang等[5]发现骨桥蛋白通过磷酸化EGFR,从而增加肺癌对吉非替尼的敏感性。Fu 等[6]发现骨桥蛋白通过活化PI3K/Akt信号通路诱导非小细胞肺癌对吉非替尼耐药。
本研究我们通过检测骨桥蛋白在PC9R细胞中的表达,通过线粒体膜电位实验进一步分析骨桥蛋白与吉非替尼耐药细胞线粒体功能的关系。进一步证明骨桥蛋白在PC9R细胞生长过程的作用。为克服非小细胞肺癌吉非替尼耐药提供新的依据。
1 材料与方法
1.1 实验材料
人非小细胞肺癌PC9细胞株及吉非替尼耐药的PC9R细胞株为复旦大学附属中山医院惠赠。吉非替尼购自Selleckchem公司。灭活胎牛血清、RPMI 1640培养基、TRIzol试剂、线粒体膜电位检测(MitoProbeTMJC-1 assay)试剂盒、EdU试剂盒购自赛默飞世尔科技公司。反转录酶购自TOYOBO公司。CCK-8试剂盒购自日本dojindo公司。SPP1抗体购自Abcam公司。Bax、Survivin、Cleaved caspase-3、Cleaved PARP抗体购自CST公司。流式细胞仪购自美国BD公司。
1.2 细胞培养
PC9和PC9R细胞在含有10%热灭活胎牛血清和100 U/mL青霉素/链霉素的RPMI 1640培养基中培养。通过在培养基中添加1 μM吉非替尼来维持PC9R细胞对吉非替尼耐药性。肿瘤细胞在恒温箱中以37℃、5% CO2的条件下孵育。
1.3 细胞增殖实验
依据CCK-8试剂盒说明书,将敲除骨桥蛋白的PC9R细胞及对照组细胞按照1 000个/孔,接种在96孔板上,并加入培养基200 μL。培养24 h后,每孔加 CCK-8溶液 10 μL,37℃孵育1 h。最后,使用酶标仪测量450 nm处的吸光度值。每组实验均重复三次。
1.4 线粒体膜电位检测实验
使用线粒体膜电位试剂盒检测线粒体膜电位的变化。JC-1是一种荧光探针,用JC-1转染PC9R细胞,JC-1在正常线粒体基质中聚合发出红色荧光。肿瘤细胞凋亡早期,因线粒体功能受损,线粒体膜电位降低,JC-1单体游离于细胞浆内发出绿色荧光。收集敲减骨桥蛋白(shSPP1)的PC9R细胞及对照组(shNEG)细胞,重现悬浮于培养基中,浓度为5×106个/mL。取0.5 mL悬浮液加入0.5 mL JC-1染色工作液,颠倒数次混匀。细胞培养箱中37℃孵育20 min。在孵育期间,按照每1 mL JC-1染色缓冲液(5X)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1X),并放置于冰浴。37℃孵育结束后,600 g 4℃离心3~4 min,沉淀细胞。用JC-1染色缓冲液(1X)洗涤2次:加入1 mL JC-1染色缓冲液(1X)重悬细胞,600 g 4℃离心3~4 min,沉淀细胞,弃上清。再加入1 mL JC-1染色缓冲液(1X)重悬细胞,600 g 4℃离心3~4 min,沉淀细胞,弃上清。再用适量JC-1染色缓冲液(1X)重悬后。实验结果通过流式细胞仪检测。正常的线粒体在590 nm处发出红色荧光,而去极化受损的线粒体在490 nm处发出绿色荧光。
1.5 EdU细胞增殖实验
用10 μM EdU对PC9和PC9R细胞孵育4 h,在室温下用含有3.7%甲醛的PBS固定15 min。根据EdU细胞增殖试剂盒以及我们以前实验方法[7],配置5个反应的Click反应液,每孔加入500 μL反应液,并加用DNA染料Hoechst33342混匀。使用共焦激光扫描显微镜进行共焦成像。通过使用Image J系统计算EdU阳性和Hoechst 33342染色阳性的PC9R细胞数。
1.6 细胞转染
取对数生长期的PC9R细胞,胰酶消化离心后接种在6孔板中,第二天细胞密度约60%~80%时进行病毒感染,包裹腺病毒的骨桥蛋白敲减质粒(shSPP1 组)和对照组质粒(shNEG)购自上海吉凯基因化学技术有限公司,转染操作和病毒使用滴度严格按照说明书进行。
1.7 免疫蛋白印迹法实验(Western blot,WB)
使用蛋白裂解液消化细胞后,提取目标细胞的总蛋白。配制10%聚丙烯酰胺凝胶分离胶,通过湿转法将蛋白转移至NC膜上。SPP1抗体(1∶200)、Bax抗体(1∶200)、Cleaved caspase-3(1∶200) ,Cleaved PARP(1∶200)、β-actin(1∶20 000)孵育NC膜4℃过夜。并使用辣根过氧化物酶标记的二抗(1∶1 000)孵育。暗室中用Super Signal化学发光底物显色并对条带进行分析。实验以β-actin为内参蛋白。
1.8 实时定量PCR(Quantitative RT-PCR qPCR)
应用TRIzol试剂提取总RNA,根据反转录试剂盒明书,利用逆转录酶合成cDNA。将反转录得到的cDNA按1∶50稀释后进行定量PCR实验。20 ng RNA量为反应底物,一共设置40个循环,参数设置如下:95℃,15 s;60℃,15 s;72℃,45 s。根据每个样本的CT值计算2-ΔΔCT,进行比较。β-actin为内参。每组实验均重复三次。引物序列祥见表1。
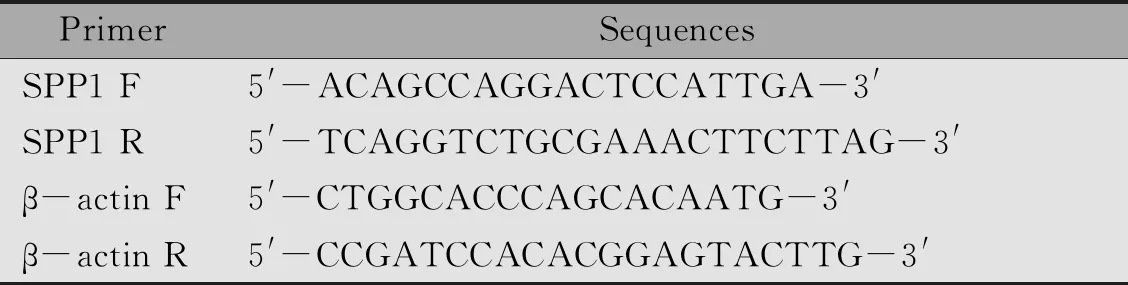
表1 PCR所用引物
1.9 统计分析
使用SPSS 20.0和GraphPad Prism 5.0进行统计分析。计量资料以平均值±标准差表示,使用双因素方差分析(Two—way ANOVA)分析分组与浓度对PC9R细胞增殖的影响,组间比较行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨桥蛋白在吉非替尼耐药细胞中的表达水平
qPCR实验结果显示,在mRNA水平骨桥蛋白在吉非替尼耐药PC9R细胞中表达量较PC9细胞明显增加(P<0.001)(图1A)。通过WB检测骨桥蛋白的表达水平,发现骨桥蛋白在PC9R细胞中的表达量较PC9细胞明显增加(图1B)。
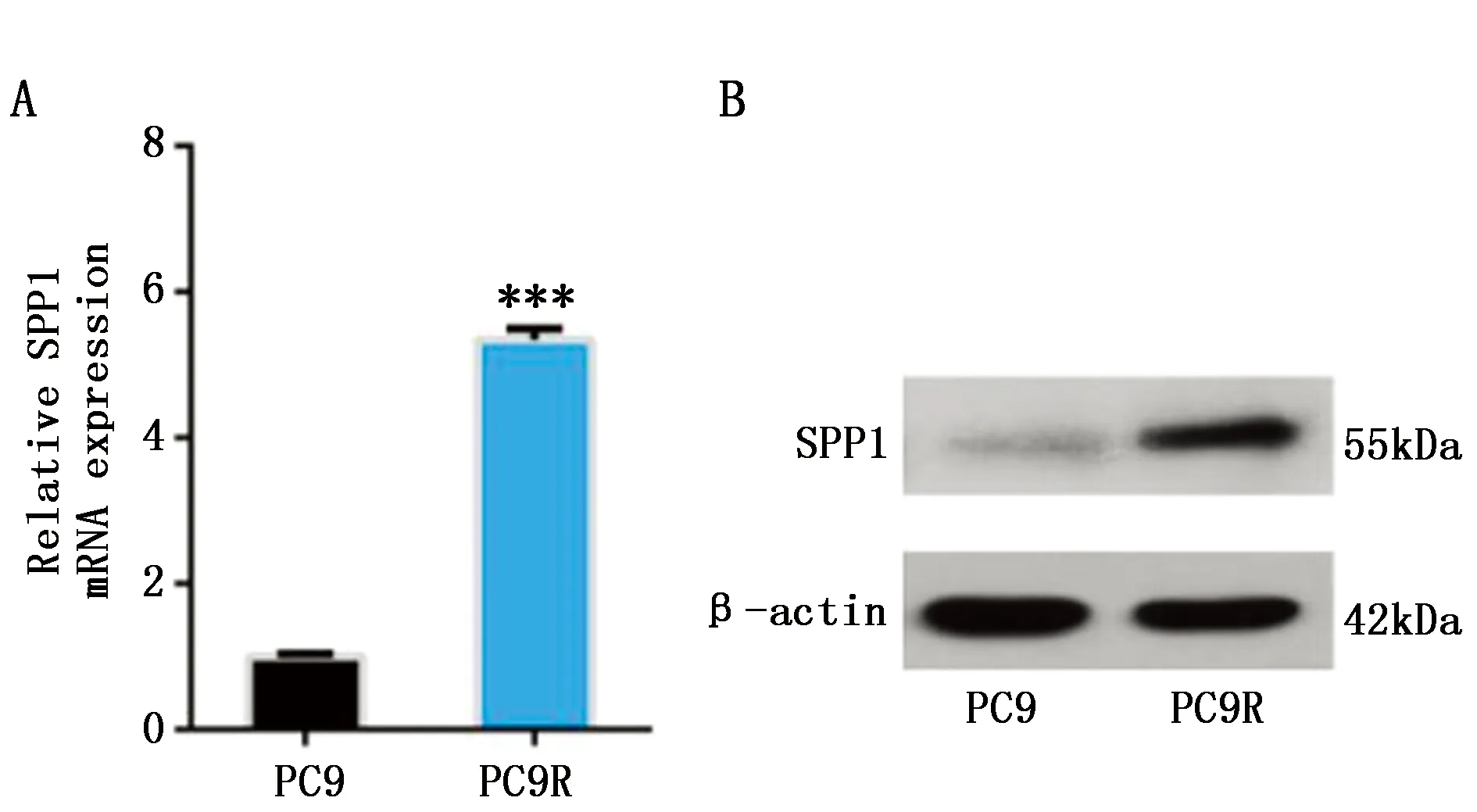
图1 骨桥蛋白在吉非替尼耐药细胞中的表达水平
2.2 敲减骨桥蛋白对PC9R细胞线粒体膜电位的作用
qPCR实验结果显示,与shNEG组相比,shSPP1组骨桥蛋白mRNA表达明显降低(P<0.05)(图2A)。Western blot结果显示,与shNEG组相比,shSPP1组骨桥蛋白的表达水平明显降低(P<0.05)(图2B)。流式细胞仪检测两组细胞的荧光强度,结果发现敲减骨桥蛋白后,shSPP1组发生绿色荧光的细胞比例明显增加,进一步证明敲减骨桥蛋白引起PC9R细胞线粒体功能障碍(P<0.05)(图2C,D)。
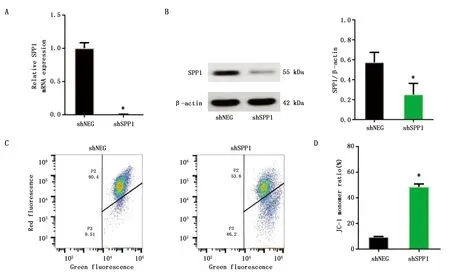
图2 敲减骨桥蛋白对PC9R细胞线粒体膜电位的作用
2.3 敲减骨桥蛋白对凋亡相关蛋白表达水平的作用
线粒体膜功能异常是诱导细胞凋亡的重要作用机制,在PC9R细胞中敲减骨桥蛋白后,本研究发现凋亡促进基因Cleaved caspase-3、Cleaved PARP及Bax升高,进一步证明敲减骨桥蛋白改变线粒体膜电位从而导致细胞凋亡(图3)。
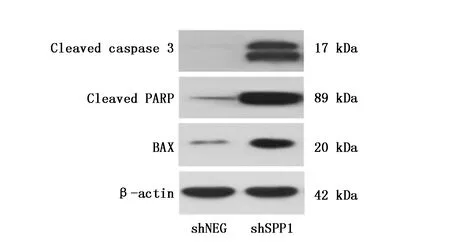
图3 减骨桥蛋白对凋亡相关蛋白表达水平的作用
2.4 敲减骨桥蛋白对PC9R细胞增殖的抑制作用
敲减骨桥蛋白促进吉非替尼耐药细胞发生凋亡,为进一步验证骨桥蛋白对吉非替尼耐药细胞增殖功能作用,通过CCK-8实验,本研究发现敲减骨桥蛋白抑制吉非替尼耐药细胞的增殖(P<0.05)(图4A)。为进一步证实骨桥蛋白在吉非替尼耐药过程中的作用,通过EdU增殖实验发现敲减骨桥蛋白后,吉非替尼耐药细胞的增殖活性被明显抑制(P<0.05)(图4B,C),进一步证明敲减骨桥蛋白促进吉非替尼的抗肿瘤作用。
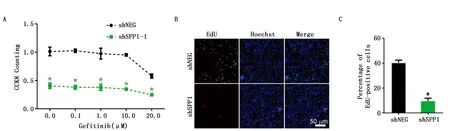
图4 敲减骨桥蛋白对PC9R细胞增殖的抑制作用
3 讨论
随着分子生物学的发展,晚期非小细胞肺癌的治疗方法已经从传统的化学药物治疗转向分子靶向药物和免疫检查点抑制剂。吉非替尼等酪氨酸激酶抑制剂通过阻断EGFR信号通路抑制肿瘤生长[8]。以吉非替尼和奥西替尼等为代表的小分子酪氨酸激酶抑制剂已经成为EGFR有义突变的晚期非小细胞肺癌的一线治疗选择。然而EGFR-TKI类药物一线治疗非小细胞肺癌的有效率在70%~80%。仍有一部分EGFR突变的患者不能从小分子酪氨酸激酶抑制剂中获益[9]。并且对于大部分患者而言,常规口服吉非替尼等第一代酪氨酸激酶抑制剂1年左右时间后会发生疾病进展及药物耐药[10]。EGFR-TKI类药物的耐药是目前肺癌治疗亟需解决的问题。
目前研究发现,多种机制均参与调节EGFR-TKI类药物耐药。其中EGFR第20外显子T790M突变是吉非替尼获得性耐药最主要的机制之一[8]。其他的耐药机制包括c-met[11]、肝细胞生长因子(HGF)扩增[12]以及上皮间质转化(EMT)[13]等。目前仍然有大约25%的EGFR-TKIs耐药机制是不明确的[10]。
骨桥蛋白是一种分泌型磷酸糖蛋白,在肺癌、乳腺癌和肝癌等多种肿瘤中起到重要作用[14]。Donati等[15]研究发现骨桥蛋白在肺癌组织中表达明显升高,骨桥蛋白的高表达与肺癌复发相关。骨桥蛋白的高表达促进肺癌细胞的增殖、转移和侵袭等[16]。在化疗药物耐药机制研究中,骨桥蛋白通过AKT信号通路增加了对顺铂的耐药性[5]。然而在EGFR-TKIs耐药机制的研究中,却存在明显的争议。Wang等[17]报道在肺癌中骨桥蛋白促进阿法替尼的获得性耐药。2020年Fu[6]在《J Hematol Oncol》发表的文章中提到,作者通过CCK-8实验证明敲减骨桥蛋白抑制吉非替尼耐药细胞的增殖,并激活了integrin αVβ3/ FAK信号通路,从而增加了肺癌细胞对吉非替尼及奥希替尼的耐药性。然而2021年Wang等[5]却发现在肺癌细胞中加入分泌性的骨桥蛋白,能增加吉非替尼对肺癌细胞的杀伤作用,进一步分析发现骨桥蛋白通过促进EGFR的磷酸化,增加肺癌细胞对吉非替尼的敏感性。临近的两项研究得到截然相反的实验结果,其中可能与不同细胞系及肿瘤微环境影响骨桥蛋白的功能有关。同样说明骨桥蛋白在EGFR-TKIs耐药作用机制的复杂性。
凋亡是酪氨酸激酶抑制剂抗肿瘤过程中的重要机制之一[18]。为了进一步明确骨桥蛋白在吉非替尼耐药中的作用,我们进行了线粒体膜电位实验。线粒体功能受损是细胞凋亡早期的主要表现,我们发现敲减骨桥蛋白后,吉非替尼耐药细胞的线粒体膜电位出现异常,导致线粒体功能发生障碍,最终引起凋亡相关蛋白的表达,促进肿瘤细胞凋亡发生。Bax是细胞凋亡过程中的重要分子,凋亡发生的过程中,细胞浆中的Bax可插入线粒体外膜上,从而改变线粒体膜功能,增加线粒体膜钙离子的渗透性。敲减骨桥蛋白的PC9R细胞中Bax表达量异常增加,进一步证明敲减骨桥蛋白改变线粒体膜电位从而导致细胞凋亡。
为了进一步验证骨桥蛋白对耐药细胞的增殖作用,我们常规进行CCK-8实验,得到与之前实验同样的结果[6]。同时我们还进行了EdU细胞增殖实验,通过共聚焦显微镜,我们直观的发现敲减骨桥蛋白后,吉非替尼耐药细胞的增殖活性被明显抑制。通过不同的实验方法,我们进一步证明敲减骨桥蛋白明显抑制吉非替尼耐药细胞的增殖。
综上所述,本研究发现骨桥蛋白在吉非替尼耐药的PC9R细胞中异常高表达,证实敲减骨桥蛋白导致PC9R细胞线粒体膜电位受损,并促进凋亡相关蛋白的表达。通过CCK-8和EdU细胞增殖实验再次验证敲减骨桥蛋白抑制吉非替尼耐药细胞的增殖。敲减骨桥蛋白促进细胞凋亡。
