棉花黄萎病抗性相关基因GhTIFY9的克隆与功能分析
2022-09-14李秀青胡子曜雷建峰代培红刘超邓嘉辉刘敏孙玲刘晓东李月
李秀青 胡子曜 雷建峰代培红 刘超 邓嘉辉 刘敏 孙玲 刘晓东李月
(1. 新疆农业大学农学院,乌鲁木齐 830052;2. 新疆农业大学生命科学学院,乌鲁木齐 830052)
棉花是一种在世界范围内普遍种植的经济作物,同时也是天然纤维和油料的主要来源[1]。黄萎病是一种主要由大丽轮枝菌(Verticillium dahliaeKleb)引起的土传维管束真菌病害;大丽轮枝菌寄主范围广泛,可以侵染包括棉花在内的200多个双子叶植物品种;此外它还可以在棉花的整个生命周期内发生,造成棉花产量的大幅损失,严重影响其纤维品质[2]。由于目前还没有针对性的杀菌剂及其他有效的防御措施,因此,选育抗病品种是控制该病原菌危害的最有效途径,而发掘棉花抗病相关基因是棉花抗病育种的关键和基础[3]。
转录因子(transcription factors,TF)在植物抗逆中发挥着不可或缺的作用,已逐渐成为植物抗逆育种的关键。TIFY家族是一类包含TIFY结构域的转录因子,只存在于植物中,在植物的生长发育和抗逆反应中发挥着重要的调控作用[4]。根据保守结构域组成的不同,TIFY家族可分为TIFY、JAZ、ZML和PPD四个亚家族,均包含一个高度保守的TIFY结构域。然而,JAZ亚家族蛋白在C端还存在一个保守的Jas结构域;ZML亚家族蛋白还含有一个GATA锌指结构域和一个CCT基序;PPD亚家族蛋白则还存在一个N端PPD结构域和一个PY基序缺失的Jas结构域;TIFY亚家族则只含有一个TIFY结构域[5]。最早由Nishii等[6]在拟南芥中鉴定出了一个TIFY家族基因ZIM,此后TIFY家族基因陆续在水稻、玉米、小麦、丹参、柳枝稷、毛竹、番茄、大豆、香蕉、苹果、沙梨、西瓜、葡萄、牵牛花及雷蒙德氏棉等多种植物中鉴定出来[7],对TIFY家族基因的功能分析也逐渐成为研究热点。JAZ亚家族基因作为茉莉酸(JA)信号通路的负调控因子和激素网络的调控枢纽,近年来对其功能的研究报道较多,且主要集中在调控植物抗逆反应。Meng等[8]研究发现,拟南芥JAZ7基因参与了植物的光合作用、氧化还原反应、氨基酸、植物激素和防御代谢物的调控,进而正向调节拟南芥的耐旱性。Ebel等[9]研究发现,小麦JAZ亚家族基因TdTIFY11a响应盐胁迫诱导,过表达该基因后显著降低了转基因植株对干旱的敏感性。Zhu等[10]通过敲除2个JAZ亚家族基因AtTIFY10a和AtTIFY10b后显著增强了植株对碱胁迫的敏感性,而过表达苜蓿JAZ亚家族基因GsTIFY10a后显著增强了转基因植株的耐碱性,推测TIFY10蛋白在植物对碱胁迫的响应中起正向调控的作用。Zhao等[11]过表达大豆GsJAZ2后,显著降低了转基因植株对碱胁迫的敏感性。Seo等[12]研究发现OsJAZ1通过调控JA信号通路继而参与水稻的抗旱反应。Yang等[13]利用RT-qPCR分析了西瓜TIFY基因在不同胁迫下的表达模式,发现部分TIFY基因对不同胁迫均有所响应,其中ClJAZ1和ClJAZ7最为显著。Zhang等[14]研究发现,玉米ZmJAZ响应茎腐病和炭疽病等真菌病害的诱导。Yu等[15]在拟南芥中过表达葡萄VvTIFY9后显著增强了转基因植株的白粉病抗性,且相关抗病基因的表达量显著上调。刘嘉鹏等[16]利用RT-qPCR分析了香蕉JAZ亚家族基因MaTIFY9在不同胁迫诱导下的表达模式,发现该基因响应低温、高温、脱落酸(ABA)、水杨酸(SA)及枯萎病菌的诱导。
目前,对于TIFY、ZML和PPD亚家族基因功能的研究鲜见报道,对于TIFY亚家族基因参与棉花抗黄萎病反应的相关研究更是未见报道。
本研究通过前期转录组数据筛选得到一个响应黄萎病菌诱导表达的TIFY亚家族基因GhTIFY9,利用病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术对该基因在棉花抗黄萎病中的功能进行了初步探究,为进一步研究该基因的抗病分子机制奠定基础。
1 材料与方法
1.1 材料
供试材料为陆地棉遗传标准系TM-1,种子由新疆农业大学农学院农业生物技术重点实验室繁存;农杆菌菌株GV3101为新疆农业大学农学院农业生物技术重点实验室保存;TRV病毒载体、阳性对照TRV:GhCLA1载体和大丽轮枝菌菌株V991(Verticillium dahliaKleb)均由新疆农业科学院黄全生研究员惠赠。EcoR I和KpnI等限制性内切酶均购于赛默飞(Thermo)世尔科技有限公司,FastPfu Fly DNA聚合酶、Trans-T1大肠杆菌感受态细胞、pEASY Blunt-Zero克隆载体、T4 DNA Ligase和DNA分子量Marker均购于北京全式金生物技术有限公司;琼脂糖凝胶回收试剂盒和RNase A购于南京诺维赞生物科技有限公司,植物总RNA提取试剂盒购于杭州博日生物科技有限公司;荧光定量试剂盒和反转录试剂盒购于加拿大ABM生物科技有限公司;试验所用卡那霉素、庆大霉素、MES、乙酰丁香酮、MgCl2及培养基配制等化学试剂均为国产分析纯;PCR所用引物的合成和DNA测序均由上海杰李生物技术有限公司完成。
1.2 方法
1.2.1 棉花的培育及种植 选取经硫酸脱绒后大小一致且颗粒饱满的种子,参照胡子曜等[17]方法进行培育及种植。
1.2.2 黄萎病菌的培养及诱导处理 参照Li等[18]方法将-80℃保存的大丽轮枝菌V991取出进行活化培养及接菌处理,对照组(MOCK)用Czapek’s培养基处理,分别在0、6、12、24、48和72 h取棉株根部组织;每个时间点均取3-4个生物学重复,取样后立即置于液氮中速冻,后转移至-80℃冰箱保存,用于后续试验。
1.2.3 棉花总RNA的提取及cDNA的合成 参照植物总RNA提取试剂盒的说明书进行棉花根部样品总RNA的提取,经1.2%的琼脂糖凝胶电泳检测其完整性后,用反转录试剂盒合成cDNA。
1.2.4 棉花GhTIFY9的克隆及序列分析 通过转录组数据分析获得GhTIFY9序列并在NCBI(https://www.ncbi.nlm.nih.gov/)数据库中进行检索,获得其登录号:XM_016837092。根据该基因的ORF(open reading frame)序列设计引物GhTIFY9-F:5'-ATGTCGAGAGCTAGCGTCGA-3'和GhTIFY9-R:5'-CTAGCAAGCATATGGAGATGC-3',参照胡子曜等[17]方法,以陆地棉TM-1的cDNA为模板,使用FastPfu Fly DNA聚合酶(北京,全式金)进行PCR扩增,扩增产物经1%的琼脂糖凝胶电泳检测后,回收目的条带,并连接pEASY Blunt-Zero克隆载体,转化大肠杆菌Trans-T1感受态细胞,挑取阳性单克隆质粒进行测序。
使 用(http://web.expasy.org/protparam/)在 线程序计算GhTIFY9编码蛋白质的理化参数;使用SignalP(http://www.cbs.dtu.dk/services/SignalP)在线程序对该蛋白质进行信号肽预测分析;使用在线软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测其跨膜结构域;使用ProtComp-Version9.0(http://linux1.softberry.com/)在线软件对该蛋白质的亚细胞定位进行分析;使用在线网站SMART(http://smart.embl-heidelberg.de/)对其蛋白结构域进行预测。
1.2.5 黄萎病菌诱导下GhTIFY9的表达模式分析 以反转录cDNA为模板,以棉花管家基因GhUBQ7[19]为内参基因,参照荧光定量试剂盒说明书(加拿大,ABM)进行RT-qPCR反应,每个样本进行3个技术重复。内参基因GhUBQ7的引物序列为q-GhUBQ7-F:5'-GAAGGCATTCCACCTGACCAAC-3',q-GhUBQ7-R:5'-CTTGACCTTCTTCTTCTTGTGCTTG-3';GhTIFY9的荧光定量引物序列为q-GhTIFY9-F:5'-CCGTTTTTAATGTACCTCGAG-3',q-GhTIFY9-R:5'-TGTCGATCGCTAGGAGGAC-3'。反应结束后,根据目的基因和内参基因Ct值,使用2-ΔΔCt方法[20]计算目的基因的表达量。
1.2.6GhTIFY9的VIGS载体构建 根据GhTIFY9的ORF(594 bp)序列,利用SGN-VIGS在线软件设计抑制目的基因表达的靶序列(550 bp),手动设计特异性扩增引物并在其上、下游5'端分别加入EcoR I和KpnI的 酶 切 位 点(CM-GhTIFY9-F:5'-GAATTCCGTCGAGCTTGATTTCTTTG-3',CM-GhTIFY9-R:5'-GGTACCCCTCTCTTTGCGCTTTTCC-3'),以cDNA为模板进行目标片段的PCR扩增,回收、检验、测序方法同1.2.4。将测序结果与目标序列完全匹配的质粒和VIGS载体TRV2用EcoR I和KpnI进行双酶切并回收目的片段,用T4 DNA Ligase连接3-4 h后转化大肠杆菌Trans-T1感受态细胞,用EcoR I和KpnI进行双酶切鉴定,正确的质粒取10-15 μL使用冻融法转化农杆菌GV3101感受态细胞,28℃倒置培养1-2 d,用于后续试验。
1.2.7 农杆菌介导的VIGS侵染棉花及沉默效率检测 将重组载体TRV:RNA1、TRV:RNA2、TRV:GhCLA1和TRV:GhTIFY9转化农杆菌后,待棉苗生长至两片子叶完全展开且真叶未露出时,选取生长较为一致的棉花幼苗,参照Li等[18]方法,进行菌体的活化、重悬及VIGS侵染棉花。将包含TRV:GhTIFY9和TRV:RNA1、TRV:GhCLA1和TRV:RNA1、TRV:RNA2和TRV:RNA1的 重 悬 菌 液所侵染的棉花植株分别作为试验组及阳性、阴性对照。侵染大约3周后,当阳性对照植株的叶片出现明显的白化表型时,对试验组和阴性、阳性对照的第二片真叶及根部进行取样,每个样本3-4个技术重复。将所取样本进行RNA提取及cDNA合成,利用RT-qPCR技术进行沉默效率检测。阳性对照GhCLA1的荧光定量引物为q-GhCLA1-F:5'-GCCCTTTGTGCATCTTC-3';q-GhCLA1-R:5'-CTCTAGGGGCATTGAAG-3'。
1.2.8 棉苗的接种处理 参照Li等[18]方法,选取生长状况一致的GhTIFY9沉默植株和阴性对照植株进行黄萎病菌的接种处理。
1.2.9GhTIFY9的黄萎病抗性鉴定 在接种黄萎病菌15 d后拍照记录GhTIFY9沉默植株和阴性对照植株的表型差异,并采用叶片分级法统计病情指数[18],同时对GhTIFY9沉默植株和阴性对照植株进行剖秆检测及茎段恢复培养试验[21]。
2 结果
2.1 GhTIFY9的克隆与序列分析
以陆地棉TM-1的叶片cDNA为模板进行PCR扩增(图1),大小符合预期,表明GhTIFY9基因的ORF序列克隆成功。利用在线软件对GhTIFY9进行生物学分析(表1),GhTIFY9的ORF为594 bp,编码197个氨基酸,相对分子质量为21.65 kD,脂肪系数为76.63,理论等电点为9.08,平均疏水性为负值,表明该蛋白为碱性、亲水性蛋白;信号肽预测结果显示GhTIFY9蛋白无信号肽;亚细胞定位预测结果显示其定位于细胞核,符合转录因子的特征;跨膜结构域预测结果显示该蛋白为非跨膜蛋白;蛋白结构域预测显示,该蛋白只含有一个TIFY结构域(图2),属于TIFY亚家族。

图2 GhTIFY9蛋白结构域预测Fig.2 Protein domain prediction of GhTIFY9

表1 GhTIFY9的生物信息学分析Table 1 Bioinformatics analysis of GhTIFY9

图1 GhTIFY9的克隆Fig. 1 Cloning of GhTIFY9 gene
2.2 黄萎病菌诱导下GhTIFY9的表达模式分析
黄萎病菌诱导处理后(图3),与对照组相比,GhTIFY9表达量在12和72 h显著上调,在24和48 h显著下调,6 h无明显变化。表明GhTIFY9响应黄萎病菌诱导处理,可能在棉花抗黄萎病反应中发挥一定的作用。
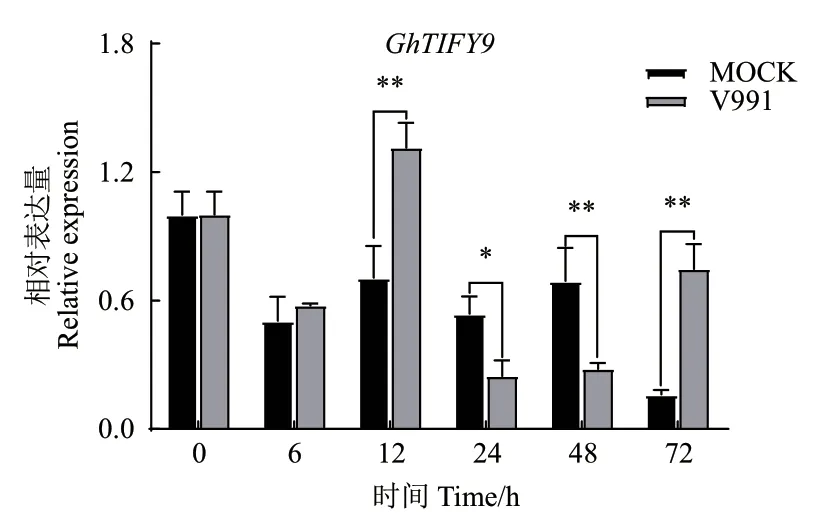
图3 黄萎病诱导下GhTIFY9的表达模式分析Fig.3 Analysis of the expression patterns of GhTIFY9 under the treatment of Verticillium dahliae
2.3 GhTIFY9的VIGS载体构建
利用PCR方法扩增抑制GhTIFY9表达的靶序列(CM-GhTIFY9),电泳检测产物大小符合预期(图4-A)。将产物进行回收、克隆并测序,所得结果与目标序列完全匹配。阳性质粒经EcoR I和KpnI酶切后与VIGS载体TRV2连接、转化,并用上述2个酶进行双酶切鉴定(图4-B),结果呈2条带(TRV:GhTIFY9),一条大于8 000 bp的载体条带和大小为500-750 bp的目标条带,表明GhTIFY9的VIGS载体构建成功。
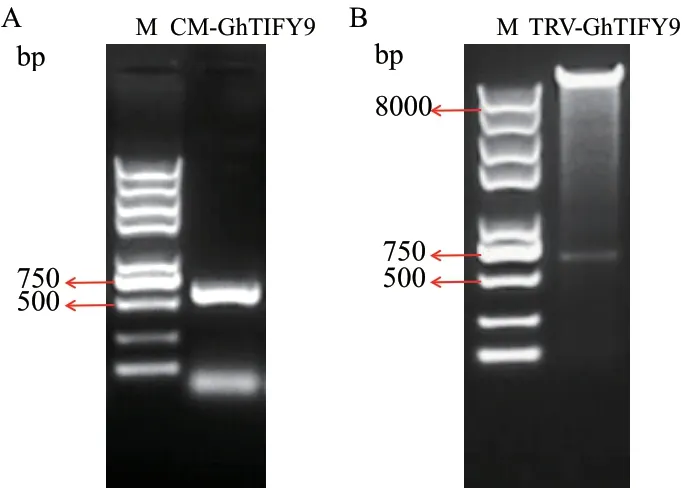
图4 GhTIFY9的VIGS载体构建Fig. 4 VIGS vector construction of GhTIFY9
2.4 GhTIFY9的沉默效率检测
将TRV:GhTIFY9、TRV:GhCLA1和TRV:RNA2分别与TRV:RNA1混合,分别侵染棉花子叶。大约3周后进行表型观察,与阴性对照TRV:00相比,阳性对照TRV:GhCLA1的叶片出现明显的白化现象(图5-A);利用RT-qPCR技术检测阳性对照GhCLA1和目的基因GhTIFY9在根部和真叶中的表达量,结果(图5-B,C)显示,与阴性对照相比,目的基因的表达量均显著性下调表明VIGS沉默载体能够在植株体内正常工作,成功获得GhTIFY9的沉默植株。

图5 GhTIFY9的沉默效率检测Fig. 5 Silencing efficiency detection of GhTIFY9 gene
2.5 GhTIFY9沉默植株的黄萎病抗性鉴定
选取生长状况一致的GhTIFY9沉默植株和TRV:00阴性对照植株进行黄萎病菌侵染处理,15 d后拍照记录其表型差异并进行病情指数的统计及剖秆检测和茎段恢复培养试验。结果(图6-A)显示,GhTIFY9沉默棉株的叶片黄化和植株萎蔫程度高于阴性对照植株,与阴性对照植株相比其整体健康状况更差;病情指数统计结果(图6-B)显示,GhTIFY9沉默植株病情指数显著高于阴性对照植株;剖秆检测结果(图6-C)显示,与阴性对照植株相比,GhTIFY9沉默植株茎秆的褐变程度更加严重;茎段恢复培养结果(图6-D)显示,与阴性对照植株相比,GhTIFY9沉默植株的茎段在培养基上长出的真菌菌丝数量更多。以上结果表明,GhTIFY9是棉花抗黄萎病反应的一个正调控因子,干涉GhTIFY9表达后显著增强了棉花对黄萎病菌的敏感性。

图6 GhTIFY9沉默植株的抗病性鉴定Fig. 6 Disease resistance identification of GhTIFY9 genesilenced plants
3 讨论
我国作为棉花种植大国,超过40%的棉花正遭受着黄萎病菌的严重威胁,黄萎病菌通过根部侵染棉花,随后蔓延至根皮层并侵入木质部导管,形成菌丝和分生孢子造成维管组织的功能损伤,导致棉花出现叶片萎蔫、变色、脱落甚至死亡,最终导致棉花产量大幅下降继而造成严重的经济损失[22]。为保护自身免受病原体的攻击,植物已进化出一系列的防御机制,包括复杂的信号感知、转导和交换;植物抗病反应是由一系列复杂的信号分子调控的信号转导网络,转录因子作为一种多功能蛋白,可以同时参与包括对胁迫信号的感知和相应基因的表达在内的多种信号途径的调控,在信号转导网络中发挥着重要作用[23]。近年来,许多研究显示,转录因子参与棉花抗黄萎病反应的相关调控,其调控方式及参与的调控机制也各不相同。Yu等[24]过表达棉花GhWRKY15后显著增强了转基因烟草的黄萎病抗性,推测该基因正向调控棉花抗黄萎病反应。Ma等[25]利用VIGS技术干涉BEL1-Like转录因子GhBLH7-D06表达后显著降低了沉默植株对黄萎病菌的敏感性,同时沉默植株中木质素合成和JA信号通路基因表达显著上调,表明该基因可能通过抑制木质素的生物合成和JA信号传导途径从而负调控棉花对黄萎病的抗性。Hu等[26]研究发现,GhWAKY1通过正向调控木质素的生物合成继而增强了棉花对于黄萎病的抗性。而相反的是,Xiao等[27]研究发现GhMYB4下调木质素的生物合成却正向调控棉花的黄萎病抗性,推测该基因还参与了别的抗病相关通路的调控,最终表现出的抗性是多种抗病途径效果总和抵消后的结果。He等[28]过表达HD-ZIP转录因子GhHB12后抑制了JA响应基因GhJAZ2和GhPR3的表达,增强了棉花对大丽轮枝菌的敏感性。此外还有一些转录调控基因如GhMYB36[29]、GhWRKY70D13[30]、GhATAF1[31]、GhMYB108[32]、GbVIP1[33]、GbERF1[34]、GhWIN2[35]等通过调控不同的信号通路,参与了棉花对黄萎病的抗性反应。
TIFY家族是植物特有的一类转录因子,在植物的生长发育及抗逆反应中发挥着重要的调控作用。目前对于该家族基因在棉花抗病反应中的研究主要集中在JAZ亚家族基因,例如He等[36]研究发现,GhJAZ2通过负调控JA信号通路并抑制GhbHLH171的转录活性,在棉花抗病反应中扮演一个负调控因子。张祥瑞[37]利用VIGS技术结合过表达转基因技术研究发现,GhJAZ4同样参与JA信号通路的调控,继而在棉花抗黄萎病反应中作为一个负调节因子。此外Song等[38]研究发现,BIN2可以与JAZ亚家族蛋白发生互作,继而负调控棉花对大丽轮枝菌的防御反应。但目前对于TIFY亚家族基因参与棉花抗黄萎病反应的相关研究还未见报道。本研究通过前期转录组数据筛选并克隆出一个TIFY家族基因GhTIFY9。该基因的ORF长度为594 bp,编码197个氨基酸,相对分子质量为21.65 kD,定位于细胞核,所编码蛋白为碱性、亲水性、非跨膜蛋白,只含有一个TIFY结构域,属于TIFY亚家族。RT-qPCR分析表明该基因响应黄萎病菌诱导处理,推测其可能在棉花抗病反应中发挥一定的作用。利用VIGS技术抑制该基因表达后,沉默植株对黄萎病菌的抗性显著降低,其病情指数显著高于阴性对照植株。剖秆检测实验发现,与阴性对照植株相比,GhTIFY9沉默植株维管束的褐变程度更加严重。茎段恢复培养试验结果显示,GhTIFY9沉默植株茎段的真菌菌丝数量明显多于阴性对照植株。以上结果初步表明GhTIFY9正向调控了棉花抗黄萎病反应,但该基因的抗病分子机制及可能参与的抗病信号通路仍需进一步探究。
4 结论
克隆获得一个TIFY转录因子GhTIFY9,其ORF为594 bp,编码197个氨基酸,相对分子质量为21.65 kD,定位于细胞核,编码蛋白为碱性、亲水性、非跨膜蛋白,属于TIFY亚家族。抑制GhTIFY9的表达可以显著降低棉花对黄萎病的抗性。
