植物MYB转录因子调控次生代谢及逆境响应的研究进展
2022-09-14位欣欣兰海燕
位欣欣 兰海燕
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830017)
转录因子又称反式作用因子,可与基因启动子区相关顺式作用元件特异结合,激活基因的表达。目前已经报道了多种植物相关转录因子,如MYB、bHLH、AP2/ERF、WRKY、NAC等[1],其 中MYB转录因子家族是分布最广、功能最强的一类。MYB转录因子由N端保守的MYB域得名,由于进化上的保守性使其几乎存在于所有真核生物中。v-Myb是在禽类成髓细胞病毒(avian myeloblastosis virus,AMV)中发现的第一个MYB 转录因子,Kranz等[2]在玉米(Zea mays)中克隆了首个植物MYB基因,随后,在真菌和动植物中又发现了众多的MYB转录因子。植物中的MYB转录因子的结构和功能更为保守,在调节植物的生长发育、初级和次级代谢以及生物和非生物胁迫响应中发挥着重要作用[1]。本文基于前人的研究成果,总结并讨论了植物MYB转录因子的结构、相关生物学功能以及参与植物激素应答调控机制等方面的研究进展,以期为相关研究提供借鉴。
1 植物MYB转录因子的结构与分类
MYB 转录因子的共同特征是具有保守的MYBDNA结合域,该结构域由1-4个不完整的重复片段(R)组成,每个重复序列编码3个α-螺旋,包含大约50-53个氨基酸残基。在这3个螺旋中,第二和第三个螺旋形成螺旋-转角-螺旋(helix-turn-helix,HTH)结构。MYB转录因子可以通过HTH结构插入到靶DNA的大沟中进行结合,从而调控靶基因的表达。通常每个MYB重复结构域包含3个保守的色氨酸残基,这些残基被18-19个氨基酸隔开形成二级结构[3]。
根据结合结构域所包含的R结构的数目,MYB家族被分为4个亚类:1R-MYB家族、R2R3-MYB家族、3R-MYB家族和4R-MYB家族(图1)[3]。其中,1R-MYB家族包含一个MYB结构域,在调控植物转录和维持染色体结构中起重要作用[4];R2R3-MYB家族基因在MYB结合结构域中包含两个保守的R2和R3重复序列,同时在C末端可变区内包含一个调控结构域(激活或抑制功能)。其成员众多,功能多样,广泛参与细胞分化、次生代谢[5]、环境胁迫以及病虫害的侵袭[6];3R-MYB家族基因保守结构域由R1、R2和R3组成,多参与细胞分化及细胞周期的调控;4R-MYB亚家族基因的保守结构域由4个R1/R2重复序列组成,目前在植物中发现的该亚家族基因数目还很少。
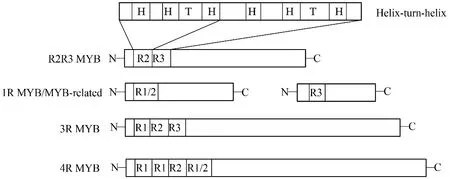
图1 植物MYB转录因子的分类Fig.1 Classification of plant MYB transcription factors
2 MYB参与植物次生代谢调控
2.1 在黄酮生物合成中的作用
黄酮类化合物主要包括花青素、异黄酮、黄酮醇等,这些化合物能够帮助植物抵御非生物和生物胁迫,MYB则通过激活黄酮类代谢合成途径中的多个基因,参与此类化合物的生物合成。已知花青素生物合成受MYB-bHLH-WD(MBW)三元复合物的转录调控,目前已在植物中鉴定出多种与花青素合成相关的MYB蛋白,如杨梅(Myrica rubra)MrMYB1与MrWD40-1和MrbHLH1相 互 作 用,形成MBW复合体调节杨梅中花青素的积累[5]。美洲黑杨(Populusdeltoides)PdMYB118可与bHLH转录因子PdTT8相互作用,从而调节创伤诱导的花青素的积累[7]。类似的还有茄子(Solanum melongena)SmMYB75[8]、红 梨(Pyrus pyrifolia)PyMYB10和PyMYB114[9]等。除了正调控外,杨树(Populus)中PtrMYB57可 与bHLH131和PtrTTG1相 互 作 用负调控花青素的生物合成[10],行使类似功能的还有 葡 萄(Vitis vinifera)中 的VvMYBC2L2[11]、菊花(Chrysanthemum morifolium)中的CmMYB #7和CmMYB6等[12]。除了广泛参与花青素的生物合成,MYB在其他黄酮类化合物的合成中也发挥重要作用。如杜梨(Pyrus betulifolia)PbMYB12b[13]、苹果(Malus domestica)MdMYB22[14]等可正向调控黄酮醇的生物合成。大豆(Glycine max)GmMYB176通过激活大豆查尔酮合成酶基因的表达调控异黄酮类生物合成[15]。
2.2 在木质素生物合成中的作用
木质素是维管植物次生细胞壁的重要组成成分,木质素赋予植物细胞壁机械强力,增加茎的硬度和强度,从而抵御外界环境造成的伤害。MYB转录因子广泛参与木质素的次生代谢调控,如拟南芥AtMYB20、AtMYB42和AtMYB43可激活木质素合成相关基因并介导次生壁形成,沉默该基因使拟南芥木质素合成大量减少并导致植株生长发育缺陷[16]。其他物种MYB转录因子参与木质素生物合成也得到证实,如玉米ZmMYB167[17]、毛白杨(Populus tomentosa)PtoMYB216[18]等。此外,MYB转录因子也可抑制木质素的生物合成,菊花CmMYB8可导致转基因植物中木质素含量降低并改变木质素的组成[19]。柳橙(Citrus sinensis)中的CsMYB330和CsMYB308具有相反的调控作用,前者可激活木质化过程,后者则抑制木质化过程[20]。桉(Eucalyptus)EgMYB1可与组蛋白变体EgH1.3发生特异性相互作用,强烈抑制木质素在木质部细胞壁的沉积,从而防止次生壁过早或不适当的木质化[21]。此外,香蕉(Musa nana)MusaMYB31[22]也能抑制木质素合成。
2.3 参与合成其他次生代谢产物
除了参与黄酮类、木质素等的合成,MYB转录因子还参与其他次生代谢产物的合成调控。番茄(Solanum lycopersicum)表皮毛状体调节因子Woolly和SlMYB31通过调控SlCER6的表达,协同作用于番茄角质层蜡质的生物合成[23]。麻疯树(Jatropha carcas)JcMYB1通过调控脂肪酸(fatty acid,FA)和甘油三酯(triglyceride,TG)生物合成基因的表达,参与种子油脂的合成,并改变FA的组成[24]。研究发现,辣椒(Capsicum annuum)中的CaMYB31可能是辣椒素类合成基因的主调控因子[25]。丹参(Salvia miltiorrhiza)SmMYB98可能调控丹参毛状根中丹参酮和丹酚酸的生物合成[26]。表1总结了MYB转录因子在不同植物次生代谢过程中的主要调控作用。
3 MYB参与植物非生物和生物胁迫响应
盐、干旱、高低温、病虫害等因素严重影响植物的生长和发育,植物则进化出一系列内在分子机制响应各种环境胁迫,其中MYB转录因子在应对生物和非生物胁迫中起到积极的作用。
3.1 盐胁迫响应
MYB转录因子通过提高植物的抗氧化能力应对盐胁迫。拟南芥AtMYB49通过上调过氧化物酶和胚胎晚期丰富蛋白基因,提高植株抗氧化能力;其突变体atmyb49则表现较高的电解质渗漏率和较低的耐盐性。同时,AtMYB49还可直接与AtMYB41、ASFT、FACT、CYP86B1等角质、木质和蜡质生物合成相关基因的启动子结合并激活其表达,促进角质层的形成[28]。水稻OsMYB6通过提高脯氨酸(proline,Pro)含量及各种抗氧化酶(peroxidase,POD;catalase,CAT;superoxide dismutase,SOD)的活性耐受盐胁迫[29]。玉米ZmMYB3R还能调节气孔开度赋予玉米耐盐性[30]。
MYB转录因子还可调节下游基因表达增强植株耐盐性。植物中SOS2(salt overly sensitive 2)编码丝氨酸/苏氨酸蛋白激酶,通过磷酸化激活Na+/H+反向转运体SOS1,促进Na+外流,增强植物的耐盐性。AtMYB42可调节SOS2的表达正调控耐盐性,与野生型相比,AtMYB42过表达株系耐盐性增强,而atmyb42突变体则表现盐敏感[31]。AtMYB30通过调节线粒体选择性氧化酶AOX1a(alternative oxidase 1a)基因的表达调节植物耐盐性,盐胁迫下,AtMYB30可结合在AOX1a的启动子上促进该基因表达,维持细胞氧化还原稳态,从而赋予植株耐盐性[32]。AtMYB12除了促进类黄酮合成和清除活性氧(reactive oxygen species,ROS)外,还可上调脱落酸(abscisic acid,ABA)和脯氨酸合成相关基因的表达[33]。在拟南芥中过表达野草莓(Fragaria vesca)FvMYB24基因能够上调盐胁迫相关基因SOS1、SOS2、SOS3、NHX1、LEA3等的表达,从而提高转基因拟南芥的耐盐性[34]。将猕猴桃(Actinidia chinensis)AcMYB3R基因在拟南芥中过表达,可显著上调RD29A、RD29B、COR15A、RD22等应激反应基因的表达,使转基因植株的耐盐性显著增强[35]。
MYB蛋白的修饰在盐胁迫响应中起重要作用。AtMYB74在盐胁迫下的表达受RdDM(RNA-directed DNA methylation)通 路 控 制,24-nt siRNA靶 向AtMYB74转录起始位点上游约500 bp的区域,使其高度甲基化,使得过表达AtMYB74的转基因种子萌发表现出超敏反应[36]。此外,盐胁迫可以改变水稻OsMYB91启动子区的甲基化,从而诱导OsMYB91在盐胁迫条件下的高水平表达[37]。蒺藜苜蓿MtMYBS1在盐胁迫下高表达,由此导致其启动子及基因的3'末端的DNA甲基化水平降低,而启动子区及翻译起始位点附近组蛋白的H3K9ac修饰水平升高,从而增强耐盐性[38]。
3.2 干旱胁迫响应
MYB作为植物生物合成代谢中最重要的转录因子家族之一,可通过调节黄酮类及花青素等化合物的合成参与植物耐旱性。拟南芥MYB12和MYB75可促进黄酮醇和花青素积累及相关基因(CHS[chalcone synthase]、FLS[flavonol synthase]、DFR[dihydroflavonol reductase]、LDOX/ANS[leucoanthocyanidin dioxygenase/anthocyanidin synthase])的表达,从而增强植株对干旱的耐受性[33,39-40]。过表达大豆GmMYB12可增加下游类黄酮的产生和黄酮生物合成途径相关基因的表达,从而提高种子萌发、根系发育和生长过程中对干旱胁迫的抗性[27]。
角质层是植物叶表面重要的结构层,也是气孔的组成部分。角质层包括角质和蜡质,其生物合成受到MYB转录因子的广泛调控。在拟南芥中,AtMYB30、AtMYB94和AtMYB96是蜡质合成基因的正调控因子。AtMYB96的过表达可促进表皮蜡质合成,从而增强拟南芥的抗旱性;而atmyb94和atmyb96双突变体的角质层失水速率加快,由此表明AtMYB94与AtMYB96在角质层形成过程中具有协同作用[41]。研究发现,与AtMYB96同源的小麦TaMYB31也可通过上调蜡质生物合成基因和干旱响应基因的表达发挥耐旱作用[42]。另一方面,AtMYB41可负调控角质层合成基因ATT1和LACS2的表达,其过表达导致植株矮化、细胞变小、叶片表面渗透性增强等,对干旱胁迫表现超敏性[43]。
气孔孔径的调节是植物控制水分流失的重要方式。AtMYB60是第一个被发现参与气孔运动调控的转录因子,其在保卫细胞中特异表达并受白光和蓝光诱导促进气孔开启;黑暗、干燥、ABA等信号则抑制其表达,导致气孔关闭。在atmyb60突变体中,光诱导的气孔开放受到抑制,从而增强植物的抗旱性;而AtMYB60过表达则使拟南芥植株对干旱表现超敏反应[44]。AtMYB44在保卫细胞中高表达,然而它对干旱的响应存在相反的论点。Jung等[45]的研究表明,AtMYB44过表达增强了种子萌发和气孔关闭过程中对ABA的敏感性,从而提高了植株的耐旱性。Jaradat等[46]则认为AtMYB44能够与ABA受体RCARs/PYR1/PYLs特异结合从而负调控ABA信号。AtMYB96主要表达于叶片的保卫细胞,其过表达能够提高气孔对ABA和干旱的敏感性[47]。棉花GaMYB85则通过降低叶片的气孔密度和气孔开度,使ABA诱导下气孔迅速关闭,从而降低失水率,提高植株耐旱性[48]。
3.3 极端温度胁迫响应
MYB转录因子参与植物低温响应的机制目前存在两种假说,依赖CBF/DREB(C-repeat binding transcription factor/dehydrate responsive element binding factor)转 录 因 子 的ICE1(inducer of CBF expression)-CBFs机制和不依赖CBF的机制。研究发现,AtMYB96可被冷胁迫诱导,并通过HHP1/2/3(heptahelical protein)蛋白激活ICE1的转录活性,从而诱导下游CBF因子的表达,增强植物抗冻性[49]。而AtMYB15在翻译后受MPK6的修饰,使其Ser-168位点发生磷酸化,从而降低MYB15与CBF3启动子的亲和力,最终抑制CBF基因的表达[50]。此外,受冷胁迫诱导的苹果MdMYB23转录因子直接与MdCBF1/2的启动子结合并激活其表达,通过CBFs低温调控途径赋予转基因植物抗寒性[51]。大部分MYB转录因子可能通过CBFs非依赖途径调控植物耐寒性,如AtMYBC1过表达植株对低温胁迫敏感,而atmybc1突变体和AtMYBC1过表达植株中CBF途径中的CBF/DREB低温胁迫响应关键基因表达无明显区别;而CBF过表达植株中AtMYBC1的转录水平也无明显差异,由此表明,AtMYBC1通过不依赖CBF途径的方式负调控拟南芥的低温耐受性[52]。
MYB 转录因子也参与植物的高温胁迫响应。在拟南芥中,AtMYB30通过Annexin介导的胞质钙信号调控氧化和热胁迫应答[53]。百合(Lilium longiflorum)LlMYB305在热胁迫下激活LlHSC70启动子活性参与植株耐热性[54]。番茄MYB转录因子SlLeAN2可调控花青素合成,并通过调节光合作用和提高POD、SOD、CAT的活性增强耐热性[55]。过表达水稻OsMYB55可增强转基因水稻的氨基酸代谢,从而提高植株的耐热性并降低高温对籽粒产量的影响[56]。
3.4 其他非生物胁迫响应
MYB转录因子在应对低磷胁迫中具有重要作用。大豆GmMYB48可与GmSPX1相互作用增强转基因植株对低磷胁迫耐受性[57]。过表达小麦MYB转录因子TaPHR3-A1可增强转基因植物对低磷耐性,并可调节小麦产量相关性状[58]。此外,水稻MYB转录因子OsARM1受砷离子的诱导并与砷转运蛋白相结合调节水稻对砷的吸收[59]。MYB还参与金属离子胁迫响应。拟南芥AtMYB4通过增强抗氧化能力、提高植物螯合素合成酶1(phytochelatin synthase,PCS1)和金属硫蛋白1C(metallothionein,MT1C)的表达来调节镉耐受性[60]。在矮牵牛中过表达萝卜(Raphanus sativus)RsMYB1基因,能促进重金属解毒相关基因的表达,如谷胱甘肽巯基转移酶基因GST(glutathione S-transferase)、络合素酶基因PCS(phytochelatin synthase)以及SOD、CAT等,从而赋予转基因植物对锌、铜、镉等重金属离子的耐受性[61]。盐角草(Salicornia brachiata)SbMYB15通过限制转基因植物对金属离子的摄取并调节抗氧化防御系统,从而缓解镉、镍离子对转基因烟草的胁迫作用[62]。
3.5 参与植物生物胁迫响应
自然界中的生物胁迫可大致分为真菌、细菌及植食性昆虫的侵害,MYB转录因子在应对真菌和细菌侵染方面具有一定的作用。苹果MdMYB30通过调节蜡质的生物合成增强了转基因拟南芥对假单胞杆 菌(Pseudomonas syringae pv tomatoDC3000)的抗性,并提高转基因苹果愈伤组织对苹果炭疽病菌(Glomerella cingulata(Stonem.)Spauld. et Schrenk)的抗性[63]。MdMYB73则通过水杨酸(salicylic acid,SA)途径提高苹果对真菌性葡萄孢菌(Botryosphaeria dothidea)的抗性[64]。辣椒感染青枯病菌(Ralstonia solanacerum)后可使MYB转录因子CaPHL8上调表达,通过激活免疫相关基因的表达增强辣椒的防御反应[65]。野生葡萄中VdMYB1可激活类黄酮代谢关键调控因子二苯乙烯合成酶(stilbene synthase,STS)基因的表达,从而增加白藜芦醇的含量并提高葡萄叶片对白粉病菌的抗性[66]。芥菜(Brassicajuncea)BjMYB1可通过与几丁质酶基因BjCHI1启动子上的W-box-like元件结合,从而提高转基因拟南芥对灰霉病菌的抗性[67]。
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)是植物防御植食性昆虫的关键酶,水稻OsMYB30可上调OsPAL6和OsPAL8的表达,导致转基因水稻中SA和木质素的生物合成增加,从而提高转基因水稻对褐飞虱(Nilaparvata lugens(Stdl))的防御[68]。过表达野生大豆(Glycine soja)GsMYB15的转基因拟南芥叶片饲喂棉铃虫可显著抑制其幼虫免疫相关基因的表达水平[6]。表2总结了MYB转录因子在植物胁迫响应中的作用。
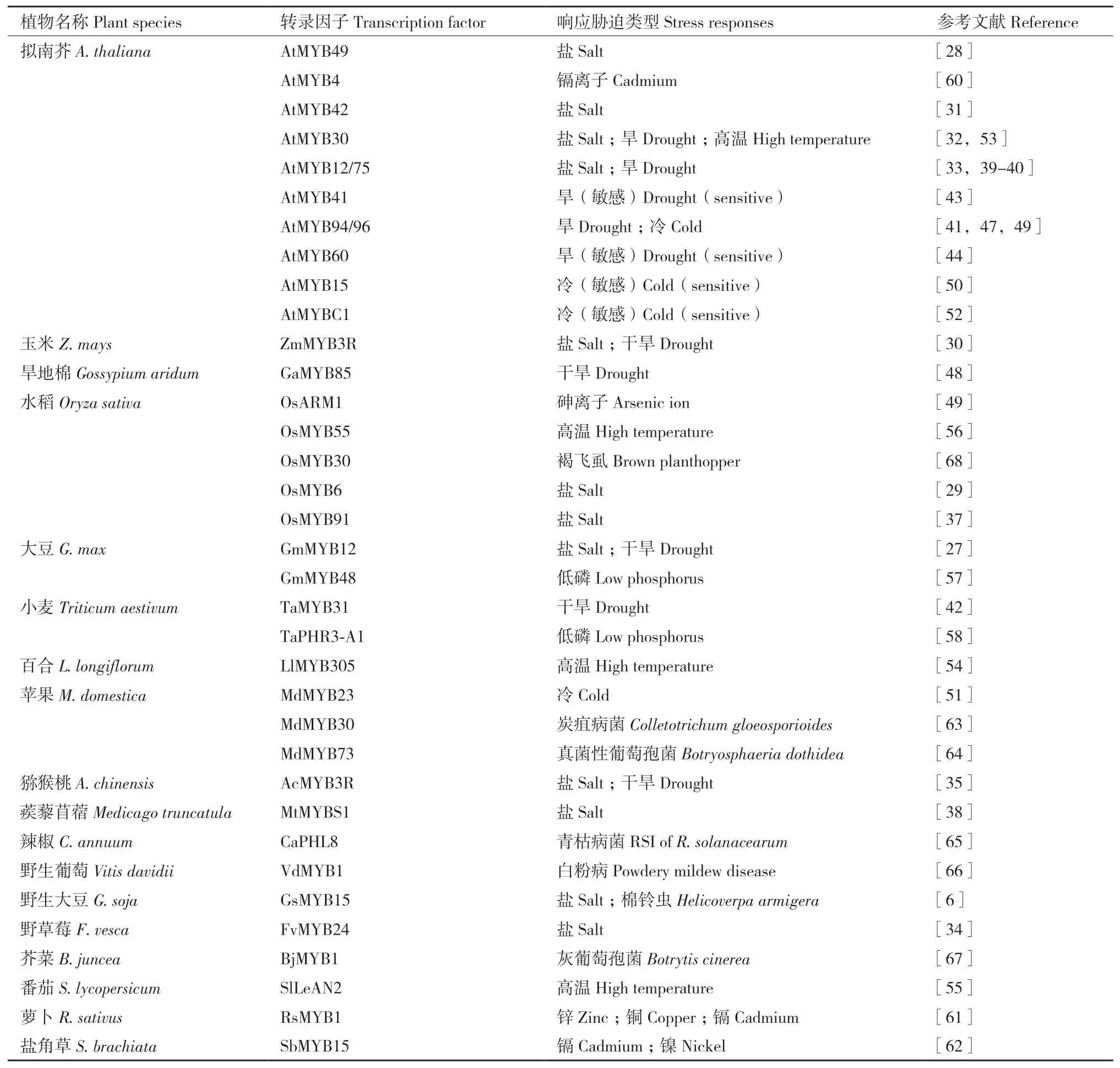
表2 MYB转录因子在植物胁迫响应中的作用Table 2 Roles of MYB transcription factors(TFs)in plant stress responses
4 MYB转录因子参与植物激素应答调控机制
MYB转录因子参与多种生物学过程的调节,虽然信号通路错综复杂,但通常与各种植物激素相关。以模式植物拟南芥为例(图2)[69-78],MYB96不仅可以通过CBFs途径参与低温响应,也可通过ABA信号通路调控耐旱性。在高浓度ABA条件下,MYB96可通过调节组蛋白脱乙酰酶HDA15(histone deacetylase)促进组蛋白H3和H4去乙酰化并抑制GTP结合蛋白ROPs(Rho-related GTPases of plants)的表达,从而在ABA途径中起负调控作用,包括ABA介导的气孔关闭和干旱响应[69]。在MYB96受MIEL1(RING-type E3 ligase)泛素化介导的降解途径中,ABA通常会抑制MIEL1的表达,从而促进MYB96的积累,使MYB96在种子萌发期通过促进初级种子休眠的正调节因子ABI4(ABA insensitive 4)的表达,抑制种子萌发[70]。此外,MYB96还可通过RD22(responsive to dehydration 22)介导的ABA信号诱导生长素结合酶GH3的表达,从而将ABA信号途径与其他激素调节通路联系起来,共同调控干旱条件下侧根的发育以及维持生长素的稳态[71]。不仅如此,MYB96还可将ABA介导的非生物胁迫信号与水杨酸诱导的病原体抗性反应相联系,其过表达能够促进SA合成基因SID2(salicylic acid induction deficient 2)的上调表达,导致内源游离态SA和SAG(SA-β-glucoside)浓度升高,从而提高植株抗病能力[72]。
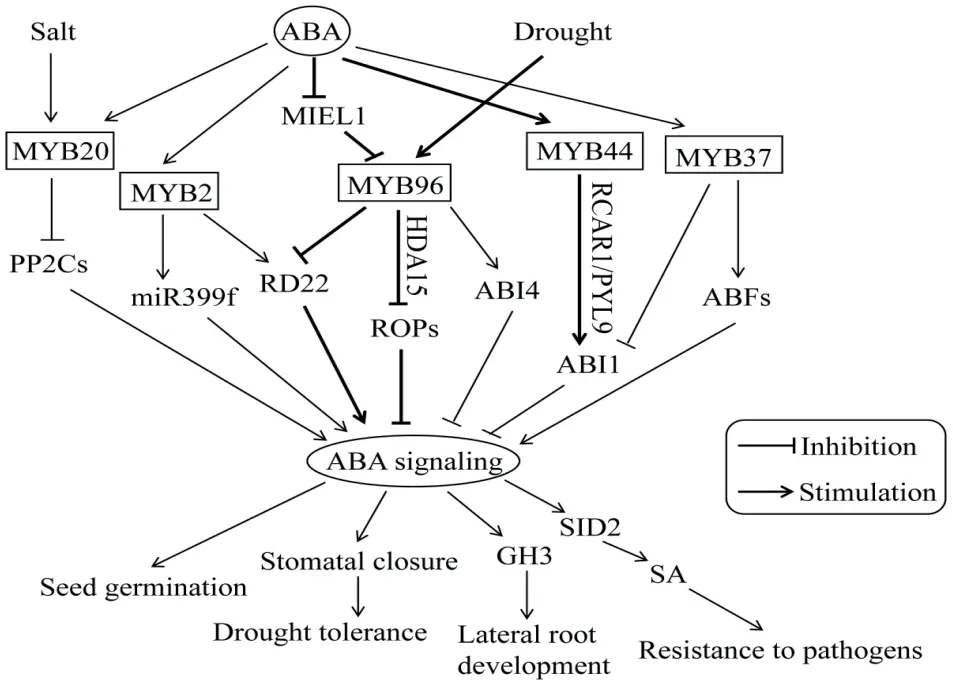
图2 拟南芥MYB转录因子参与ABA介导信号模式图Fig. 2 Schematic diagram of ABA-mediated signaling in which MYB transcription factors are involved in Arabidopsis
除参与ABA介导的气孔关闭外,MYB转录因子还参与ABA调控的其他信号通路。如MYB33和MYB101已被鉴定为种子萌发过程中ABA信号的正调控因子[73],MYB7则通过抑制ABI5(ABA insensitive 5)的表达作为种子萌发过程中ABA信号的负调控因子起作用[74]。此外,MYB2受干旱和ABA的诱导,通过结合RD22的启动子正向调控该基因的表达,从而导致种子萌发对ABA敏感性增加;MYB2还可直接结合在miR399f(microRNA399 precursor gene)上的MYB结合元件驱动该基因的表达,从而降低种子萌发和根系生长对ABA的敏感性[75]。过表达MYB37可上调ABF2/3、DREB2A和MYC2等ABA应答与耐受相关基因的表达,从而在耐受细胞脱水过程中发挥作用[76]。
MYB蛋白也通过ABA信号途径调控植物耐盐性。蛋白磷酸酶家族PP2C(protein phosphatase 2C,PP2Cs)作为ABA信号转导途径中的负调控因子,其主要成员有ABI1、ABI2、HAB1、AHG3和PP2CA。当MYB20受NaCl诱导表达时,可与ABI1和PP2CA的启动子核心元件ACGT结合,抑制二者的表达,最终提高植物耐盐性[77]。MYB44也通过调控PP2Cs参与耐盐反应,在过表达MYB44的转基因植株中,盐胁迫下PP2Cs表达降低,而myb44突变体株系的PP2Cs表达增强,导致盐胁迫耐受性降低[78]。
MYB转录因子对植物生长发育的调控机制与植物激素密切相关(图3)[79-84]。Song等[79]提出模型阐明茉莉酸(jasmonic acid,JA)调控拟南芥雄性育性的分子机制。当JA水平升高时,COI1(coronatine insensitive 1)与JAZs(jasmonate-ZIM domain containing protein,JAZ)蛋白之间相互作用形成复合体,使JAZs在26S蛋白酶体中被泛素化降解,释放出被JAZs抑制的MYB21和MYB24,随后二者与bHLH转录因子MYC形成 MYB-MYC 复合物,激活调控雄蕊发育所需的相关基因的表达;而在coi1突变体中,MYB21和MYB24的N端与JAZs蛋白相互作用,从而抑制雄蕊发育早期基因的表达。研究发现,赤霉素(gibberellin,GA)对拟南芥雄蕊发育的调控作用位于JA信号通路的上游,GA通过26S蛋白酶体途径触发DELLA蛋白降解,从而解除DELLA蛋白对JA生物合成基因DAD1和LOX1的抑制,随后促进JA的合成并解除被JAZs抑制的MYB21、MYB24和MYB57蛋白,进而促进雄蕊花丝的发育[80]。MYB转录因子除参与JA和GA途径调控雄蕊发育之外,还参与生长素途径(auxin)调控花药开裂。生长素应答因子ARF17(auxin response factor 17)可 驱动MYB108和NST1(NAC secondary wall thickening promoting factor 1)的表达促进花药内壁木质化和开裂[81]。此外,MYB26、ARF8.4(auxin response factor 8.4)和NST1/NST2构成的基因通路也调控花药内壁的木质化并促进花药开裂[82]。
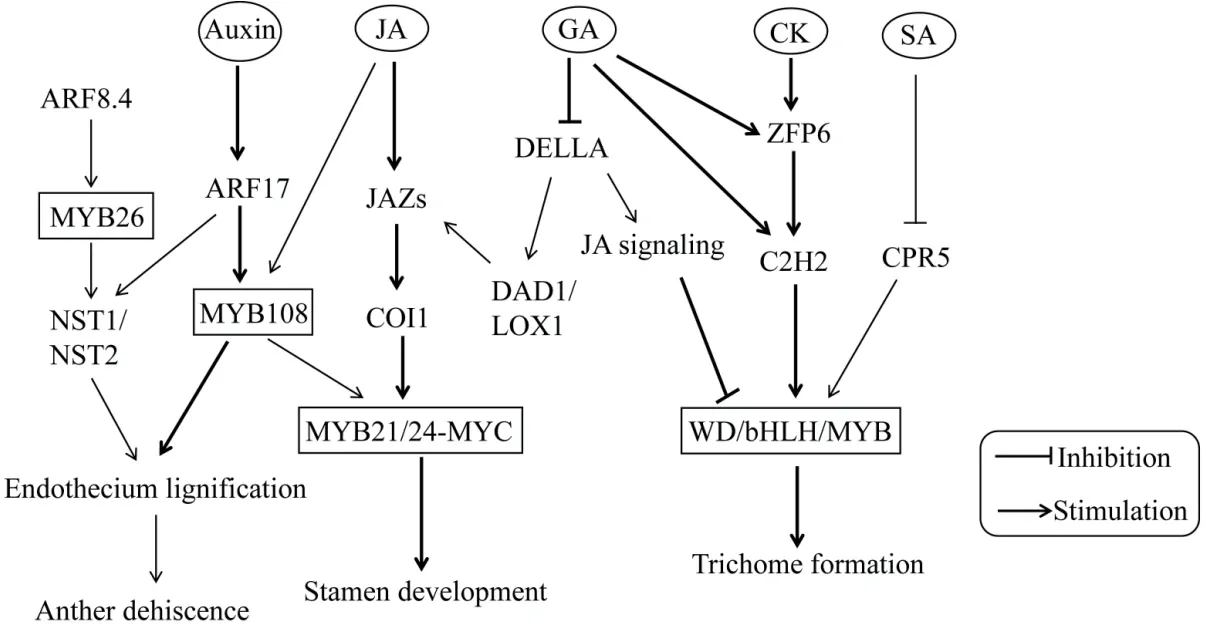
图3 MYB转录因子参与植物激素调控生长发育网络图Fig. 3 MYB transcription factors involved in plant hormone regulation of growth and development network
在表皮毛发育过程中,GA、JA和细胞分裂素CK(cytokinin)均具有促进作用,而SA则抑制表皮毛生长。与调控雄蕊发育过程类似,GA和JA信号分别诱导DELLAs和JAZs降解,从而解除对WD/bHLH/MYB(MBW)复合物的抑制,两条激素调控通路协同作用并相互依赖地调节拟南芥毛状体发育[83]。此外,CK通过锌指蛋白ZFP6(zinc finger protein 6)调节MBW复合体,SA则通过细胞周期调节因子CPR5(cell progression regulator 5)调控MBW复合体,进而影响毛状体的形成[84]。目前植物激素与MYB转录因子相互作用调控细胞生长发育的研究已较为深入,但详细调控网络还需进一步构建。
5 展望
MYB转录因子广泛存在于植物中,并积极参与植物生长发育调控及胁迫响应。MYB家族内部成员在结构和功能上具有一定的相关性,可通过分析其蛋白结构和表达模式来预测未知MYB转录因子的生物学功能。迄今为止,对MYB的研究多集中于单一因子的孤立作用,对其在不同信号通路中与其他因子的相互作用机制尚待深入探索;与此同时,不同MYB转录因子存在功能冗余,利用传统的分子生物学方法难以揭示其作用机制。随着CRISPR/Cas9等技术的发展,MYB转录因子调控网络的研究将成为热点,这对进一步揭示MYB响应多种逆境胁迫的作用机制并应用于生产实践具有重要意义。
