人骨髓间充质干细胞外泌体通过miR-93-5P 介导改善肾纤维化*
2022-09-14张瑞石嘉琪王雪蓉顾夏梦陈晓岚
张瑞,石嘉琪,王雪蓉,顾夏梦,陈晓岚
(1 南通大学医学院,南通 226001;2 南通大学附属医院肾内科)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)被报道[1-2]具有促进血管生成,减少炎症反应,从而加速肾功能恢复和损伤部位的修复,防止肾脏进一步受损的作用。BM-MSCs 主要通过细胞因子的旁分泌或自分泌来改变微环境,调节炎症和纤维化对组织和细胞的损伤[3-4]。BM-MSCs 分泌的外泌体富含蛋白质、脂质、mRNA 和miRNA 等生物活性分子,可以调节组织或生物体的微环境,促进机体修复[5-6]。越来越多的研究[7-8]显示miRNAs 在慢性肾脏疾病(chronic kidney disease,CKD)的发病中发挥了重要的作用,有报道[9]称微小RNA-93-5P(microRNA-93-5P,miR-93-5P)可以作为一种非侵入性的生物标志物,用于检测顺铂刺激的近端肾小管损伤。此外,上调miR-93-5P 能够抑制转化生长因子β(transforming growth factor β,TGF-β)诱导的小管细胞纤维化[10]。因此,本研究通过建立小鼠肾脏单侧输尿管梗阻(unilateral ureteral obstruction models,UUO)模型,用BM-MSCs 外泌体(BM-MSCs exosomes,BMexo)的miR-93-5P 进行干预,以探讨其对肾脏纤维化的保护机制。
1 材料和方法
1.1 材料来源 MiR-93-5P 抑制剂、阴性对照(NC)抑制剂(RiboBio,广州,中国),水通道蛋白1(aquaporin,AQP1)(Proteintech,武汉,中国),TRIzol 试剂盒、反转录试剂盒和SYBR green real-time PCR Master Mix试剂盒(诺唯赞,南京,中国),α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)、纤连蛋白(fibronectin,FN)、上皮细胞钙黏蛋白(E-cadherin)和α-Tubulin(Abcam,英国)。
1.2 BM-MSCs 的提取、培养和鉴定[11]用等体积的磷酸缓冲盐溶液(phosphate buffered saline,PBS)稀释正常人骨髓并轻轻混合。之后,加入等体积的淋巴细胞分离液,将稀释的骨髓轻轻置于淋巴细胞分离器上,离心后分为4 层,吸出第二层(白色透明层)并与2~3 mL PBS 混合。离心,弃上清,将沉淀重悬于2~3 mL PBS 中。该步骤重复2 次。离心后弃上清液,加入低糖培养基(89% DMEM/低糖+10%胎牛血清+1%青霉素-链霉素溶液)重悬细胞沉淀。培养3 d 后不弃培养基,直接加入3~5 mL 低糖培养基继续培养,5~7 d 后细胞完全贴壁时更换培养基。用异硫氰酸荧光素标记的CD 抗原(亦称白细胞分化抗原)CD29、CD90、CD34、CD45 特异性抗体染色BM-MSCs,流式细胞仪分析。
1.3 外泌体的分离和鉴定[12]取培养的第3~5 代BMMSCs,将培养基更换为DMEM/低糖,培养24~48 h。使用差速离心法分离外泌体,在透射电子显微镜下观察外泌体的形态。分离后,将10 μL 外泌体稀释在1 mL 过滤后的PBS 中,通过Zetaview(PMX120-Z,德国)测量大小分布。Western Blot 鉴定外泌体分子标志物CD9 和CD63。通过蛋白质浓度测定法(Bicinchoninic acid,BCA)测量总蛋白确定外泌体的数量,每次使用的外泌体量为200 μg/每只小鼠。分别用200 nmol/L miR-93-5P 抑制剂或NC 抑制剂转染BM-MSCs 48 h,然后收集BM-exo。
1.4 动物模型的建立 健康雄性BaLB/c 小鼠,6~8周龄,质量(20±2) g,购自南通大学实验动物中心(动物伦理审批号:220191465)。使用0.08 mL/10 g质量的10%戊巴比妥麻醉小鼠。将小鼠固定并消毒,在耻骨联合上方腹部中线左侧5~6 mm 处切开腹壁。分离左侧输尿管并用4-0 丝线结扎,然后整层缝合。假手术组(Sham 组)的左输尿管被隔离但不结扎。在UUO术后的第1、3、5 天给UUO 模型组尾静脉注射PBS(0.1 mL/小鼠),BM-exo 组小鼠尾静脉注射正常人BM-exo(200 μg 外泌体溶于0.1 mL PBS/小鼠),BMexo/miR-93-5P 抑制剂组小鼠注射含有miR-93-5P抑制剂的MSC-BM-exo(200 μg 外泌体溶于0.1 mL PBS/小鼠)。7 d 后处死小鼠。收集血液样本以确定血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)。收集肾组织并在液氮中速冻,并储存在-80 ℃以提取RNA 和蛋白质。
1.5 外泌体的荧光标记 BM-MSCs 用细胞示踪剂Dil-C18(碧云天,中国)标记1 h,用PBS 洗涤3 次。从Dil 标记的BM-MSCs 的条件培养基中收获外泌体,并在UUO 术后的第1、3、5 天分别注射到小鼠体内(200 μg 外泌体溶于0.1 mL PBS/小鼠),第7 天处死取肾进行免疫荧光检测。
1.6 Western Blot 用蛋白裂解液提取肾组织蛋白,检测蛋白质浓度。取50 μg 肾组织样本,用10%聚丙烯酰胺凝胶进行电泳分离,湿法转膜。封闭、滴加一抗(α-SMA、FN、E-cadherin,均1∶500)后在4 ℃过夜,滴加二抗并孵育,TBST 清洗,最后用增强型化学发光试剂(enhanced chemiluminescence,ECL)显影。Image J 软件扫描条带灰度值,以α-Tubulin 作为内参照,计算各目的蛋白的相对表达量。
1.7 免疫组化和病理组织学染色 肾组织石蜡切片脱蜡水化后,分别行α-SMA(1∶1 000)、FN(1∶1 000)、E-cadherin(1∶500)免疫组化染色以及HE、过碘酸雪夫(periodic acid-schiff,PAS)和Masson 染色。每只小鼠任选4 张切片,每个切片任选5 个视野,在200×视野下检测α-SMA、FN 和E-cadherin 阳性染色的表达强度,观察肾组织细胞形态、分布以及细胞外基质沉积,并随机拍摄肾组织图像。以Image Pro Plus 6.0 为工具对阳性区域的积分光密度(integral optical density,IOD)进行量化,并测量每个视野下肾小球PAS 阳性染色(紫红色部分)面积和肾小球面积,Masson 染色下阳性胶原沉积(蓝色部分)面积,计算胶原沉积面积占整个视野面积的百分比。
1.8 统计学方法 所有数据均采用SPSS 17.0 软件进行统计分析,实验数据以表示,采用独立样本t 检验、非参数t 检验、单因素方差分析(ANOVA)等方法,P<0.05 表示差异有统计学意义,
2 结果
2.1 BM-MSCs 的流式鉴定结果 BM-MSCs 的表面标志物CD29、CD90 呈阳性表达,CD34、CD45 的表达呈阴性,证明外泌体来源的细胞为人BMMSCs,见图1。

图1 BM-MSCs 细胞表面标志物CD29、CD90、CD34、CD45 的流式鉴定
2.2 BM-exo 的表征 通过连续离心和超离心从MSCs 培养上清中纯化外泌体,透射电镜显示分离的MSC 囊泡具有典型的杯状异物形状,具有双层膜结构。纳米颗粒跟踪分析结果显示,颗粒的直径均在30~200 nm 范围内。此外,Western Blot 分析证实了外泌体CD9 和CD63 的表达,而作为阴性对照组的BM-MSCs 不表达这两种分子,见图2。以上结果表明收集到的BM-MSCs 的分泌颗粒为外泌体。

图2 BM-exo 的鉴定
2.3 BM-exo 中miR-93-5P 的表达和体内吞噬结果BM-MSCs 经miR-93-5P 抑制剂处理后,收集的BM-exo 中miR-93-5P 的表达显著下调(P<0.01),经Dil 处理过的外泌体尾静脉注射入小鼠体内后,免疫荧光显示,Dil 标记的BM-exo 被AQP1 标记的肾小管上皮细胞吞噬,提示肾小管上皮细胞能吞噬外泌体,见图3。

图3 BM-exo 中miR-93-5P 的表达和肾小管细胞吞噬图
2.4 各组小鼠血清BUN、Scr 生化指标的变化 与注射PBS 的UUO 小鼠相比,尾静脉注射BM-exo 的UUO 小鼠第7 天的血BUN、Scr 水平降低,而注射BM-exo/miR-93-5P 抑制剂的UUO 小鼠肾功能并没有改善(均P<0.05),见图4。
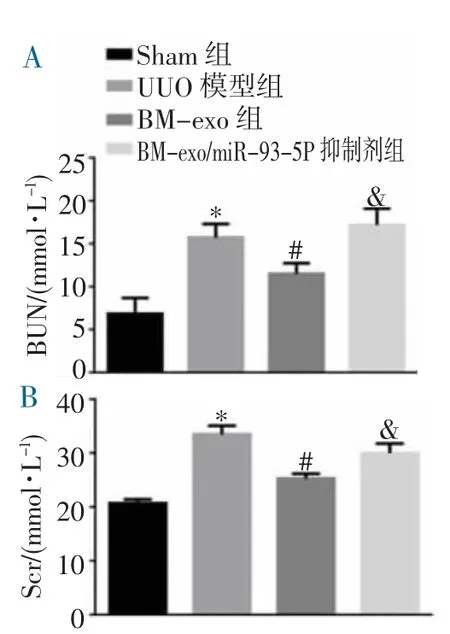
图4 4 组小鼠BUN、Scr 的表达变化
2.5 各组小鼠肾组织病理学改变 Sham 组小鼠肾小球和肾小管未见明显病理改变。术后7 d,UUO 模型组和BM-exo/miR-93-5P 抑制剂组小鼠PAS 染色显示肾小球病变不明显,而肾小管上皮细胞扁平,刷状缘脱落,肾小管管腔扩张,间质呈纤维化样改变,散在炎性细胞浸润;Masson 染色显示UUO 模型组和BM-exo/miR-93-5P 抑制剂组肾间质见胶原纤维沉积。而BM-exo 组小鼠肾间质病理改变较UUO 模型组和BM-exo/miR-93-5P 抑制剂组轻。量化分析表明BM-exo 组小鼠的肾间质纤维化面积显著低于UUO 模型组和BM-exo/miR-93-5P 抑制剂组(均P<0.05)。提示BM-exo 可通过miR-93-5P 介导减轻UUO 小鼠肾间质的损害程度(图5,见封三)。
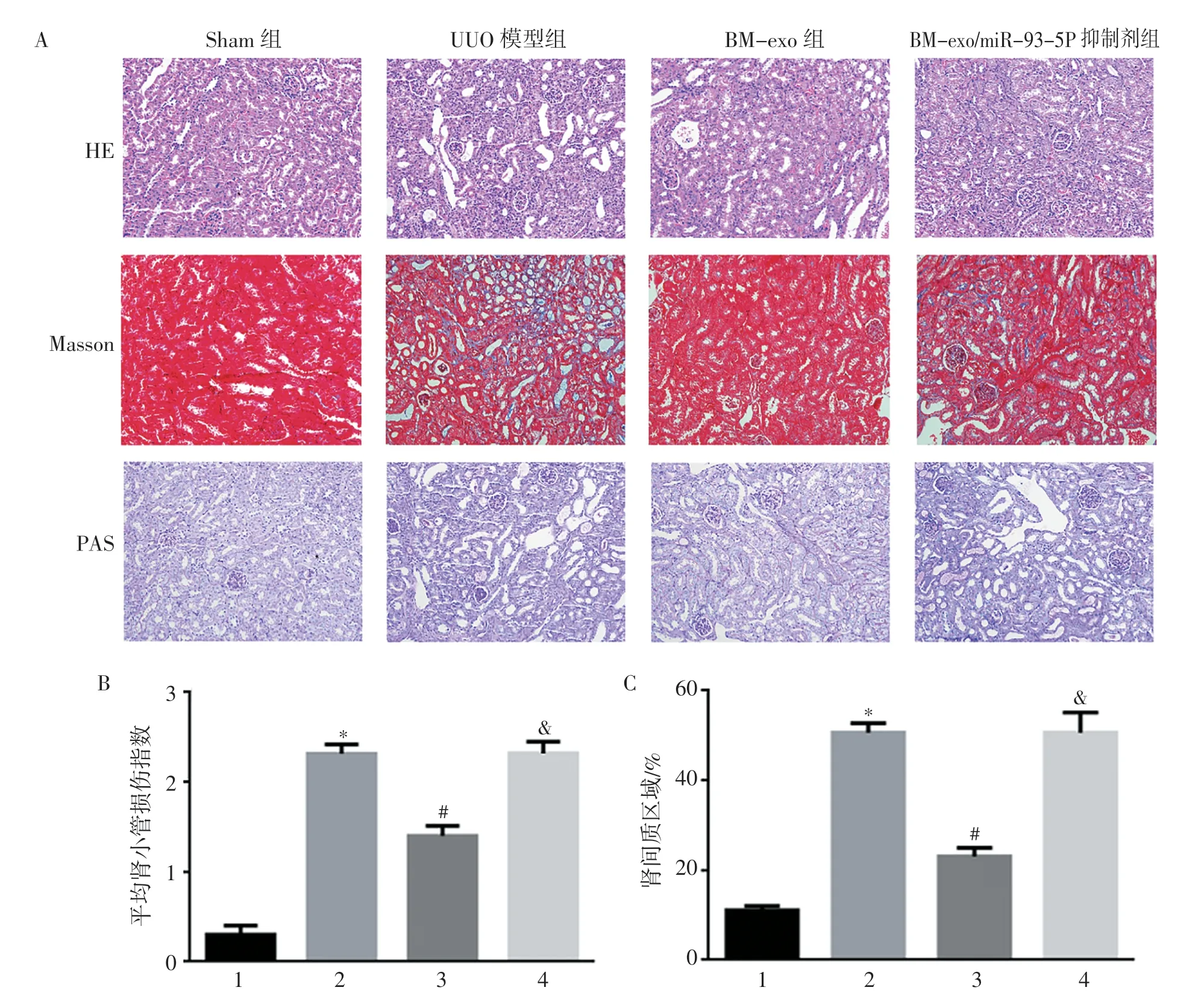
图5 4 组小鼠病理学变化
2.6 各组小鼠上皮-间质转化(epithelial-mesenchymal transition,EMT)的变化 通过对相关蛋白的免疫组化染色和Western Blot 分析,发现UUO 小鼠肾小管上皮标志物E-cadherin 的表达降低,而成纤维细胞标志物α-SMA 的表达显著增加,FN 的表达也明显增加。与UUO 小鼠相比,BM-exo 能显著抑制UUO小鼠肾脏FN 和α-SMA 的表达,促进E-cadherin 的表达;与BM-exo 组小鼠相比,BM-exo/miR-93-5P抑制剂组小鼠的肾脏纤维化加重(均P<0.05)。这些结果表明BM-exo 可通过miR-93-5P 介导抑制UUO小鼠肾间质纤维化,见图6。

图6 各组小鼠α-SMA、E-cadherin、FN 的表达
3 讨论
肾间质纤维化的一个重要特征是间质炎症细胞的浸润和炎症介质的释放,而成纤维细胞的活化和增殖可导致过量的细胞外基质沉积[13]。因此,需要进一步阐明肾纤维化的发病机制,寻找新的治疗干预措施。BM-MSCs 可改善损伤区的微环境,对受损的肾脏具有保护作用,其分泌的外泌体富含蛋白质、脂质、核糖核酸和miRNA 等生物活性分子,可以调节组织或生物体的损伤微环境[14]。MiRNA 作为非编码RNA,由于其多样性具有沉默某些蛋白分子的功能,近些年已经成为BM-MSCs 外泌体中研究最为广泛的生物活性物质。其作为外泌体中的一部分,由囊泡包裹分泌到细胞外,通过细胞的自分泌或旁分泌功能到达受损部位发挥生物活性作用[15-16]。
根据本研究先前的高通量测序结果,与正常人相比,CKD 患者BM-exo 中miR-93-5P 下调,在此基础上,本研究构建UUO 小鼠肾纤维化模型,检测BM-exo 是否通过miR-93-5P 介导对小鼠肾脏纤维化的影响。
本研究发现miR-93-5P 在UUO 诱导的纤维化小鼠的肾脏中表达下调(P<0.05),提示小鼠肾脏miR-93-5P 的下调和其纤维化发生有关。体内吞噬实验验证,BM-exo 能顺着尾静脉血流到达肾脏,因此,通过尾静脉注射BM-exo 和加入miR-93-5P 抑制剂的BM-exo 观察二者对肾脏纤维化的影响,结果表明,BM-exo 组UUO 小鼠肾脏病理损伤、肾纤维化明显改善,而BM-exo/miR-93-5P 抑制剂组对小鼠肾脏纤维化的进展没有改善作用,提示BM-exo 通过miR-93-5P 介导减轻肾脏纤维化。以细胞外基质过度沉积为特征的肾纤维化在肾脏病的发展中起了核心作用,肾小管上皮细胞在获得间充质细胞表型的同时失去了上皮细胞的表型,导致肌成纤维细胞的数量大量增加,最终导致肾间质纤维化的发生[17]。本研究发现,UUO 小鼠肾小管上皮细胞发生EMT,而细胞间黏附分子E-cadherin 的丢失是EMT 发生的重要决定因素[18]。本研究结果也证实,BM-exo 通过miR-93-5P 介导降低UUO 小鼠肾组织中的α-SMA 和FN 沉积,减少E-cadherin 的丢失。
综上所述,BM-exo 可通过miR-93-5P 介导减轻小鼠肾脏纤维化。本研究结果为BM-exo 介导的miRNAs 基因疗法应用于未来慢性肾纤维化的临床治疗提供思路。
