小胶质细胞过表达IL-10 改善帕金森病模型小鼠运动障碍*
2022-09-14彭建亚沈康丽袁王睿邓乔轩庄乾兴
彭建亚,沈康丽,陈 澍,陈 锐,袁王睿,邓乔轩,庄乾兴*
(南通大学医学院生理学系,南通 226001)
帕金森病(Parkinson's disease,PD)是一种常见的、由于黑质多巴胺能神经元退行性病变所引起的中老年性神经系统疾病,临床上主要表现为运动发起困难、运动迟缓、静止性震颤和肌肉僵直等运动障碍,严重影响患者的生活质量,甚至直接威胁患者的生命安全[1-2]。PD 病理进程中伴随着以神经胶质细胞的激活及炎症因子的释放为主要特征的神经炎症反应[3-4]。神经胶质细胞的激活可释放多种可溶性因子,包括细胞因子、神经营养因子、自由基、脂质代谢产物等。其中神经营养因子如胰岛素样生长因子-1、脑源性神经营养因子和胶质源性神经营养因子等能促进受损神经元的功能恢复而帮助受损神经元存活,发挥神经营养及保护作用。然而随着炎症反应的过度激活,也会产生包括白细胞介素(interleukin,IL)-1β、IL-8、IL-12、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在内的大量的炎性细胞因子,这些炎性细胞因子具有神经毒性,能导致正常神经元功能改变乃至凋亡[5-6]。因此,以抑制神经炎症反应的过度激活为目的,寻找抑制炎症介质的释放而促进受损神经元功能恢复的抑炎因子有望为PD 治疗提供新的思路。
IL-10 是一种多效细胞因子,由活化的免疫细胞包括T 细胞、B 细胞和巨噬细胞等产生,在调节炎症反应和免疫反应中发挥着多重作用,通过抑制炎症介质的释放、增强抗炎介质的产生以及抑制抗原递呈,促进单核巨噬细胞的吞噬功能和对抗炎症反应,尤其是阻断Toll 样受体介导的炎症过程[7]。在PD发生发展过程中,脑膜中的免疫细胞迁移至大脑实质中去,这些免疫细胞被激活后通过多种机制相互作用,分泌炎性因子放大炎症信号,同时产生神经毒素直接作用于多巴胺能神经元,最后导致神经元死亡。由此有效地抑制神经炎症也将可能成为防治PD的重要策略[8-9]。本研究利用黑质致密部(substantia nigra pars compacta,SNc)小胶质细胞过表达IL-10的PD 模型小鼠,探索小胶质细胞过表达IL-10 通过影响PD 模型小鼠神经退变和神经炎症在PD 运动障碍中的作用,为PD 的发病机制和防治措施提供新的线索。
1 材料与方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)级8~12 周龄C57BL/6 雄性小鼠,体质量20~30 g,购自南通大学实验动物中心。本实验经南通大学实验动物中心伦理委员会批准(S20210120-907)。
1.2 实验方法
1.2.1 脑立体定位手术及病毒注射 在异氟烷麻醉下(4%诱导,1.5%维持),将小鼠置于脑立体定位仪上(1404,David Kopf Instruments,Tujunga,CA),根据小鼠脑立体定位图谱(Paxinos and Waston,2011),按SNc 坐标位置(前囟后3.16 mm,中线两侧±1.25 mm,硬膜下4.1 mm)在恒流输液泵(KDS100,KD scientific,MA)的驱动下使用微量注射器(Hamilton 7632-01,Reno,NV)将AAV9-Iba1p-IL-10-2A-EGFP(病毒滴度为5×1012,广州派真生物技术有限公司)注入双侧SNc(每侧0.5 μL,双侧共1 μL),注射速度为20 nL/min,注毕留针20 min 以让注射部位更好地吸收病毒,然后再以0.5 mm/min 速度将注射针缓缓拔出,防止病毒沿注射管回流而扩散。手术后,动物被单独饲养,并至少恢复72 h。
1.2.2 PD 模型小鼠的制备 (1)将小鼠随机分为4组:正常组、PD 模型组、PD 模型+对照病毒组、PD 模型+IL-10 过表达组。(2)PD 模型组小鼠,病毒注射后第21 天腹腔注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrapyridine,MPTP)(20 mg/kg),每隔2 h 注射1 次,共注射4 次。
1.2.3 免疫荧光组织化学实验 根据先前报道[10-11]的方法进行。成年小鼠(体质量20~30 g)经异氟烷麻醉(4%诱导)后,经左心室灌流生理盐水50 mL,然后换成含4%多聚甲醛的磷酸缓冲液(phosphate buffer,PB)固定液灌流250~300 mL。灌流后将脑取出,分离含SNc 的脑组织,放入4 ℃固定液中固定12 h,之后依次放入20%、30%的蔗糖溶液中脱水24 h。将脱水脑组织用O.C.T.包埋,放置冰冻切片机(CM1850,Leica,Germany)内速冷后制作冰冻切片,切片厚度30 μm。将组织切片用含0.25% Triton X-100 的磷酸盐缓冲液(phosphate buffered saline with Triton X-100,PBST)冲洗6 次,5 min/次,然后用含10%牛血清的PBST 室温下封闭30 min。分别加入一抗:兔抗小鼠酪氨酸羟化酶(tyrosine hydroxylase,TH,1∶500,MilliporeSigma,St.Louis,MO;Cat#AB152,RRID:AB_390204)和兔抗小鼠Iba1(1∶500,Wako Pure Chemical Industries,Tokyo,Japan;Cat#019-19741,RRID:AB_839504),4 ℃过夜。PBST 冲洗6 次,5 min/次,常温、避光下在含0.1% Triton X-100 的0.01 mol/L PBST中加入Alexa 488 连接的第二抗体(山羊抗兔,1∶2 000,Thermo Fisher Scientific,Sunnyvale,CA)孵育2 h,用含0.1% Triton X-100 的0.01 mol/L PBST 洗3 次,用封片剂(Southern Biotech,Cambridge,UK)封固。在倒置激光共聚焦显微镜(SP2 TCS,Leica)下观察脑片并拍照。
1.2.4 挑战平衡木测试 采用自制的挑战平衡木装置进行动物行为学测试。该平衡木由1 根长125 cm的横梁跑道构成,横梁跑道的宽度依次为3、2.5、2、1.5、1 cm,长度均为25 cm,横梁间隔均为1 cm,高度均为4 cm,跑道最窄一端设有1 个黑色塑料鼠巢(15 cm×15 cm×8 cm)用于激发动物穿越平衡木,见图1。平衡木离墙面50 cm,距地面90 cm,地面上铺以软垫以防止跌落的动物受伤。记录动物通过平衡木的总步数、平均每步的错误数及通过平衡木所花费的时间,数据经标准化后进行统计分析。

图1 挑战平衡木检测装置
1.3 统计学方法 采用SPSS 19.0 软件(SPSS,Chicago,IL)进行统计分析,数据均以表示。分别采用单因素方差分析(one-way ANOVA)及纽曼-科伊尔斯后检验(Newman-Keuls post hoc test)分析不同测试组间的差异,P<0.05 表示差异有统计学意义。
2 结果
2.1 IL-10 在SNc 小胶质细胞中的表达 依据实验流程(图2A,见封二),在SNc 微量注射IL-10 过表达腺相关病毒AAV9-Iba1p-IL-10-2A-EGFP(图2B,见封二),病毒所携带的IL-10 基因在启动子Iba1 的驱动下在小胶质细胞内特异表达IL-10。腺相关病毒注射21 d 后显示IL-10 在SNc 小胶质细胞内表达(图2C1~C2,见封二)。
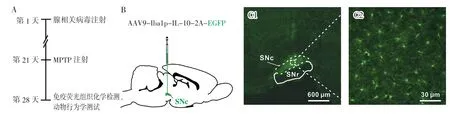
图2 实验流程及IL-10 在SNc 小胶质细胞中的表达
2.2 小鼠SNc 多巴胺能神经元的凋亡 免疫荧光组织化学染色显示各组小鼠SNc 多巴胺能神经元的数密度发生了显著的变化(F(3,36)=25.267,P<0.001)。与正常组相比较,PD 模型组小鼠SNc 多巴胺能神经元发生了显著的凋亡(P<0.001);与PD 模型组相比,PD模型小鼠微量注射对照病毒没有显著影响SNc 多巴胺能神经元的凋亡(P>0.05),而SNc 小胶质细胞过表达IL-10 显著地缓解了SNc 多巴胺能神经元的凋亡(P<0.001)(图3,见封二)。

图3 各组SNc 多巴胺能神经元凋亡的比较
2.3 小鼠SNc 小胶质细胞的面积密度 免疫荧光组织化学染色显示各组小鼠SNc 小胶质细胞的面积密度发生了显著的变化(F(3,36)=85.533,P<0.001)。与正常组比较,PD 模型小鼠SNc 小胶质细胞的面积密度显著升高(P<0.001);与PD 模型组比较,PD 模型小鼠微量注射对照病毒对SNc 小胶质细胞的面积密度没有显著影响(P>0.05),而SNc 小胶质细胞过表达IL-10 显著地缓减了SNc 小胶质细胞的活化(P<0.001)(图4,见封二)。

图4 各组SNc 小胶质细胞表达的比较
2.4 PD 模型小鼠SNc 小胶质细胞过表达IL-10 改善运动障碍 应用自制挑战平衡木装置测试显示,各组小鼠穿过挑战平衡木的步数(F(3,36)=23.76,P<0.001)、踩踏的错误率(F(3,36)=5.927,P=0.002)及穿越平衡木的时间(F(3,36)=7.94,P<0.001)均发生了显著的变化。与正常组相比较,PD 模型小鼠穿过挑战平衡木的步数显著增加(P<0.001),踩踏的错误率显著升高(P<0.01),穿越平衡木的时间也显著延长(P<0.01)。与PD 模型组比较,PD 模型小鼠微量注射对照病毒的小鼠穿过挑战平衡木的步数、踩踏的错误率及穿越平衡木的时间差异均无统计学意义(均P>0.05);而PD 模型小鼠SNc 小胶质细胞过表达IL-10 显著增加小鼠穿过挑战平衡木的步数(P<0.001)、踩踏的错误率(P<0.05)及穿越平衡木的时间(P<0.01)。

图5 SNc 小胶质细胞过表达IL-10 改善PD 模型小鼠运动障碍
3 讨论
PD 的发病机制尚不明确,目前多认为其可能与老化、遗传和环境等因素有关。近年来越来越多的研究[1,6,12-13]证实,小胶质细胞的过度激活与PD 的发病机制有关。小胶质细胞来源于间充质中胚层的巨噬细胞,形态上主要分为分枝状和阿米巴状,前者为未被激活状态的小胶质细胞,后者为活化状态的小胶质细胞。在PD 病理进程中,受损的黑质多巴胺能神经元能够释放TNF-α 及γ 干扰素(interferon-γ,IFN-γ)等炎症因子,激活SNc 中的小胶质细胞,其分泌的TNF-α、IFN-γ 及IL-1β 等炎症因子进一步激活周围的其他小胶质细胞[3-4,12]。此外,与PD 密切相关的路易小体的主要成分α-突触核蛋白也对小胶质细胞具有直接的激活作用。激活后的小胶质细胞可以通过形态的改变吞噬α-突触核蛋白,活化还原型的辅酶Ⅱ,还原型辅酶Ⅱ的激活又可以导致活性氧簇和细胞内活性氧簇的合成增加,进而加速了神经元的凋亡过程[13-14]。
大量研究[4,7,13]表明,PD 病理进程中抑炎因子IL-10 通过其典型的抗炎和抗凋亡的神经保护机制参与PD 运动调控。临床研究[9]显示,PD 患者血清内IL-10 的含量显著升高。IL-10 基因启动子多态性与PD 患者的发病年龄相关[14]。脑内微量注射表达含人源IL-10 基因的慢病毒能够缓解动物前肢的运动障碍[15];IL-10 基因敲除小鼠腹腔注射脂多糖后其运动协调能力与野生型小鼠相比显著地恶化[16]。这些临床与基础研究提示:IL-10 很可能在脑内通过其抗炎和抗凋亡作用发挥重要的运动调控功能,并在PD运动障碍的改善中发挥重要作用。
本研究利用腺相关病毒过表达技术,选择性地在PD 模型小鼠SNc 小胶质细胞过表达IL-10。进而发现,与正常组相比,PD 模型小鼠SNc 多巴胺能神经元发生了显著的凋亡且小胶质细胞的面积密度显著增加;与PD 模型组相比较,SNc 小胶质细胞过表达IL-10 显著地减少SNc 多巴胺能神经元的凋亡且降低小胶质细胞的面积密度。结果表明,SNc 小胶质细胞过表达IL-10 能够减轻PD 模型小鼠SNc 多巴胺能神经元的神经退变及小胶质细胞的神经炎症。进一步采用挑战平衡木测试发现,与正常组比较,PD 模型小鼠穿过挑战平衡木的步数、踩踏的错误率及穿越平衡木的时间均显著增多;与PD 模型组比较,SNc 小胶质细胞过表达IL-10 小鼠穿过挑战平衡木的步数、踩踏的错误率以及穿越平衡木的时间均显著增加。综合以上结果表明,SNc 小胶质细胞过表达IL-10 通过抑制PD 模型小鼠SNc 小胶质细胞的活化从而发挥对多巴胺能神经元的神经退变的保护作用,进而在动物行为学水平上改善PD 模型小鼠的运动障碍。本研究提示抑炎因子IL-10 对神经退变的保护作用及神经炎症的抑制作用可望发展成为临床上PD 治疗的新靶点。
