Castleman 病临床诊治分析
2022-09-14顾史洋季丽莉王志梅庄静丽程志祥王伟光承璐雅
顾史洋,魏 征,季丽莉,王志梅,庄静丽,程志祥,王伟光,袁 玲,承璐雅,柯 杨,刘 澎
复旦大学附属中山医院血液科,上海 200032
Castleman 病(Castleman disease, CD)是一组少见的淋巴增生性疾病,2018 年被列入中华人民共和国第一批罕见病目录。CD 的病理特点及发展过程均有异质性。根据受累淋巴结的病理特征,CD 分为透明血管(hyaline vascular,HV)型,浆细胞(plasma cell,PC)型及混合型;根据受累部位,CD 可分为单中心型(UCD)及多中心型(MCD)。UCD 发病率相对较高,但多数患者通过单纯手术治疗可获得长期生存;MCD 异质性高,根据人类疱疹病毒8 型(HHV-8)及HIV 的感染情况,可分为HIV 感染相关MCD、HHV-8 感染相关MCD 及HHV-8 阴性MCD,其中HHV-8 阴性MCD 也称为特发性多中心型CD(iMCD)。iMCD 包括非特指型(iMCD-NOS)及 iMCD-TAFRO 亚型[1-2]。
近 年 来 关 于iMCD 的 研 究 较 多,2018 年Castleman 病协作网(CDCN)发布了首个国际iMCD 治疗共识[3],国内学者亦通过Ⅱ期 RCT 研究探讨其治疗策略[4],推动了iMCD 诊治的进展。本研究分析了本中心近年收治的CD 患者的临床病理特征及其对患者生存的影响,尤其是iMCD 患者的诊治与生存情况,进而为CD 的研究提供临床依据。
1 资料与方法
1.1 一般资料 纳入复旦大学附属中山医院血液科2015 年1 月至2020 年10 月经组织病理学证实的95 例CD 患者,分析其临床、病理特征,实验室检查结果,治疗情况,以及不同亚型患者间的生存差异。本研究经医院伦理委员会批准(B-2017-033R),取得患者知情同意。
入选排除标准:(1)经本院病理科医师诊断或会诊证实为CD;iMCD 除符合组织病理学诊断外,还须满足 2017 年CDCN 标准[3],须同时符合2 条主要标准、2 条次要标准,次要标准中至少有1 条为实验室标准,且排除感染性疾病、自身免疫性疾病、恶性肿瘤或淋巴增殖性疾病等与CD 患者临床表现相似的疾病。(2)患者治疗前后临床资料完整。(3)随访时间不短于3 个月。随访至2021 年2 月,剔除随访过程中失访的患者
1.2 资料采集 (1) 基线临床资料:年龄、性别、病灶最大径,发病时有无B 组症状、脾肿大、浆膜腔积液、骨髓累及、是否符合TAFRO 亚型等。(2)基线实验室指标:血常规、生化、免疫球蛋白、免疫固定电泳、炎症因子、C 反应蛋白(CRP)、白细胞介素6(IL-6)等。(3)病理亚型:HV 型、PC 型和混合型。(4) 患者的治疗方案。(5)患者的生存资料:无进展生存率(PFS)及总生存率(OS)。无进展生存期定义为自治疗之日至任何有书面记录的疾病进展或任何原因导致死亡的时间间隔。总生存期定义为自治疗之日至有书面记录的任何原因导致死亡的时间间隔。
1.3 疗效评价 与淋巴瘤不同,评估iMCD 的疗效时除观察肿大淋巴结是否缩小及缩小程度外,还应观察患者症状改善情况和实验室指标(如CRP、血红蛋白、白蛋白、肌酐)的变化趋势。目前国内外多采用CDCN 在2017 年提出的iMCD疗效评估标准。该标准包括3 个维度:生化、淋巴结和症状改善。其中,症状维度重点关注疲乏、厌食、发热和体质量下降这4 个核心症状。根据这3 个维度,将疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[1]。
1.4 统计学处理 采用SPSS 22.0 进行统计学分析。满足正态分布的连续性变量以表示,2 组间比较采用t 检验,3 组间比较采用one-way ANOVA 检验;不服从正态分布者以M(P25,P75)表示,组间比较采用秩和检验。分类变量以n(%)表示,组间比较采用检验。上述检验均为双侧检验,检验水准(α)为0.05。
2 结 果
2.1 患者基线临床特征 95 例患者均由两名病理科医师确诊为CD,其中HV 型56 例、PC 型24 例、混合型15 例。结果(表1、表2)显示:MCD 组(n=26)患者PC 型比例、临床表现(B 组症状、脾大、浆膜腔积液)发生率、血沉、炎症指标(IgG等)均高于UCD 组(n=69,P<0.05)。
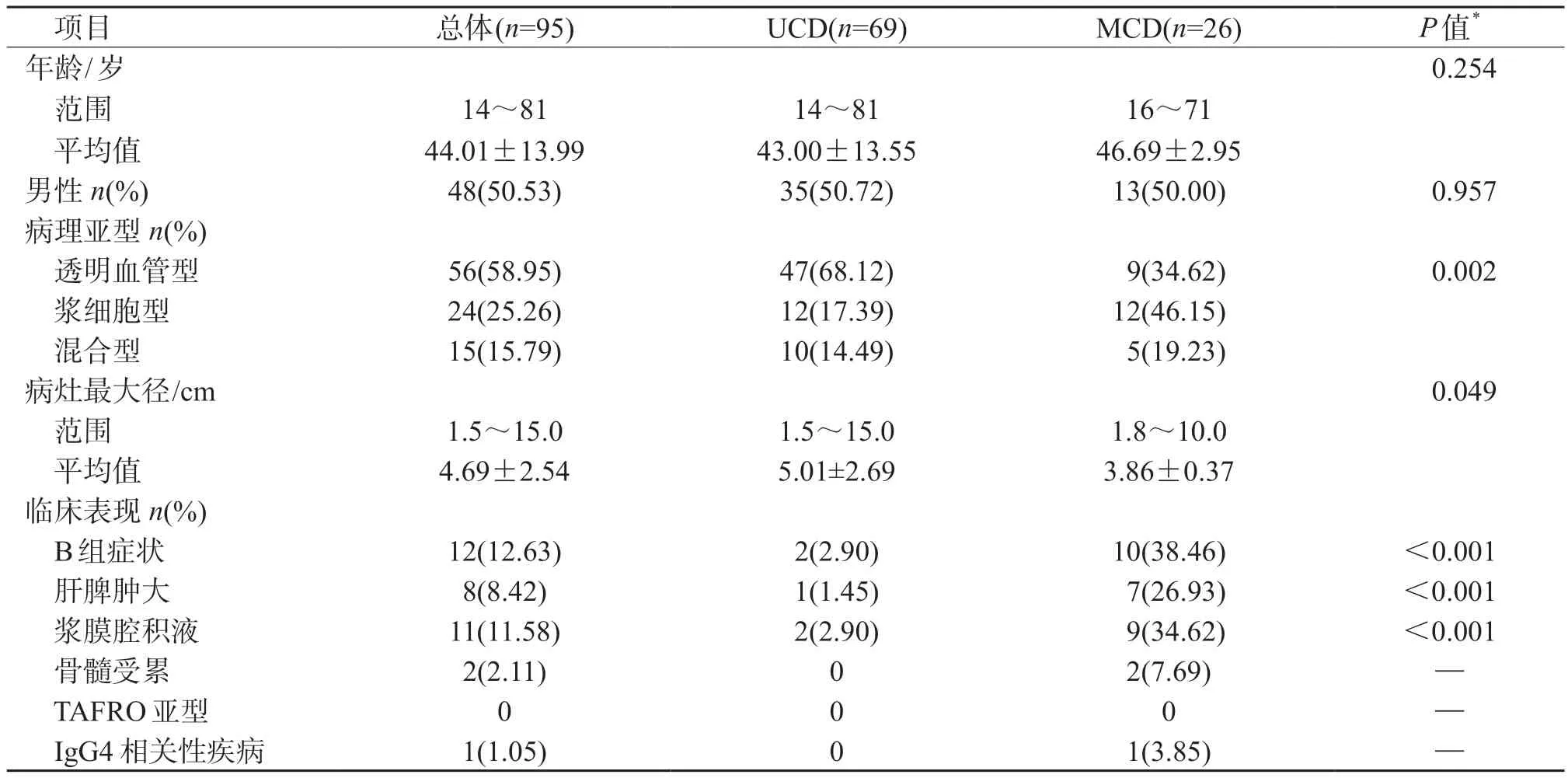
表1 患者基线临床病理资料
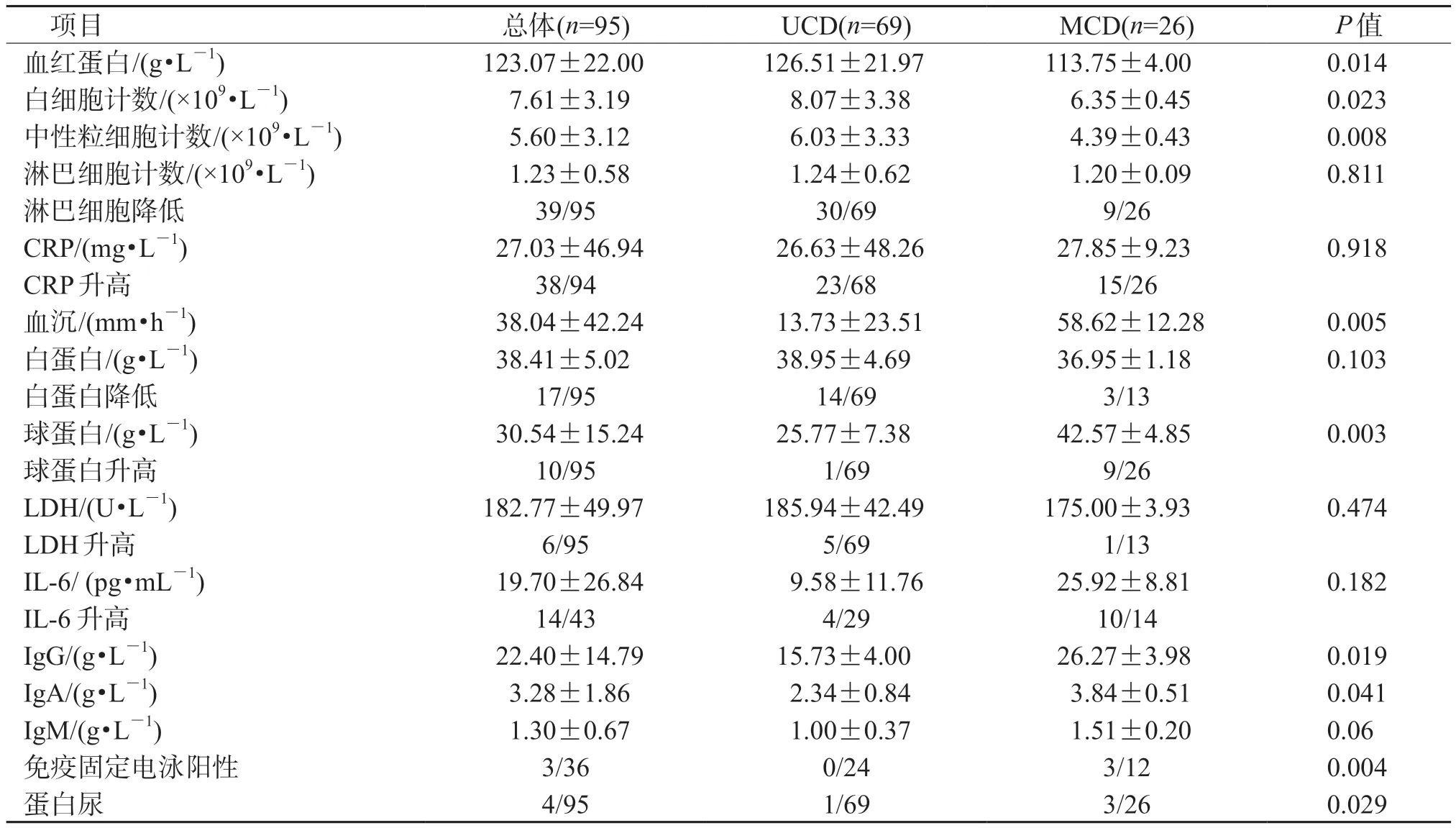
表2 患者基线实验室检查结果
2.2 治疗情况 69 例UCD 患者中,60 例(86.96%)接受外科手术完整切除病灶,余9 例(13.04%)仅行粗针穿刺或部分切除活检。26 例MCD 患者均为HHV-8 阴性,其中21 例(80.71%)患者符合iMCD-NOS 诊断,另5 例(19.23%)患者为无症状性MCD(aMCD),无HHV-8 相关MCD 及iMCD-TAFRO 亚型患者。UCD 及 aMCD 患者未行全身药物治疗。21 例iMCD-NOS 经手术取典型病灶完整切除活检(14 例,66.67%)、部分切除活检(4 例,19.05%)或粗针穿刺活检(3 例,14.29%)证实;结合iMCD 诊断标准明确诊断后,患者均接受激素、免疫调节剂、利妥昔单抗、化疗药物中的一种或多种全身治疗(表3)。
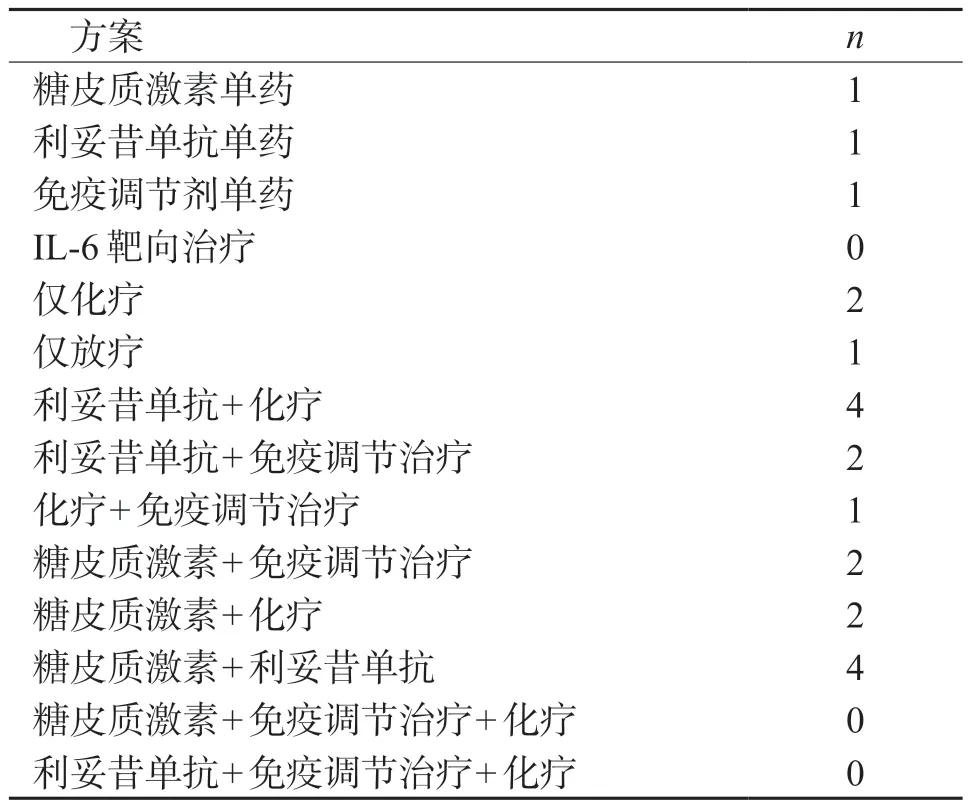
表3 iMCD-NOS 患者药物治疗方案
2.3 疗 效 95 例患者中位随访 39.8(24.2,50.7)个月,失访3 例(均为非iMCD-NOS 患者)。21 例iMCD-NOS 患者中,最佳疗效为CR 1 例、PR 16 例、SD 4 例。手术切除或仅活检且完成随访患者共 71 例,其最佳疗效为CR 60 例、PR 2 例、SD 9 例。
2.4 生 存 随访期内,15 例患者出现疾病进展(PFS 事件),UCD 组2 例、MCD 组13 例;死亡(OS事件)7 例,均为MCD 患者。总体 1 年PFS 为89.2%,预测 3 年PFS 为 78.8%,预测 3 年OS 为92.2%。其中,MCD 患者预测3 年PFS 为52.1%,预测 3 年 OS 为 78.2%,预测 5 年OS 为 70.2%。UCD 患者因生存期长,随访期内PFS 及OS 事件少,未达到预测PFS 及OS 统计学阈值。
3 讨 论
CD 作为一组异质性疾病,病理亚型、病灶数目、基线临床和实验室特征等均影响治疗策略和患者生存。本研究中UCD 及MCD 患者病理亚型分布、病灶最大径、合并症状(B 组症状、肝脾肿大、浆膜腔积液等)以及血红蛋白、炎症指标、免疫指标等差异有统计学意义。本研究中UCD 占72.63%、MCD 占27.37%,MCD 患者中有80.77%(21/26 例)为iMCD。国外文献[5]报道,总体iMCD 占MCD 患者的 33%~58%,但中国人群中该比例达84%。本研究中UCD 中HV 型比例较高,MCD 中PC 型比例较高,与国内外报道[1-2]一致。此外,本研究中患者合并B 组症状、脾大、浆膜腔积液比例较低,可能与本中心患者通过体检筛查发现病变者比例较高,而以出现全身症状首诊比例较低相关。
本研究中,MCD 患者预测5 年OS 为70.2%,优于国内外文献报道(51%~65%)[6-7],可能亦与本研究中患者多通过体检发现病灶,从而诊治较早相关。此外,本研究中,患者发病时的淋巴细胞绝对值多低于正常下限(41.1%,39/95),仅1 例高于正常上限,推测亦可能与炎症通路激活及患者异常免疫状态有关;既往文献未报道CD 患者淋巴细胞减少现象,拟后续进一步扩大样本量分析并进行相关机制研究。
CD 发病假说包括自身免疫/自身炎症假说、副肿瘤综合征假说、病原体假说等,其共同病理生理机制包括IL-6 等炎症因子上调和(或)血管内皮生长因子(VEGF)上调,进而导致过度血管化和(或)多克隆淋巴细胞/浆细胞增生,部分患者可出现全身细胞因子风暴和(或)高炎症状态[1,3,8]。根据上述机制,对于iMCD,可采用IL-6 靶向治疗[9]、利妥昔单抗治疗、免疫调节治疗、激素治疗、化疗等。国内外文献[1,3,9]报道,上述药物单用或联用对iMCD 有一定疗效。司妥昔单抗等新药也显示出较好的疗效及安全性,6 年疾病控制率达97%,患者6 年生存率达100%[9-10]。本研究中,对于UCD 患者及aMCD 患者,未给予全身药物治疗;除3 例失访外,余均接受规律随访,2 例仅接受活检的UCD 患者随访中病灶增大,后续接受病灶完整切除。随访过程中,UCD 患者暂未发生副肿瘤性天疱疮、闭塞性细支气管炎、二发肿瘤(如霍奇金或非霍奇金淋巴瘤)等UCD 常见合并症。5 例aMCD 患者随访过程中病情未进展。对于iMCD,本研究根据专家共识和诊疗路径[3,8],结合患者是否为重型iMCD、具体临床表现、合并症、耐受性等特点,个体化选择药物予以单用或联用,总体疗效较佳,总体反应率(ORR)较高,未发生治疗相关严重不良事件。
综上所述,本研究示CD 患者合并脾大、浆膜腔积液等情况的比例较低;MCD 患者5 年预测OS 优于既往报道。上述现象可能与本中心患者多通过体检筛查发现而非出现明显临床症状后就诊发现(即患者的诊治时间点前移)有关。本研究发现CD 患者常合并淋巴细胞绝对值降低,有待进一步探讨机制。后续须增加样本量、延长随访时间,进一步探讨不同病理亚型CD 患者病理生理机制,以及临床及实验室指标(如有无B 组症状、脾大等“侵袭性”表现,是否为高炎症状态、有无淋巴细胞减少等)对治疗药物选择的指导作用,并选择患者进行司妥昔单抗等新药的组合方案应用及探讨,以提高对该疾病的认识及诊治水平,进而延长患者生存。
利益冲突:所有作者声明不存在利益冲突。
