鉴别蜂蜜真实属性实时荧光PCR法的建立
2022-09-14林碧莲
林碧莲
(福建省产品质量检验研究院,国家加工食品质量监督检验中心(福州),福建 福州 350000)
蜂蜜是蜜蜂从植物的花中采集花蜜后在蜂巢中酿制、加工的天然滋补品。蜂蜜中含有果糖、葡萄糖、氨基酸、维生素、矿物质和有机酸类物质,以及酚类物质等多种营养成分,具有抗衰老、增强免疫力,缓解感冒症状等促进人类健康的作用[1-3],深受广大民众喜爱。我国是世界上最大的蜂蜜生产国和出口国,年产蜂蜜近50万吨,占全球总生产量的27.5%,欧盟、日本、韩国等国是我国蜂蜜重要的出口市场[4]。
在利益的驱使下,不法商家以次充好,以假乱真来谋取巨额利益。掺杂掺假蜂蜜不但会对人体健康造成一定的威胁,而且对蜂农的利益及整个蜂蜜市场产生不良影响。很多蜂蜜掺假物质成分与蜂蜜中的主要成分相似度高,主要是一些糖浆,如高果玉米糖浆、玉米糖浆、麦芽糖浆、蔗糖糖浆、大米糖浆等,这些糖浆主要含有葡萄糖和果糖,葡萄糖和果糖是天然蜂蜜的主要成分,因此掺入这些糖浆后的蜂蜜风味变化较小,具有很大的隐蔽性,使蜂蜜掺假检测技术存在很大的难度[5],据欧洲委员会调查,以外源糖掺假达到6%[6]。现在蜂蜜真伪的鉴别方法主要有感官鉴别法[7]、光谱法[8-10]、气相色谱法[11-13]等,每种方法各有优缺点,如何快速、准确、高效鉴别蜂蜜掺伪,仍是一个技术难点。
传统PCR和实时荧光PCR技术,提供了高特异性的结果,具有低水平交叉污染和减少分析时间的优越性,成功应用于各种源性成分的鉴定,如肉类[14-16]、海鲜[17-19]等动物产品的检测及果汁、果实等植物产品[19-21]的检测。蜂蜜成分复杂,含糖量高,蜜源植物多样性,PCR技术在蜂蜜真实属性的应用上还在试探性阶段。
蜜蜂在采蜜的时候,身上粘有大量花粉粒,这些花粉粒或多或少都会进入蜂蜜里。目前的过滤手段尚不足以将蜂蜜里的花粉完全清除干净。本研究采用实时荧光PCR法对蜂蜜中的花粉DNA进行测试,选用显花植物的显花基因、油菜内源基因、龙眼内源基因的引物探针,从源头上鉴别,同时采用传统感官检测法观察其花粉,比较两种方法的优劣,探讨实时荧光PCR法在蜂蜜真实属性鉴定技术的适用性,可为直接掺假蜂蜜的鉴别提供快速有效的检测法。
1 材料与方法
1.1 材料
14种显花植物:玉米、橙、油菜、紫云英、洋槐、椴树、龙眼、荔枝、菊花、红枣、桂花、荆条、桉树、棉花,4种非显花植物或藻类:野生蕨类植物、苔藓、红藻、紫菜,市售或自备;15份蜂蜜含6份龙眼蜂蜜、6份油菜蜂蜜,3份配料表标蜂蜜的产品,市售或网购,未知来源。
1.2 试剂
2×Taq PCR Mix预混液(上海生工生物工程有限公司);深加工食品DNA提取试剂盒【天根生化科技(北京)有限公司】;乙酸、乙酸酐、硫酸(国药集团化学试剂有限公司);NADH基因、油菜基因和龙眼基因的引物探针选用SN/T 4848.2-2017[22]和SN/T 4848.6-2017[23]的序列,序列见表1,委托上海生工生物工程有限公司合成。

表1 引物探针序列
Tguide S32全自动核酸提取纯化仪(天根生化科技有限公司);ABI 7500荧光PCR仪器(美国Life Tech公司);Mini spin小型离 心机(Eppendorf);IKA MS3 basic涡旋混合器(上海琪特分析仪器有限公司);Steril GARD III Advance生物安全柜(美国贝克公司);JJ1000电子天平(美国双杰兄弟集体有限公司);Ultrospec 2100 pro紫外/可见光分光光度计(美国GE公司);CR22GⅢ落地式冷冻离心机(日本Hitachi KoKi公司)。
1.4 方法
1.4.1 DNA的提取
蜂蜜样品50℃水浴20 min至充分融化,上下颠倒混匀。取20 g蜂蜜到50 mL的离心管中,各2管,加40℃的纯化水30 mL,振荡混匀溶解,4 500 rpm/min 10 min离心,去上清,加1 mL的水溶解沉淀,吸出至2 mL离心管中,4 500 rpm/min 10 min离心,再用纯化水清洗一遍,4 500 rpm/min 10 min离心,去上清,所得沉淀按试剂盒说明提取DNA。
14种显花植物和4种非显花植物或藻类的种子或水果皮、叶子的DNA按试剂盒说明提取DNA。
1.4.2 实时荧光PCR反应
两种实时荧光PCR反应的反应体系总体积25 μL,荧光PCR预混液2×Mix 12.5 μL,模板DNA 3 μL,引物对(各10 μmol/L)各1μL、探针(10μmol/L)0.5μL和ddH2O 7 μL。扩增程序为,95℃预变性5 min;95℃变性15 s,60℃退火60 s,共进行50个循环,每个循环结束后收集荧光信号,CT≤45为阳性。
1.3.3 特异性检测
取14种显花植物的DNA为阳性对照,4种非显花植物或藻类的DNA为阴性对照,水为空白对照,进行NADH基因的扩增;油菜的DNA为阳性对照,13种其它显花植物和4种非显花植物或藻类的DNA作为阴性对照,水作为空白对照,进行油菜基因的扩增;龙眼的DNA为阳性对照,13种其它显花植物和4种非显花植物或藻类的DNA作为阴性对照,水作为空白对照,进行龙眼基因的扩增。
1.4.4 灵敏度检测
提取棉籽的DNA、油菜的DNA、龙眼的DNA用紫外分光光度计检测其浓度,稀释到100 ng/μL作为原液,用纯化水进行梯度稀释,获得浓度分别为10 ng/μL、1ng/μL、0.1 ng/μL、0.01 ng/μL、0.001 ng/μL、0.0001 ng/μL、0.00001 ng/μL的灵敏度分别进行NADH、油菜、龙眼基因的测试,每个梯度两个平行,纯化水作空白对照。
1.4.5 蜂蜜的检测
15份蜂蜜分别采用传统鉴别方法感官法和实时荧光PCR法对其进行检测,比较两种方法的准确性及灵敏度。感官法根据标准GB/T 23194-2008[7]进行蜂蜜中花粉粒的提取、镜检观察:称取均匀蜜样25g,加入约40℃的50 mL蒸馏水,使蜂蜜溶解混匀,以2 000 rpm/min离心10 min,去4/5上清液,加入5 mL乙酸拌匀,浸泡2 h;2 000 rpm/min离心10 min,去1/2上清液,加入新鲜配制的乙酸酐和硫酸的混合液(9+1体积比混合)6 mL,并拌匀,然后将离心管放入90℃水浴中加热7 min;停止加热后,2 000 rpm/min离心10 min,弃去5 mL上清液,加入10 mL蒸馏水混匀离心,如此水洗3次后去上清液,使试样溶液留下约1 mL溶液,进行镜检观察,每张载玻片观察十个视野,两个重复。实时荧光PCR法则提取蜂蜜中的花粉的DNA,测试其浓度和纯度,并采用建立好的三组基因实时荧光PCR法检测,比较两者方法的结果。
2 结果与分析
2.1 三组引物探针特异性的检测结果
18种测试样品提取的DNA浓度在30~180 ng/mL,测试结果证明三组引物探针具有很好的特异性:14种常见蜜源植物的DNA均有检出NADH基因;野生蕨类植物、苔藓、红藻、紫菜提取的DNA均未检测到NADH基因;只有油菜DNA检出油菜基因,其余均未扩增;只有龙眼DNA扩增有曲线,其余均未扩增;空白对照均未扩增,曲线强度高,典型“S”曲线,具体结果见图1-3。

图1 NADH基因引物探针特异性检测扩增曲线
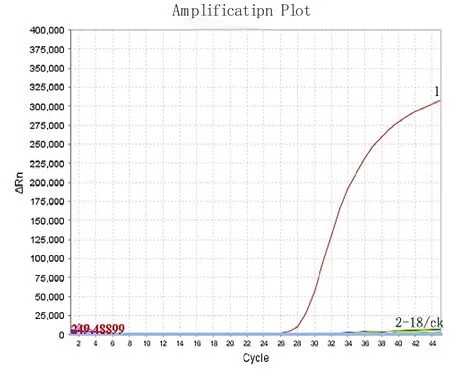
图2 油菜基因引物探针特异性检测扩增曲线
2.2 灵敏度检测结果
棉籽的DNA浓度为100ng/μL、10 ng/μL、1ng/μL、0.1ng/μL、0.01ng/μL、0.001 ng/μL、0.0001 ng/μL、0.00001 ng/μL时NADH基因扩增的曲线CT值分别为17.35、20.82、24.30、28.82、34.12、37.67、41.88和未检出,空白对照(CK)未检出,扩增曲线见图4。图4中曲线1为100 ng/μL,曲线2为10 ng/μL,曲线3为1 ng/μL曲线4为0.1 ng/μL曲 线5为0.01 ng/μL,曲 线6为0.001 ng/μL,曲线7为0.0001 ng/μL,曲线8为0.000 01 ng/μL,CK为 空 白 对 照,(图5-6相同)。油菜的DNA浓度为100 ng/μL、10 ng/μL、1 ng/μL、0.1 ng/μL、0.01 ng/μL、0.001 ng/μL、0.0001 ng/μL、0.000 01 ng/μL时油菜基因扩增的曲线CT值分别为22.02、25.48、29.32、32.14、35.96、未检出、未检出和未检出,空白对照(CK)未检出,扩增曲线见图5;龙眼的DNA浓度为100 ng/μL、1 0 ng/μL、1 ng/μL、0.1 ng/μL、0.01 ng/μL、0.001 ng/μL、0.0001 ng/μL、0.00001 ng/μL时油菜基因扩增的曲线CT值分别为22.08、25.96、29.32、33.92、未检出、未检出、未检出和未检出,空白对照(CK)未检出,扩增曲线见图6;所以三组引物探针灵敏 度 分 别 为0.0001 ng/μL、0.01 ng/μL、0.1 ng/μL。

图3 龙眼基因引物探针特异性检测扩增曲线

图4 NADH基因引物探针灵敏度测试扩增曲线
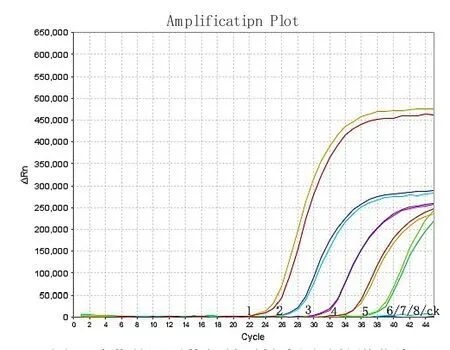
图5 油菜基因引物探针灵敏度测试扩增曲线

图6 龙眼基因引物探针灵敏度测试扩增曲线
2.3 蜂蜜的检测
根据标准GB/T 23194-2008进行花粉粒的提取、镜检,计数10个视野中的花粉粒,结果为15份市售蜂蜜样品中有1份样品未观察到花粉粒,另外14份蜂蜜样品中镜检视野中的花粉粒数量差异很大,形态各异,大部分为圆形或椭圆形,因经验不足,无法鉴定为何种花粉。提取这16份蜂蜜的花粉DNA,DNA浓度与花粉粒的数量成正比,DNA提取纯度测试结果为:260/280值只有两份样品低于1.7,表明DNA中蛋白质、多酚的残余量非常少,但有6份样品的值大于1.9,表明可能污染有RNA;而260/230值只有1份样品高于2.0,表明大部分样品的DNA残存有盐或其它小分子杂质[24]。将提取的DNA进行NADH基因实时荧光PCR检测,结果为15份样品有扩增曲线,一份样品未检出,该样品镜检10个视野的花粉粒中计数为0,其它样品实时荧光PCR检测的CT值与花粉粒数目呈正相关。15份蜂蜜内参基因的实时荧光PCR检测法结果与传统感官检测法的结果一致;将6份龙眼蜂蜜和3份未知配料蜂蜜进行龙眼基因的检测,只有3份检出龙眼源性成分;将6份油菜蜂蜜和3份未知配料蜂蜜进行油菜基因的检测,结果有7份样品检出油菜源性成分,具体实验数据见表2。

表2 16份市售蜂蜜的花粉粒计数及实时荧光PCR检测结果
3 讨论
蜂蜜掺假降低了蜂蜜的质量,降低了蜂蜜的市场价值,降低了消费者的信任度,需严厉打击掺假掺杂行为,也说明研究不同的蜂蜜掺假方法、掺假物质和相对应检测方法的重要性。
近年来,国内外学者开始尝试使用PCR技术来检测蜂蜜的掺杂掺假,如Sg A等人用传统和实时荧光定量PCR技术对蜂蜜中米糖蜜进行定量检测,表明DNA技术可以用于蜂蜜中米糖浆的检测[25],马丽等人采用多重实时荧光PCR鉴定麦卢卡蜂蜜,确定该方法可在麦卢卡蜂蜜真实属性检测中推广使用[26]。PCR技术在蜂蜜掺假的检测领域将越来越得到重视,以蜂蜜中的花粉为研究对象,检测蜂蜜是否含有花粉DNA来鉴别蜂蜜,具有操作简单、灵敏度高、结果直观的优点。
蜂蜜本身不含植物DNA,提取蜂蜜的DNA其实提取的是蜜蜂采蜜过程中带入的花粉粒DNA。在过去的几十年里,花粉鉴别法一直是蜂蜜中最常见的鉴别方法,需要在显微镜下观察花粉,在很大程度上,需要依靠专家的能力和判断力,采用实时荧光PCR技术只需熟练的仪器操作技术,就能得到直观的结果分析;花粉鉴别法采用化学试剂乙酸、乙酸酐和硫酸处理蜂蜜,去掉蜂蜜中的糖分和杂质获得较纯的花粉,这三种试剂均会挥发,吸入后对鼻、喉和呼吸道有刺激性,对眼睛有强烈刺激作用,甚至可能诱发慢性咽炎、鼻炎和支气管炎等疾病的发生,相比,实时荧光PCR技术从DNA提取到PCR扩增采用较温和的试剂,且主要是仪器密闭运行,安全系数高。
蜜蜂采集的蜜源植物非常广,所有的显花植物都有可能是它们的采蜜对象,因此本研究寻找显花植物的共有基因NADH,检测蜂蜜中是否含有花粉来判断蜂蜜的真假。蜂蜜提取的DNA浓度、实时荧光PCR检测CT值与花粉粒数目呈正相关,由于蜂蜜中糖分含量大,成分复杂,DNA纯度一般,提取方法有待进一步优化。
15份蜂蜜样品中有一份样品镜检和内参基因NADH实时荧光PCR检测结果均为阴性,直接掺假率高达6.67%;6份龙眼蜂蜜中只有3份检出龙眼内源基因,未检出有可能是龙眼花粉粒过少,低于龙眼检出限,也有可能蜂蜜中的花粉不是龙眼,有作假嫌疑。本次购买的蜂蜜价格比较便宜,有些甚至是市面上三无产品,检出率比较高。
4 结论
NADH基因检测蜂蜜中有无显花植物花粉,判断蜂蜜是否真的含花粉蜂蜜;油菜基因和龙眼基因检测单花蜂蜜中是否含有油菜花粉和龙眼花粉,判断蜂蜜是否为真的油菜蜂蜜和龙眼蜂蜜。三组实时荧光PCR体系特异性强,灵敏度高,且方法安全性好、操作简单、结果直观。能够鉴别完全掺假蜂蜜,可应用于蜂蜜的真实性检测。
