光强和温度变化对曲浒苔光合作用的调节机制
2022-09-13查敏俊周玲洁蔡春尔何培民
查敏俊 周玲洁 蔡春尔, 董 傲 何培民,
(1. 上海海洋大学海洋生态与环境学院,上海 201306;2. 上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
浒苔属常生活在潮间带的岩石与石沼中,有时也会附着在船体或者水产养殖网箱上[1,2]。作为近海生长的绿藻,浒苔受到人们广泛关注与研究源于由其引起的海洋自然灾害——绿潮。20世纪70、80年代,欧洲部分海域就出现绿潮暴发的现象[3,4]。目前绿潮暴发更是早已成为世界沿海各国普遍发生的海洋环境问题。绿潮除了影响当地的自然景观和旅游业,对生态环境的影响也不可小觑。大量的绿藻在生长过程中,会快速消耗海水中的养分,并且遮蔽阳光,严重影响底栖生物的生长,容易打破沿岸生态环境平衡。
目前已知的浒苔属约有40种,在中国常见的有浒苔、扁浒苔、曲浒苔、缘管浒苔和肠浒苔等[5]。曲浒苔(Ulva flexuosa)是浒苔属中的一类,也是黄海绿潮的组成种,与同属的浒苔类似,曲浒苔多生长于潮间带,生活的环境较为复杂,虽常受到各种非生物因子的影响,但对多种生态因子的胁迫条件的耐受范围较大[6]。
目前对于绿潮暴发的原因,还未有一个统一的结论,但大致可分为环境因素和绿潮生物自身的原因。排放的污染物造成水体富营养化,气候变暖等环境因素为其营造了较为合适的生存环境[7],大部分绿潮生物具有强大的繁殖能力并且对光照、温度等生态因子具有较高的耐受度。这些因素都为绿潮的暴发提供了条件。
曲浒苔的生长与繁殖需要有机物的积累,高效的有机物积累能力是其暴发的内因。其通过光合作用将无机物转化为有机物,光强和温度是对植物体光合作用影响较为明显的生态因子。因此本实验采用转录组测序技术对曲浒苔进行测序,研究在不同光照与温度下参与光合作用的结构蛋白及酶相关基因的表达水平,从而对曲浒苔光合作用系统的环境响应情况进行系统地分析。
1 材料与方法
1.1 材料
实验材料为2008年7月青岛(东经120°19′,北纬36°04′)的曲浒苔,采集的曲浒苔用海水反复洗涤后,在阴凉处干燥至含水量为30%—40%。在4℃下送至实验室,选择健康的单株藻类,用无菌海水清洗15min,去除表面附着物后培养[8]。培养条件为其最适生长条件[9]: 温度(25±1)℃,光照强度100 μmol/(m2·s)。光照周期均为12L∶12D,培养基为VSE(Ott 1965)。
1.2 实验设计
将传代培养后的曲浒苔取相同质量(5 g)鲜重的藻体,高温、中温和低温(30℃、25℃和4℃)3个梯度与高光、中光和低光[400、100 和20 μmol/(m2·s)]3个梯度,共分为9组分别进行处理(每组3个平行)。30℃下400、100 和20 μmol/(m2·s)编号为Q1、Q2和Q3,依照以上编号至Q9(表1)。
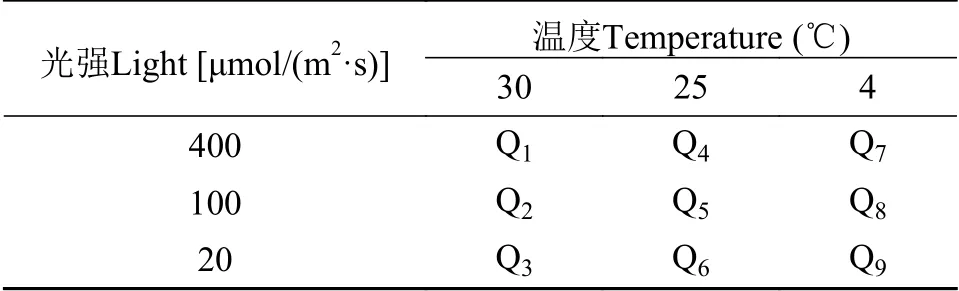
表1 实验组编号Tab. 1 Experimental group number
1.3 总RNA提取与质控检测
在提取样品RNA的同时将DNase I加入以消化DNA,然后通过含有Oligo(dT)的磁珠将真核mRNA富集;之后在Thermomixer中适当温度下打断,所得mRNA作为模板来反转录成cDNA第一链,进一步合成第二链;而后通过试剂盒来纯化回收,黏性末端修复;cDNA3′末端加上一个碱基“A”再将接头连接,之后对片段大小进行选择,PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后,使用Illumina HiSeQ 2000进行测序[10]。
1.4 数据分析方法
通过短reads组装软件Trinity,Trinty组装获得的Unigene序列将Unigene序列与蛋白数据库NR、Swiss-Prot、KEGG和COG进行blastx比对(Evalue<0.00001),取比对结果最匹配的蛋白确定Unigene的序列方向。从已注释的Unigene中筛选出光合作用相关的基因,包括从原初反应到电子传递,光合磷酸化,最终到碳的同化,对曲浒苔的光合作用系统进行全面地分析。各实验组基因表达量与Q5[25℃、100 μmol/(m2·s)]最佳条件组进行对比,揭示光强与温度对曲浒苔光合作用相关基因的诱导表达情况。Unigene表达量的计算使用FPKM法(Fragments Per kb per Million fragments)。其计算公式为:
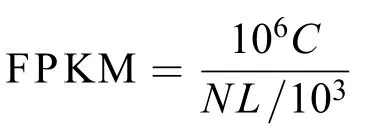
式中,FPKM(A)为Unigene A的表达量,则C为唯一比对到Unigene A的fragments数,N为唯一比对到所有Unigene的总fragments数,L为Unigene A的碱基数。通过FPKM法计算获得的基因表达量可以直接对不同样本间基因表达量进行比较。文中的差异表达基因筛选条件为FDR≤0.001,|log2Ratio|≥1,P-value<0.005。若log2(Q1_FPKM/Q5_FPKM)>0,为上调;反之为下调,其他组以此类推。
1.5 光合荧光参数测定
选取较为极端的实验组Q1、Q9与对照组Q5通过DUAL-PAM-100进行光合荧光参数测定。采用SPSS 25对实验结果进行处理,利用单因素ANOVA检验,Duncan法多重比较,图表中数据为平均值±标准差。利用OriginPro 2021制图。
2 结果
2.1 转录组测序结果
通过Illumina HiseQ 2000平台测序,总计产出42536762640 nt数据。组装后含Unigene 85570个,总长110449659 nt,平均长度1291 nt,N50达到2710 nt。所有注释上的Unigene是38459个,其中功能注释到NR、NT、Swiss-Prot、KEGG、COG和GO库的Unigene数目分别是37645、7631、26233、27975、23534和16000。各组差异表达基因表达情况如图1所示。光合作用相关差异基因与差异基因的表达趋势如图1所示。
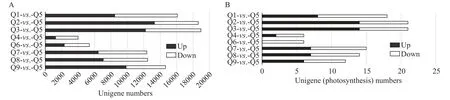
图1 差异表达基因统计图(A)和光合作用相关差异表达基因统计图(B)Fig. 1 Statistics of differentially expressed genes (A) and those related to photosynthesis (B)
2.2 叶绿素合成途径基因表达情况
光合作用的原初反应涉及到众多光系统结构蛋白和光合色素。本文主要关注了两类最为常见的光合色素,叶绿素和类胡萝卜素。光合色素的合成涉及大量的生化反应,通过分析KEGG途径,我们发现与叶绿素a和叶绿素b的合成相关的基因表达量普遍未受到明显影响,仅Q1中与叶绿素a和叶绿素b合成直接相关的叶绿素合成酶的基因表达量下调。这表明高温高光[30℃、400 μmol/(m2·s),下同]对叶绿素合成的影响更大。
2.3 类胡萝卜素合成途径基因表达情况
相对于叶绿素,类胡萝卜素合成相关基因的表达水平变化更为显著,各实验组中涉及类胡萝卜素合成的相关基因部分呈下调,Q1、Q4、Q7与Q8相关基因下调较为明显,而其中Q7下调基因最多,类胡萝卜素合成途径中几乎全部的酶的基因表达下调。这表明光强对类胡萝卜素合成相关基因的影响更大,高光[400 μmol/(m2·s),下同]会抑制其表达,尤其在低温高光[4℃、400 μmol/(m2·s),下同]的环境下。
2.4 聚光复合体基因表达情况
由于聚光复合体Ⅰ与聚光复合体Ⅱ的基因表达水平的变化较为同步,因此以下统一称为聚光复合体。聚光复合体各组分的表达量都发生变化(表2)。从基因类别以及表达量变化的水平来看,Q4和Q6相较于其他组差异最不明显,Q2与Q3上调最为明显,Q7、Q8和Q9上调的基因较多,但上调幅度一般。同一温度下各实验组的聚光复合体基因表达水平无显著波动,但不同温度组对曲浒苔聚光复合体的影响远大于光强对其的影响,且高温(30℃,下同)环境会诱导曲浒苔聚光复合体基因显著上调。而值得注意的是作为高温组的Q1却与低温组Q7、Q8和Q9的聚光复合体上调水平极为一致。
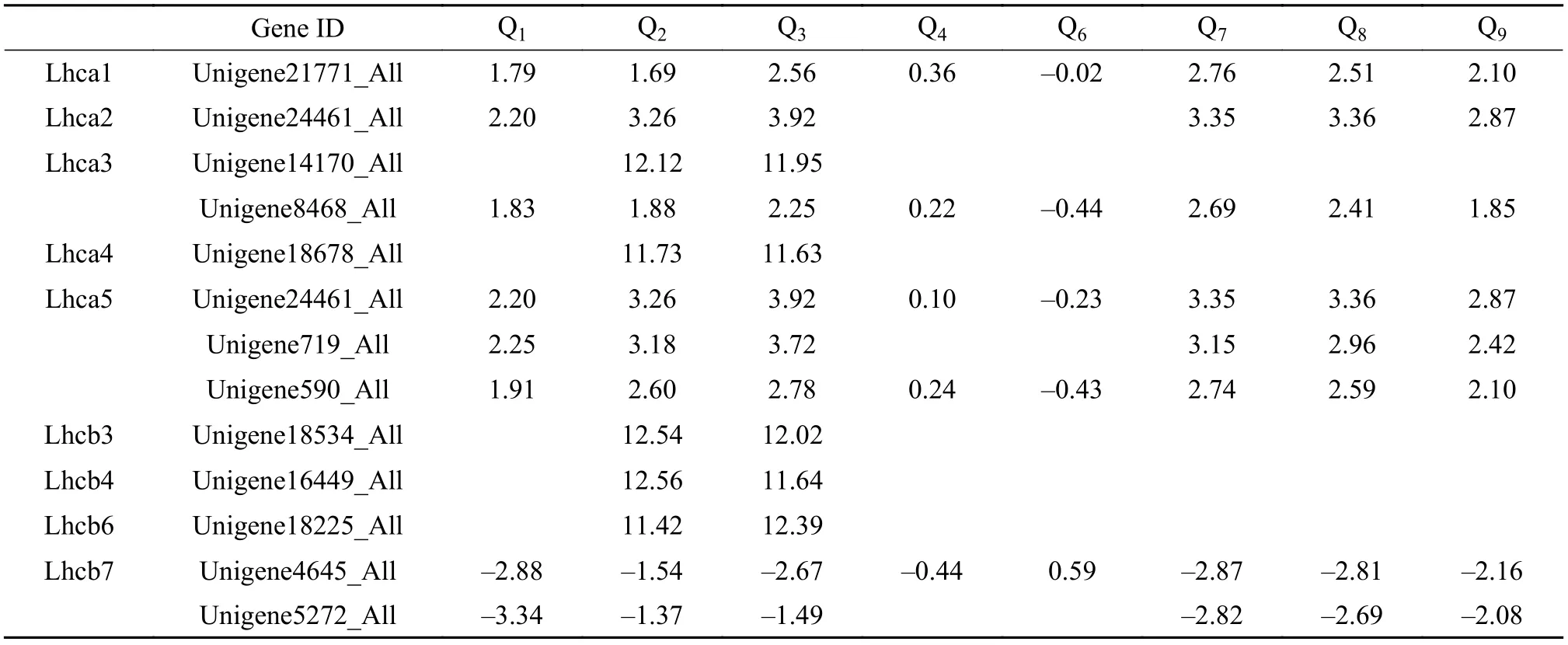
表2 聚光复合体基因表达情况Tab. 2 Expression of light-harvesting complex genes
2.5 光系统基因表达情况
各实验组中光系统Ⅱ反应中心的四个亚基D1、D2、cp43和cp47的基因全部下调,下调水平相差不大,表明对光强和温度的波动均较敏感。Q1、Q2、Q3、Q7和Q8锰稳定蛋白基因表达全部上调,表明其只对温度的波动较敏感。各实验组中光系统Ⅰ反应中心基因表达水平变化较为复杂,不同亚基的基因表达水平变化不同,其中Q2与Q3各亚基基因较为一致地上调,表明受到高温的影响。Q4部分亚基基因下调,表明受到高光的作用,而同时受到高温与高光双重调节的Q1则出现部分基因上调,部分基因下调的情况。其中上调基因与Q2、Q3组较为一致,下调则与Q4组相同,其余实验组该类基因整体表达趋势不明朗。
各实验组中细胞色素b6/f复合物的基因表达为下调,表明对光强和温度的波动均敏感。电子传递链各组分基因表达趋势不明朗。CF1F0-ATP合酶基因表达除Q1无明显变化外,其余各组均呈现出不同程度的下调(表3和图2)。
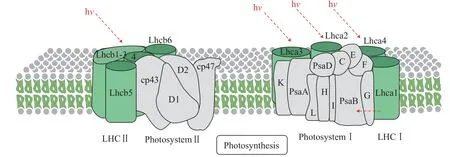
图2 聚光复合体、光系统结构图Fig. 2 Light-harvesting complex,photosystem complex
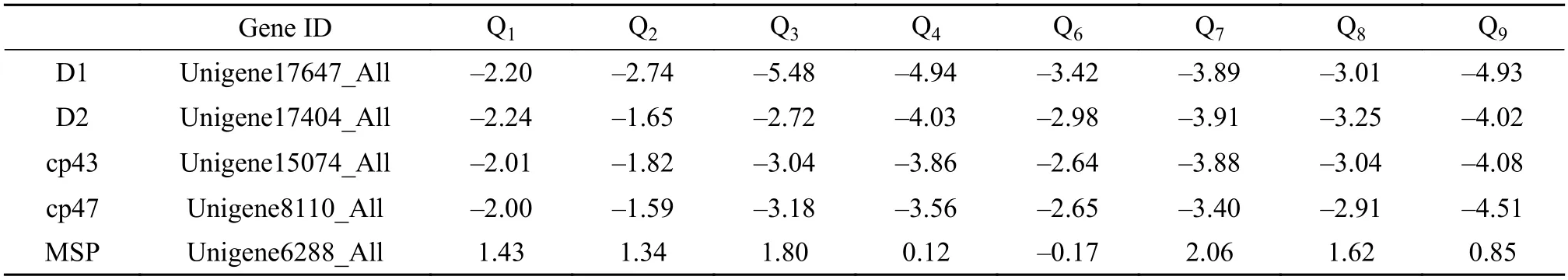
表3 光系统Ⅱ基因表达情况Tab. 3 Expression of photosystem Ⅱ complex genes
2.6 碳固定基因表达情况
碳固定涉及到C3途径与C4途径等,参与的酶种类较多,但变化趋势不一致。本实验针对C3途径与C4途径相关基因研究结果显示,C3途径的变化趋势不明显,同一实验组各基因的变化趋势不一致,对于整个C3途径的影响不明朗。控制核酮糖-1,5-二磷酸羧化酶的众多基因表达不一致。PEPC可催化形成固定CO2的初始分子受体,并且该酶只在中温高光[25℃、400 μmol/(m2·s),下同]的条件下上调,其对温度及光强的耐受范围较窄。PPDK相较于PEPC相关基因对温度与光强具有更好的抵抗能力(表4)。
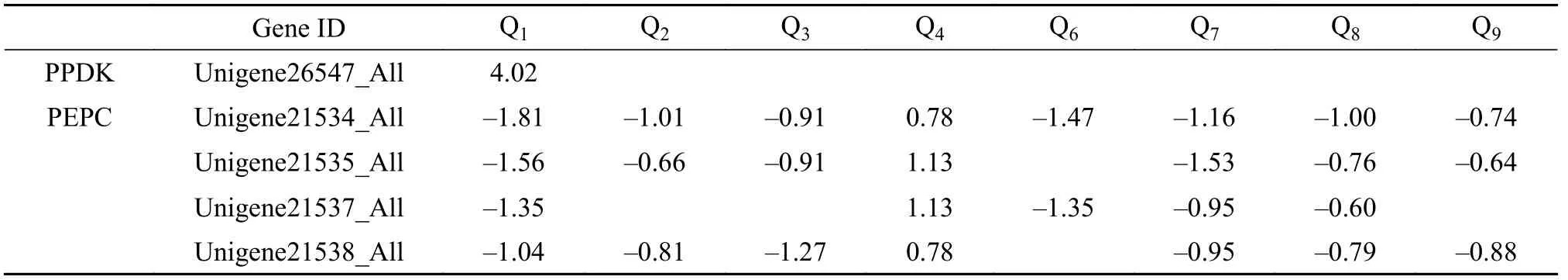
表4 C4途径关键酶相关基因表达情况Tab. 4 Expression of C4 pathway key enzyme genes
2.7 光合荧光参数测定结果
Q1与Q9的Fv/Fm、Y(Ⅱ)与ETRmax远低于Q5。高温高光与低温低光对曲浒苔造成了胁迫,导致曲浒苔光合能力下降,光电子传递效率降低(图3)。
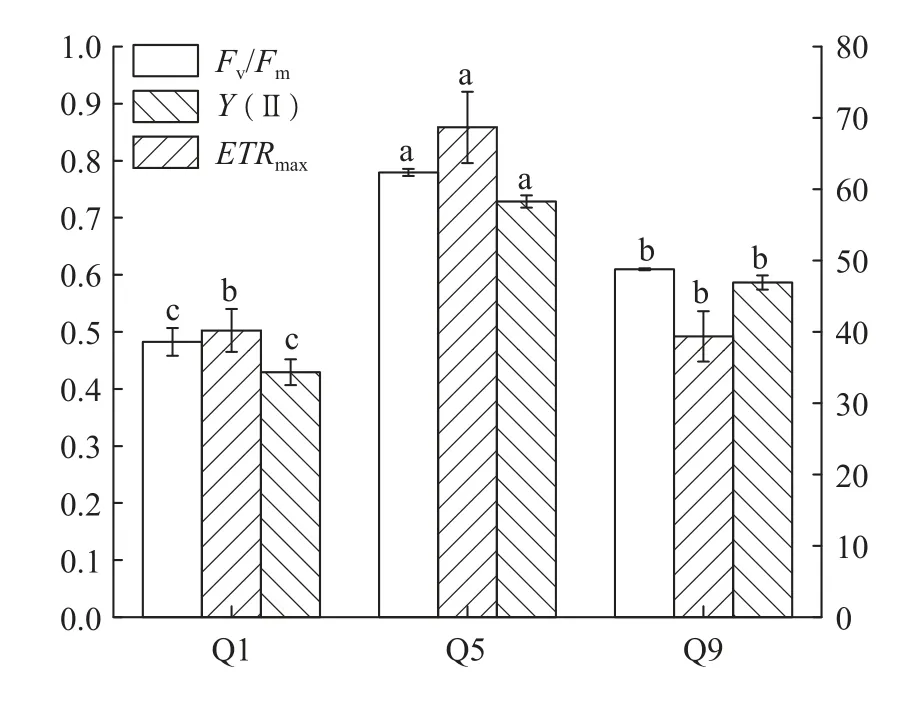
图3 光合荧光参数Fig. 3 Photosynthetic fluorescence parameter
3 讨论
光合作用涉及大量的结构蛋白及参与反应的酶,任何环节的变化都将使整个光合作用的效率发生改变,本实验对曲浒苔的光合作用整个途径进行全面地分析,揭示不同光强与温度对曲浒苔光合作用相关基因的诱导表达情况。
对曲浒苔光合作用相关的差异表达基因的整体表达情况进行分析发现温度对其的影响是显著的。除此之外,作者发现在高温环境下,高光(Q1)对曲浒苔的影响更为显著;在低温环境下,低光(Q9)对其的影响更为显著,这体现在于它们处于同一温度的其他实验组的差异表达基因表达情况。这一特点是有别于其他功能的差异表达基因的。
叶绿素合成相关基因与类胡萝卜素合成相关基因相比具有更好的的耐受能力,叶绿素合成相关基因的表达量虽然也出现一定的波动,但其合成的关键酶,叶绿素合成酶基因只在高温高光条件下发生了下调。这也与Dennison[11]的结果相一致,其研究表明,藻类的光合色素在秋末冬初含量最高,在夏季较低。本实验从基因水平揭示藻类在高温高光两种逆境联合作用下,比单一逆境对其叶绿素合成基因的损伤更大。
类胡萝卜素合成相关基因只要在高光[400 μmol/(m2·s)]条件下就会明显下调,但下调最为严重的实验条件是低温高光,与叶绿素合成酶基因对于温度的偏好刚好相反。类胡萝卜素除了参与光合成外,还可以防止叶绿素受光氧化损伤[12,13]。推测有可能是低温与高光下氧自由基的双重逆境对其表达造成了影响。
聚光复合体基因与光合色素合成基因对于温度与光照的敏感度不同,聚光复合体基因对于温度的变化更为敏感,在同一温度下不同光照强度对其的影响可忽略不计。Q1与Q2和Q3的差异(Q1表达量低于Q2和Q3)可能是由于在高温环境下高光对曲浒苔的聚光复合体基因的抑制作用大于诱导作用,在高光环境下光合作用其他组分如有助于耗散过剩光能的光呼吸系统或PSⅠ系统受损,则曲浒苔通过适当降低聚光复合体表达来降低对光能的吸收,从而降低高光对其的伤害[14]。本实验的Lhcb7基因的表达水平的变化与Koussevitzky等[15]提出一种整合多信号途径的反馈模式相吻合。在此模式下,当叶绿体面临压力时会产生信号,该信号会结合促使ABI4结合到Lhcb的启动子上阻止GBF (光诱导Lhcb表达所必需的组织特异性G框结合因子) 的结合,导致Lhcb表达下调。而在高温中低光环境下Lhcb3、4、6基因出现显著上调,表达水平发生改变说明环境的变化对其产生了压力。值得注意的是,上述3种基因受到环境影响的范围小效果强,其中有可能存在更为精细的反馈调节系统。
在光强和温度调节下各实验组的PSⅡ系统反应中心的4个亚基一致呈现下调,而锰稳定蛋白一致上调。锰稳定蛋白是光合作用放氧复合体的重要组成部分,对水裂解和稳定放氧复合体起关键作用,能提高放氧效率,减少光抑制作用[16,17]。除了对于光合作用的贡献,锰稳定蛋白还参与植物体逆境中的生理调节活动。有报道指出下调锰稳定蛋白的表达量可以诱导植物体显著增强对各种非生物因素的耐受性[18]。差异基因表达较少的Q4与Q6组的锰稳定蛋白表达较低。CF1F0-ATP合酶基因的表达量一定程度上说明了能量合成的效率,该基因表达量除Q1无明显变化外,其余各组该基因呈现出不同程度的下调,在一定程度反映了各组电子传递链的效率。
参与碳固定的C4途径的酶众多。目前已有研究指出,C4途径的关键酶为磷酸烯醇式丙酮酸羧化酶(PEPC)、丙酮酸磷酸双激酶(PPDK)以及核酮糖-1,5-二磷酸羧化酶[19—21]。表达量上调与表达量下调的约各占一半,虽然属于同一种生化途径,但基因对温度光强胁变化的响应结果截然不同。作为C4途径中最重要的两类酶,PEPC基因的表达情况说明,其对温度和光照变化的敏感及耐受能力的一般,只在高光中温的条件下呈现了上调。在白炽灯和/或高强度荧光灯下生长的植物,PEPCase mRNA和蛋白水平都显著增加[22]。本实验结果显示光对曲浒苔PEPC表达的诱导仅在正常温度条件下发生(Q4和Q6)。而正常光照下温度的变化则不会对其表达造成显著影响(Q2和Q8),实验结果与大米中PEPC表达情况相似[23]。PPDK基因的表达量在高温高光双重逆境下表达量上调幅度最显著。虽然这样的结论看似矛盾,但PEPC的表达量变化趋势不明显,对整个C4途径的反应效率影响水平较低,PPDK是C4途径的限速酶,其变化对曲浒苔C4途径的贡献是不可忽视的。高温会直接促进C3植物的光呼吸,由于光呼吸消耗了30%以上的光合作用产物,植物正是为了规避类似的损耗而进化形成了C4途径[24]。且此前已有研究发现高温有助于诱导植物形成C4途径[25],这也与本实验结果中PPDK的表达量变化趋势相互印证。
综合以上所有基因的变化趋势发现(表5),在中温环境下曲浒苔光合作用相关基因表达量的变化幅度最小,说明温度对曲浒苔光合作用基因的影响较大,但曲浒苔对高温高光条件响应最为强烈。从表5中可以看出曲浒苔对温度及光照具有一定的耐受性。曲浒苔在不利环境中调节部分与光合作用相关的基因可能是通过该方式使光合作用效率最大化,同时避免因环境不适造成的自由基积累。
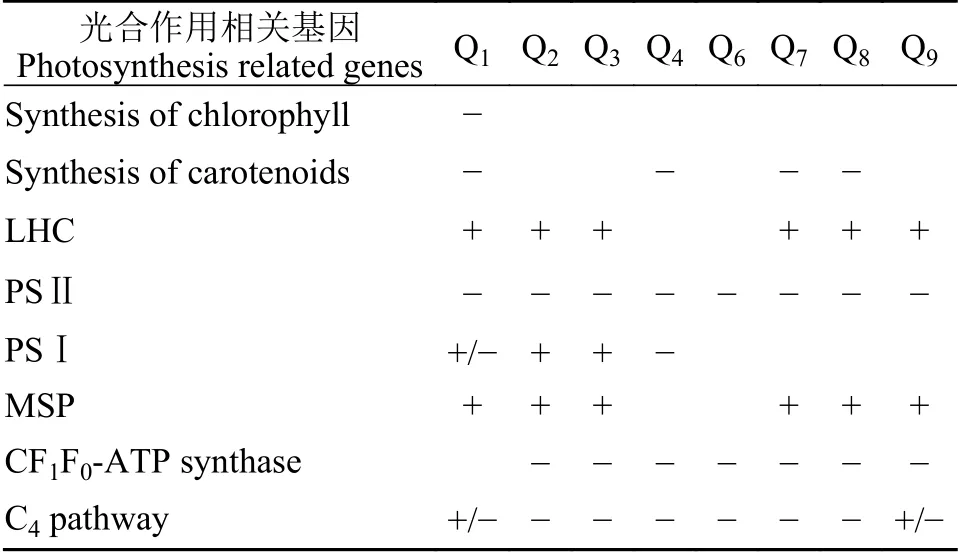
表5 光合作用相关基因表达情况Tab. 5 Expression of photosynthesis related genes
浒苔属的不同种适宜温度范围差异较大。何进等通过比较发现肠浒苔在10—20℃内相对生长率较高。Taylor等[26]和王阳阳等[27]的研究均表明扁浒苔最适生长温度为10℃。曲浒苔为亚热带高温物种,最适生长温度25℃,在我国最早只分布于南海,这是有别于其他习见种的[28]。根据姜鹏等[29]的研究,最近50年中国黄海春季的10—15℃等温线正逐步向北移动,为曲浒苔向北扩展提供了条件;洋流与海风为其提供动力,使其在江苏紫菜筏架上也有大量分布,且在绿潮暴发前期作为优势种存在。这体现了曲浒苔的生长及迁移与温度的变化较为密切。本实验即从基因水平揭示了短期内,于不同温度与光强下曲浒苔光合作用系统的应对机制,有助于准确认识绿藻暴发周期中曲浒苔在不同海域的光温条件下其光合作用系统的应对机制,为深入分析绿潮暴发过程中主要物种生理活动情况提供支持。
