莱茵衣藻BBS8蛋白的原核表达、纯化及多克隆抗体的制备
2022-09-13李文娟樊振川
李文娟 贾 航 薛 斌, 樊振川,
(1. 天津科技大学食品营养与安全国家重点实验室,天津 300457;2. 天津科技大学生物工程学院,天津 300457;3. 天津科技大学大健康生物技术国家国际科技合作基地,天津 300457)
鞭毛(又称纤毛)是突起于大多数真核细胞表面,主要由纤毛膜包裹的轴丝组成。起初研究者认为鞭毛仅具有运动功能,但是越来越多的研究表明,鞭毛在信号传导中也发挥着重要的作用[1]。鞭毛结构异常或功能缺陷会导致一系列先天性疾病的发生,包括巴德-毕德氏综合征(Bardet-Biedl syndrome,BBS)、阿耳斯特雷姆(氏)综合症(Alstrom syndrome)、Meckel-Gruber综合症和Joubert综合症等,这些与鞭毛有关的疾病统称为“纤毛病”[2]。BBS是一种常染色体隐性遗传病[3],能够引发多种疾病,如视网膜变性[4]、肥胖[5]、多指(趾)症[6]及肾功能障碍[7]等。
BBS主要是由于巴德-毕德氏综合征复合物(BBSome)组装缺陷或者功能缺失,导致鞭毛内信号蛋白异常累积或缺失,最终引发相关的疾病[8]。BBSome不参与鞭毛组装,但是其在鞭毛内信号传导中发挥着重要的功能[9],因此阐明BBSome组装及其信号传导机理是攻克BBS疾病的前提。
BBS8也称TTC8,是BBSome的组成成分,具有三角形四肽重复序列(Tetratricopeptide repeat,TPR)。Ansley等[10]首次在沙特阿拉伯和巴基斯坦的家族中出现BBS患者体内发现突变的BBS8蛋白。孙琳等[11]研究发现,莱茵衣藻BBS8蛋白参与鞭毛内膜蛋白运输,但是其详细的分子机制仍待进一步研究。为了深入研究BBS8蛋白功能,需制备一支特异性强的anti-BBS8多克隆抗体。莱茵衣藻是单细胞真核生物,由于其细胞结构简单、生长迅速,其鞭毛可以从细胞体分离下来等优势,常作为国内外研究鞭毛结构、组装及功能的理想模式生物[12]。本研究首先在大肠杆菌中表达莱茵衣藻BBS8蛋白,然后利用纯化后的BBS8蛋白免疫新西兰白兔获得抗血清,对抗血清进行IgG亚型抗体富集和抗原抗体亲和纯化后,获得高特异性的anti-BBS8多克隆抗体,该研究为莱茵衣藻BBS8蛋白功能的研究奠定了材料基础。
1 材料与方法
1.1 实验材料
菌株和质粒大肠杆菌(Escherichia coli)XL1-blue和BL-21(DE3)菌株、莱茵衣藻(Chlamydomo-nas reinhardtii)野生型藻种CC-125、大肠杆菌表达载体pMal-c2x与pET-28a(+)均保存在本实验室;莱茵衣藻BBS8基因突变体(命名为bbs8)由清华大学潘俊敏老师馈赠,该突变体是通过电转化的方法将APHVⅢ片段插入野生型藻种21gr基因组,插入位置在BBS8基因的第5个内含子上,最终形成BBS8蛋白完全缺失突变体[11]。
试剂pfu DNA聚合酶、限制性内切酶、T4 DNA连接酶和DNA Marker购于北京全式金生物技术有限公司;质粒小提试剂盒购自TIANGEN;琼脂糖凝胶DNA回收试剂盒与PCR产物纯化回收试剂盒购自Sangon Biotech;蛋白标志物(Protein Marker,货号26616)购自加拿大Fermentas公司;Protein A SepharoseTMCL-4B(货号17-0780-01)、Ni SepharoseTM6 Fast Flow(货号17-5318-01)、Dextrin SepharoseTMHigh Performance(货号28-9817-80)和CNBr-activated Sepharose 4B(货号17-0981-01)购自美国 GE Healthcare公司;红外荧光素(Alexa Fluor 594)标记的羊抗兔二抗(货号A11012)购自美国Sigma公司提供;辣根过氧化物酶(HRP)标记的羊抗兔/鼠二抗购自美国Jackson公司。
1.2 实验方法
原核表达载体pET-28a(+)-BBS8与pMal-c2x-BBS8的构建BBS8的cDNA基因被送至上海生工生物工程有限公司合成,并且在5′和3′端分别添加EcoRⅠ和HindⅢ酶切位点。BBS8cDNA基因合成后,将BBS8cDNA克隆至大肠杆菌表达载体pET-28a(+)和pMal-c2x,形成新的重组表达载体pET-28a(+)-BBS8和pMal-c2x-BBS8。
蛋白质诱导表达蛋白质诱导表达实验方法参照文献[13]中所述方法进行。将重组表达载体pET-28a(+)-BBS8和pMal-c2x-BBS8转入E.coliBL21细胞,在利用IPTG诱导12—16h。收集菌体,利用超高压破碎仪对菌体超声破碎,收集少量细菌破碎物进行SDS-PAGE电泳分析,确定目标蛋白表达于上清还是沉淀。在蛋白诱导表达过程中,所有培养基都需添加相应抗生素。
蛋白纯化超声破碎菌体后,4℃及12000 r/min离心2min收集沉淀(重组蛋白6×His::BBS8表达于沉淀中),用添加有8 mol/L尿素的结合缓冲液溶解并与1mL Ni SepharoseTM6 Fast Flow填料混匀,室温结合2h。经漂洗后,收集洗脱后的蛋白并对其进行SDS-PAGE电泳分析。MBP::BBS8表达于上清中,超声破碎菌体后将上清液与1 mL Dextrin SepharoseTMHigh Performance填料混匀,4℃过夜结合。用结合缓冲液漂洗填料,后用洗脱缓冲液洗脱填料,收集重组蛋白并对其进行SDS-PAGE电泳分析。
动物免疫将纯化合格的蛋白送至北京华大蛋白质研发中心有限公司进行动物免疫。免疫用兔子是2.0 kg左右的新西兰大白兔;免疫之前在耳静脉取阴性血。初次免疫取400 μg抗原,再加入等体积弗氏完全佐剂并混匀,将混匀好的抗原进行背部皮下注射,打8—10个点。初次免疫14d后,取200 μg抗原,进行加强免疫。加强免疫14d后进行第三次加强免疫。第三次免疫后,耳静脉取血测定效价。若效价达到1∶51200,则颈动脉取血,离心收集抗血清;若效价低于1∶51200,则继续加强免疫。
抗血清效价测定本研究采用间接ELISA法测定抗血清的效价[14],详细实验过程如下。将包被抗原BBS8稀释至10 μg/mL,并以100 μL/孔包被于酶标板。用5%的脱脂牛奶对抗原室温封闭1h,后用PBST清洗液洗板3次,然后加入抗血清室温孵育1h,在孵育结束后,用PBST洗板4次,后加入酶标二抗室温孵育30min。最后加入TMB(3′,3′,5′,5′-四甲基联苯胺)显色液显色,利用酶标仪测定其在OD450处的吸光值。抗血清效价为最大OD值一半时所对应的抗血清稀释倍数。
IgG亚型抗体富集IgG亚型抗体富集参照参考文献[15]所述方法进行,其详细实验过程如下。首先用结合缓冲液(50 mmol/L Tris-HCl,pH 7.0)平衡Protein A纯化株,然后将1 mL抗血清与Protein A纯化株混匀,室温结合1—2h后用结合缓冲液漂洗10次,最后用酸性洗脱液(0.1 mol/L 甘氨酸,pH 2.7)洗脱Protein A填料,收集洗脱下来的抗体加入中和液(1 mol/L Tris-HCl,pH 9.0)保存备用。
抗原抗体亲和纯化抗原抗体亲和纯化实验方法参照文献[16]所述方法进行,详细实验过程如下。称取0.2—0.4 g CNBr-activated Sepharose 4B干粉,加入2 mL 1 mmol/L HCl使其充分溶胀,溶胀大约0.5h后用pH 8.3的结合缓冲液(0.1 mol/L NaHCO3,0.5 mol/L NaCl)平衡。将MBP::BBS8蛋白溶于结合缓冲液中,与溶胀好的CNBr-activated Sepharose 4B于4℃结合过夜。用结合缓冲液漂洗3次,加入pH 8.0的0.1 mol/L Tris-HCl室温封闭2—4h。最后用pH 8.5的100 mmol/L Tris-HCl、0.5 mol/L NaCl和pH 3.5的50 mmol/L甘氨酸、1 mol/L NaCl交替洗脱8次以上。按照上文中IgG亚型抗体富集的方法洗脱抗体,保存备用。
免疫印迹取20 μg野生型CC-125和bbs8突变体藻种的全细胞蛋白提取物进行SDS-PAGE电泳,并将其转移至硝酸纤维素膜上,5%的脱脂奶粉室温封闭2h。封闭结束后添加稀释后的抗体室温孵育1h,用TBST缓冲液(10 mmol/L Tris,pH 7.5,166 mmol/L NaCl,0.05% Tween-20)漂洗3次后,加入HRP标记的二抗,室温孵育1h,TBST缓冲液漂洗3次后,用ECL化学发光显色液曝光。
免疫荧光实验免疫荧光实验方法参照文献[16,17]所示的方法进行,其详细实验方法如下。取对数生长期的野生型CC-125和bbs8突变体细胞并固定到盖玻片上,用封闭液(5%BSA,10%山羊血清,0.3% TritonTMX-100)室温封闭2h。封闭结束后加入稀释后的抗体,室温孵育4h,用50% PBS漂洗10次,然后加入红外荧光素(Alexa Fluor 594)标记的羊抗兔二抗,室温孵育1h,50% PBS漂洗10次后封片,最后在荧光显微镜下拍照留用。
2 结果
2.1 大肠杆菌表达载体pET-28a(+)-BBS8的构建
用EcoRΙ和HindⅢ酶切pET-28a(+)和BBS8cDNA并进行纯化回收,然后将两个片段室温连接1h后转入E.coliXL1-blue细胞中,待长出转化子后,随机挑取两个转化子进行酶切验证。载体经双酶切后,实验结果显示,载体经EcoRI和HindⅢ双酶切后,分别在5和2 kb附近出现两条带并且其大小与pET28a和BBS8的大小一致,酶切验证正确。将酶切验证正确的质粒送至金唯智生物科技有限公司进行测序,测序后结果与Phytozome v13数据库BBS8cDNA参考序列进行比对,连接到载体pET28a上的BBS8cDNA序列与原始参考序列一致,说明载体构建成功并将其命名为pET-28a(+)-BBS8。
2.2 6×His::BBS8重组蛋白诱导表达及纯化
将原核表达载体pET-28a(+)-BBS8转入E.coliBL21细胞中,待长出转化子后,挑取单克隆接种至LBK(LB培养基中加入卡那霉素)进行扩大培养和诱导表达。蛋白表达后经镍柱纯化和SDS-PAGE分析。蛋白经纯化后获得纯度较高的目的蛋白6×His::BBS8(大小约61 kD),经Image J分析后得知,目标蛋白占总蛋白的92.5%,符合公司纯度达到85%的免疫要求,可进行后续免疫。
用纯化合格后的6×His::BBS8融合蛋白进行动物免疫,经3次免疫后,采集少量血清,利用间接ELISA法测定其效价(图1)。按照北京华大蛋白质研发中心的标准,效价为1/2最大OD450值所对应的稀释倍数,由此可知此次所制备的抗血清效价为1∶102400。
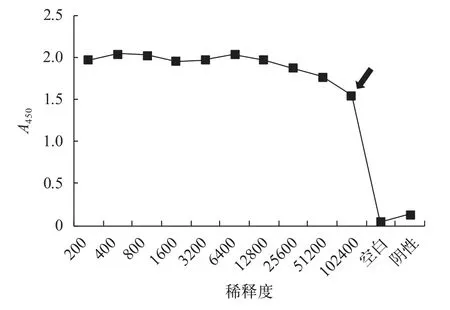
图1 间接ELISA法测定抗血清效价Fig. 1 ELISA test of anti-BBS8 polyclonal antiserum
2.3 BBS8抗体纯化及其特异性检测
IgG亚型抗体富集Protein A是一种金黄色葡萄球菌细胞壁蛋白质,它能够特异性地结合多种免疫球蛋白的Fc区段而与Fab区或轻链结合很弱。因此,本研究首先利用Protein A纯化株对BBS8抗血清IgG进行富集,然后用富集所得到的IgG对野生型CC-125和突变体bbs8的全细胞蛋白提取物进行免疫印迹分析。如图2所示,BBS8抗血清经Protein A富集后,可以识别莱茵衣藻野生型藻种CC-125全细胞蛋白提取物中的内源BBS8蛋白(大小约61 kD),而bbs8突变体中由于缺乏BBS8蛋白,因此未能检测到目标条带。但是Protein A富集后的BBS8抗体仍检测到多条非特异性条带,需要对其进一步地亲和纯化以提高BBS8抗体的特异性。

图2 免疫印迹检测抗体的特异性Fig. 2 The specificity of the antibody
抗原抗体亲和纯化: 原核表达载体pMal-c2x-BBS8的构建本研究制备的抗血清是用6×His标签的BBS8融合蛋白,为避免抗体与6×His标签的非特异性结合,在进行抗原抗体纯化时,使用MBP标签的融合蛋白,为此首先构建原核表达载体pMal-c2x-BBS8。将EcoRI和HindⅢ双酶切后的BBS8cDNA克隆至载体pMal-c2x,经连接和转化后,随机挑取两个转化子进行酶切验证。如图3所示,载体经EcoRI和HindⅢ双酶切后,分别得到与pMalc2x和BBS8大小一致的条带,酶切验证正确。将酶切验证正确的质粒送至金唯智生物科技有限公司进行测序,测序后结果与Phytozome v13数据库BBS8cDNA参考序列进行比对。连接到载体pMalc2x上的BBS8 cDNA序列与原始序列一致,说明载体构建成功并将其命名为pMal-c2x-BBS8。

图3 重组表达载体pMal-c2x-BBS8双酶切验证Fig. 3 Restriction digestion analysis of recombination plasmids
MBP::BBS8蛋白表达与纯化CNBr-activated Sepharose 4B通过溴化氰和琼脂糖上面的羟基反应生成活化的氰酸酯基团,可偶联含有氨基的配体,蛋白质、多肽和氨基酸等可以偶联到CNBr-activated Sepharose 4B琼脂糖凝胶上。本研究是用6×His标签的BBS8融合蛋白免疫新西兰大白兔产生的抗血清,为了提高抗体的特异性,本研究将用MBP标签的BBS8融合蛋白为抗原进行抗原抗体纯化,因此首先需表达MBP::BBS8融合蛋白。将构建好的重组表达载体pMal-c2x-BBS8转入E. coliBL21感受态细胞进行诱导表达,经Dextrin Agarose Resin亲和纯化后,实验结果显示MBP::BBS8融合蛋白(大小约101 kD)表达于上清,且获得较高浓度的MBP::BBS8融合蛋白。
抗原抗体亲和纯化及其特异性检测按上文所述实验方法,将纯化后的MBP::BBS8与CNBractivated Sepharose 4B偶联,然后按照上文所述方法对抗BBS8 IgG进行抗原抗体亲和纯化,收集纯化后的抗体,保留备用。将纯化后的BBS8抗体稀释500倍后,对野生型CC-125和bbs8突变体的全细胞蛋白提取物进行免疫印迹分析。从图4可以看出,纯化后的BBS8抗体可以特异性识别莱茵衣藻野生型CC-125内源性BBS8蛋白,而在bbs8突变体的全细胞蛋白提取物未能检测到BBS8蛋白,并且其特异性明显提高,适合后续进行蛋白功能的研究。

图4 免疫印迹检测抗体的特异性Fig. 4 The specificity of the antibody
2.4 BBS8蛋白在莱茵衣藻细胞中的定位
已有的研究表明,BBSome定位在细胞基体,并且在细胞基体与IFT颗粒组装,从而依赖鞭毛内运输机制(Intraflagellar transport,IFT)输入和输出鞭毛[18,19]。本研究利用纯化的anti-BBS8对野生型CC-125和bbs8进行免疫染色。从图5可以看出,BBS8蛋白在野生型CC-125的细胞基体明显富集,且其分布形状与BBS4[19]和BBS5[18]蛋白在细胞基体处一致。而bbs8突变体的细胞基体和其他部位未看到任何荧光信号,进一步说明本研究制备的anti-BBS8具有较高的特异性。

图5 免疫荧光检测BBS8蛋白在莱茵衣藻细胞中的定位Fig. 5 Immunofluorescence analysis of BBS8 in C. reinhardtii
3 讨论
在哺乳动物和莱茵衣藻细胞中,BBSome不参与鞭毛组装,但是其在信号分子鞭毛内运输中发挥着重要的作用。莱茵衣藻BBSome的单一组分如BBS1、BBS4和BBS7缺失,导致BBSome无法成功组装,从而无法进入鞭毛,但是引起鞭毛内信号蛋白的异常累积(如磷脂酶和AMP激酶)和缺失(如碳酸酐酶6)[20]。孙琳等[11]利用随机插入的方法筛选到一株BBS8蛋白缺失藻种(bbs8突变体),并且作者进一步研究表明bbs8突变体鞭毛内膜蛋白异常累积,说明BBS8在调控鞭毛内膜蛋白运输中发挥着重要的作用,但是其详细的分子机制仍待进一步研究。
特异性高的抗体是蛋白功能的研究前提。本研究利用大肠杆菌原核表达系统诱导表达BBS8蛋白,经纯化后获得纯度为92.5%的蛋白作为抗原进行动物免疫并获得BBS8抗血清,然后对BBS8抗血清进行IgG亚型抗体富集和抗原抗体亲和纯化,最终获得特异性较高的anti-BBS8多克隆抗体。用该抗体对野生型CC-125和bbs8突变体进行免疫荧光染色,可以看到BBS8蛋白在细胞基体富集,这种在细胞内的分布与孙琳等[10]报道一致,而bbs8突变体的细胞基体没有观察到任何信号,进一步证实anti-BBS8在体内具有较高的特异性,且适合用于后续免疫荧光分析。因此,Protein A富集IgG和抗原抗体纯化用于开发后续莱茵衣藻兔源多克隆抗体。在后续抗体测试中,我们将利用该BBS8抗体对莱茵衣藻细胞体和鞭毛进行免疫共沉淀分析,探索其在免疫共沉淀实验中的应用可能。
