日本鳗鲡肠道N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及酶学性质
2022-09-13林建城胡建辉吴钦端
林建城 胡建辉 吴钦端
(莆田学院环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室,生态环境及其信息图谱福建省高等学校重点实验室(莆田学院),莆田 351100)
长期以来对鱼类消化道的消化酶如蛋白酶、脂肪酶和淀粉酶等已有相当多的研究,但对鱼类如何利用和消化含几丁质的食物知之甚少,这一问题近年来逐渐得到学者们的重视[1]。Matsumiya等[2]从大泷六线鱼(Hexagrammos otakii)和日本鲐(Scomber japonicas)胃中分离到几丁质酶,证实了鱼类消化道几丁质酶具有很强的底物专一性,与几丁质的消化生理密切相关;Ikeda等[3]先从白姑鱼(Pennahia argentatus)胃中分离到一种分子量为56 kD的几丁质酶(PaChiB),证明是一种内切型几丁质酶;后从三线矶鲈(Parapristipoma trilineatum)胃中也分离到PtChiA和PtChiB两种几丁质酶同工酶,它们均可从几丁寡糖(GlcNAc)n非还原端的第二和第三糖苷键优先进行降解[4];接着又从褐菖鲉(Sebastiscus marmoratus)胃中提取分离到SmChiA、SmChiB和SmChiC三种几丁质酶同工酶,其中SmChiA和SmChiB可降解几丁寡糖(GlcNAc)n非还原端的第二糖苷键,SmchiC则是优先降解第三糖苷键,认为鱼类消化道含有一种降解几丁质的酶系统,可以有效地降解从食物中摄入的几丁质[5]。而Kawashima等[6]从日本沙丁鱼(Sardinops melanostictus)胃中也分离到分子量为45和56 kD的两种几丁质酶同工酶,并预测了其三维结构模型;相似地,黄金凤等[7]近期研究发现,吉富罗非鱼(Oreochromis niloticus)在前肠和中肠能高表达3种几丁质酶tChit1a、tChi3和tChit,而在胃中表达量很少,推测可能与罗非鱼栖息地是在水体中下层,食性为杂食性、食物中含虾蟹壳较少有关,并认为这些几丁质酶主要功能可能不是降解几丁质。
几丁质酶系包括有内切型和外切型几丁质酶,乙酰-β-D-氨基葡萄糖苷酶(NAGase,EC3.2.1.52)是几丁质酶系组成分之一,具有外切酶性质,可将几丁质外切形成N-乙酰葡萄糖胺单体和几丁寡聚糖[8]。目前对节肢动物NAGase已有不少研究,Kogo等[9]从家蚕(Bombyx mori)表皮层和消化道中获得NAGase,研究表明分布在表皮层的NAGase与其成虫化蛹和蜕皮生长密切相关,而分布在内脏的NAGase主要功能是消化含几丁质的食物,与蜕皮无关;研究结果普遍认为节肢动物外表皮NAGase主要是参与调节周期性蜕皮和新表皮形成的生理过程,而内脏NAGase可能主要是参与消化含几丁质的食物。近年来,鱼类消化道NAGase的功能与性质也逐渐得到关注。Kakizaki等[10]从日本鲐和白姑鱼消化道分离到高活性的内切型几丁质酶和外切型NAGase,发现酶在两种鱼胃中表达有所不同,可能是与鱼食性不同有关;陈晓佳等[11]从尼罗罗非鱼(Oreochromis niloticus)肝脏分离到NAGase,阐明了其酶学性质和功能基团;从此,对鱼类消化道NAGase有了初步认识。
日本鳗鲡(Anguilla japonica)隶属于鳗鲡目鳗鲡科,为降河洄游鱼类,在海水中繁殖、淡水中生长,成鳗主要以鱼、虾、蟹和水生昆虫等水生生物为食,人工饲养下主要摄食的是人工配合饲料,是一种我国重要的淡水养殖鱼类。有报道鳗鲡消化道内存在较高的几丁质酶活力,可以利用含几丁质的食物[12],但对日本鳗鲡外切型NAGase还未有研究。为此,本课题拟从日本鳗鲡肠道中提取分离NAGase,研究其酶学性质和功能基团,并探讨环境因素对鳗鲡消化道NAGase的影响,为进一步阐明鳗鲡消化道几丁质酶系的结构与功能奠定基础。
1 材料与方法
1.1 材料
日本鳗鲡出自莆田市东源水产食品有限公司,挑选体长(43±2) cm的无病害活鳗为试材,解剖取其小肠部分,剔除肝脏、表面分布的脂肪等附着物,无离子水清洗后沥干,每样品袋装入1条鳗鲡的小肠,冻藏待用。
NAGase底物为对硝基苯-N-乙酰-β-D-氨基葡萄糖苷(pNP-β-D-GlcNAc),系上海医药工业研究院生化室产品,分离纯化使用的Sephadex G-100是Pharmacia产品,DEAE-32系Whatman分装,牛血清蛋白为标准蛋白,电泳使用的低分子量标准蛋白(Phosphorylase b 98.0 kD、牛血清白蛋白BSA 66.0 kD、Egg Albumin 47.0 kD、Carbonic Anhydrase 30.0 kD、Trypsin Inhibitor 22.0 kD和α-Lactabumin 14.4 kD)由天根生化科技有限公司出品。化学修饰剂对氯汞苯甲酸(pCMB)和苯甲基磺酰氟(PMSF)是Sigma产品;乙酸酐(AcAn)、三硝基苯磺酸(TNBS)、二巯基苏糖醇(DTT)、乙酰丙酮(AcAc)、溴代乙酸(BrAc)、N-溴代琥珀酰亚胺(NBS)及金属化合物等药品均为国产分析纯。
1.2 方法
日本鳗鲡肠道NAGase的提取与分离随机取3个样品袋,小肠解冻后切成1 cm小段,共取样100 g,加入300 mL预冷的0.01 mol/L Tris-HCl缓冲液(pH 7.4),10000 r/min下捣碎匀浆1min,4℃抽提4h以上,20000×g冷冻离心30min,取上清液。依次采用35%,75%饱和度硫酸铵分级分离酶蛋白,收集沉淀物,透析后冷冻离心(25000×g) 30min,得粗酶制剂。先经过Sephadex G-100分子筛凝胶柱(柱规格为2.6 cm×60 cm)层析分离,洗脱液是0.01 mol/L Tris-HCl缓冲液(pH 7.4,含0.2 mol/L NaCl),流速为0.4 mL/min,自动部分收集器收集流出液,按每管4 mL收集,收集110管,集中酶活力峰周围的收集管,收集酶液,并继续用于DEAE-32离子交换柱(柱规格为1.6 cm×40 cm)层析,同样的缓冲液洗脱,内含NaCl (0—1.0 mol/L)直线梯度洗脱,流速为0.25 mL/min,每管收集5 mL,收集酶活力峰的洗脱酶液,透析后用于酶蛋白的纯度鉴定和酶学性质研究。采用Bradford[13]的方法测定收集液的蛋白浓度,以牛血清蛋白为标准蛋白,结果以A280表示。
日本鳗鲡NAGase纯度鉴定采用聚丙烯酰胺凝胶电泳(PAGE)和SDS-PAGE鉴定酶纯度,分离胶和浓缩胶浓度分别为 10和3.75,考马斯亮蓝R250染色。
日本鳗鲡NAGase相对分子质量的测定从SDS-PAGE电泳图谱测定NAGase蛋白亚基相对分子质量,以各标准蛋白的迁移率(变量x)对相应分子质量的对数(变量y)作图,从样品的相对迁移率求出酶蛋白亚基的相对分子质量。
日本鳗鲡NAGase等电点的测定参照文献[14]方法,采用等电点聚焦电泳分离法测定NAGase等电点。
日本鳗鲡NAGase活力测定体系NAGsae活力测定参照文献[14]的方法进行。2 mL的测活体系包含有: 5 mmol/L底物0.2 mL、75 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 6.0) 1.0 mL、dd H2O 0.78 mL,37℃预保温10 min后,加入浓度为0.111 mg/mL的NAGsae纯酶制剂20 μL,此条件下催化反应10min,以0.5 mol/L氢氧化钠(NaOH)终止反应,在405 nm波长下测定反应液的光吸收值A405,设立空白对照组,在此测活体系中测定NAGase活力,对其酶学性质进行研究。
1个酶活力单位(U)定义为: 每min催化水解产生1 μmol/L对硝基苯酚(pNP)所需要的酶量。比活力单位为U/mg。
pH对日本鳗鲡NAGase活力的影响在NAGase活力测定体系中,测定不同pH3.2—10.0下的NAGase活力,其中pH 3.2—5.8选择醋酸-醋酸钠缓冲液,pH 5.8—8.0使用NaH2PO4-Na2HPO4缓冲液,pH 9.0—10.0采用硼砂-NaOH缓冲液,根据不同酸碱度下测定的NAGase活力,确定酶的最适pH;再将NAGsae纯酶制剂(0.111 mg/mL)分别与各种不同pH(pH 3.2—10.0)的缓冲液等量混合,在4℃下孵育1h,取出20 μL处理过的酶制剂,分别加入已在37℃中预保温10min的反应体系(含5 mmol/L底物0.2 mL,75 mmol/L pH 6.0的Na2HPO4-NaH2PO4缓冲液1.0 mL,dd H2O 0.78 mL)中,催化反应10min,分别测定剩余酶活力,计算各试验组的相对酶活力(%),分析NAGsae的酸碱稳定性。
温度对日本鳗鲡NAGsae活力的影响在测活体系中,检测不同温度(20—90℃)下NAGsae的活力,酶活力最大的试验温度确定为NAGsae的最适温度;再将NAGsae纯酶制剂(0.111 mg/mL)置于各种不同温度(4—90℃)下分别处理1h,取出20 μL处理过的酶制剂,分别加入已在37℃中预保温10min的反应体系(含5 mmol/L底物0.2 mL,75 mmol/L pH 6.0的Na2HPO4-NaH2PO4缓冲液1.0 mL,dd H2O 0.78 mL)中,催化反应10min后检测其剩余酶活力,计算各试验组的相对酶活力(%),确定NAGsae的温度稳定性范围。
日本鳗鲡NAGase酶促反应动力学参数的测定在测活体系中,仅仅改变底物浓度([S]范围:0.15—1.5 mmol/mL),测定不同底物浓度下的NAGase活力(以表示酶促反应速度v),以1/v对1/[S]作图,利用Lineweaver-Burk作图法求出酶的米氏常数(Km)和最大反应速度(Vmax)值。
金属离子对日本鳗鲡NAGase活力的影响在测活体系中,先分别加入终浓度均为10 mmol/L的NaCl、NaNO3、Na2SO4和Li2SO4,测定NAGase活力,探讨Na+、Li+、Cl-、NO3-和SO42-对NAGase的影响;再分别加入MgSO4、CaCl2、BaCl2、Cu2SO4、ZnSO4、FeSO4和FeCl3,终浓度均为0.5 mmol/L,以及分别加入0.1 mmol/L MnCl2、1 mmol/L Pb(NO3)2和1 μmol/L HgCl2,测定不同金属离子作用下的NAGase活力,以相对酶活力(%)表示,分析金属离子对日本鳗鲡NAGsae活力的影响。
日本鳗鲡NAGsae酶蛋白的化学修饰NAGsae的修饰方法以及修饰酶活力测定方法参照文献[15]。采用AcAc、pCMB、BrAc、PMSF和NBS分别作为酶蛋白精氨酸(Arg)胍基,半胱氨酸(Cys)巯基、组氨酸(His)咪唑基、丝氨酸(Ser)羟基和色氨酸(Trp)吲哚基的修饰剂,DTT为酶蛋白中二硫键的修饰剂,AcAn为酶蛋白氨基、TNBS为赖氨酸(Lys)ε-氨基的修饰剂。将纯酶分别与8种不同修饰剂以1∶3体积混合修饰30min,在NAGsae测活体系中测定各修饰酶的活力,设定未修饰酶活力为100%,测定修饰酶的相对酶活力(%),研究不同修饰剂对酶的修饰效应。
2 结果
2.1 日本鳗鲡肠道NAGase的提取与分离
日本鳗鲡肠道NAGsae粗酶制剂经过葡聚糖凝胶柱层析分离,从层析图谱(图1a)可知,获得了3个蛋白峰,只有第2个小蛋白峰的区间具有NAGase活性,将收集到的酶制剂经DEAE-32纤维素离子交换柱层析,从层析图谱(图1b)可见2个蛋白峰,仅仅第1个蛋白峰区间具有NAGase活性,收集酶活力峰周围的酶液,获得酶比活力为2517.40 U/mg,得率为54.99%,纯化倍数为27.71的NAGase酶制剂;进一步分析分离纯化方案,结果(表1)显示,分离纯化期间NAGase比活力和纯化倍数得到不断升高,酶得率缓慢下降,最后获得的酶制剂纯度大、得率高,说明该纯化方案简单又高效。
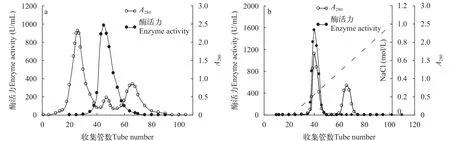
图1 日本鳗鲡肠道NAGase的Sephadex G-100(a)和DEAE-32(b)柱层析图谱Fig. 1 Column chromatography of NAGase from intestine of Anguilla japonica on Sephadex G-100 column (a) and DEAE-cellulose (b)

表1 日本鳗鲡肠道NAGase的分离纯化Tab. 1 Purification of NAGase from intestine of Anguilla japonica
将纯化的NAGase酶制剂经PAGE和SDSPAGE电泳鉴定,从图2可知两种电泳的结果均只有单一蛋白带,可判断NAGase酶制剂已达到电泳纯;进一步以图2b中各标准蛋白的迁移率(变量x)对相应分子质量的对数(变量y)作图,回归一直线方程为:y=-1.646x+5.207,求得NAGase酶蛋白亚基的相对分子质量为69.98 kD;将纯酶经等电点聚焦电泳,测得日本鳗鲡NAGase等电点pI为4.98。

图2 日本鳗鲡NAGase的PAGE(a)及SDS-PAGE(b)电泳图谱Fig. 2 PAGE (lane a) and SDS -PAGE (lane b) of the purified NAGase from intestine of Anguilla japonica (Mw molecular weight standard)
2.2 pH对日本鳗鲡NAGase活力的影响
日本鳗鲡NAGase最适pH为6.0(图3a),pH偏离6.0越大,NAGase活力越小;NAGase在pH 4.8—7.2区域内相对稳定,在pH 9.0环境中酶活力仅剩余34.9%,在pH 4.0以下偏酸的环境中酶失活加速(图3b)。这说明日本鳗鲡NAGase活力易受环境中酸碱度变化的影响。
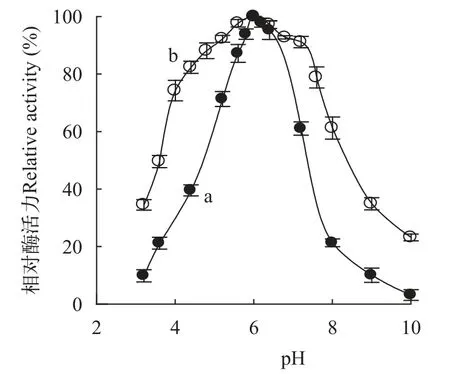
图3 pH对日本鳗鲡NAGase活力的影响Fig. 3 Effects of pH on the activity of NAGase from intestine ofAnguilla japonica
2.3 温度对日本鳗鲡NAGase活力的影响
由图4可见,日本鳗鲡肠道NAGase的最适温度为60℃,温度在60℃以上酶活力快速下降,温度达80℃时,酶失活 89.6(图4a);在60℃温度以下,NAGase具有较好的热稳定性,65℃以上酶稳定性迅速下降,在70℃环境内处理1h,酶活力仅剩余10.3,90℃下NAGase接近失活(图4b)。
2.4 日本鳗鲡NAGase酶促反应动力学参数的测定
在0.15—1.5 mmol/mL [S]下,测定不同[S]对日本鳗鲡NAGase活力(v)的影响,结果(图4)显示,随着[S]的增大,酶反应速度v也增大。以1/v对1/[S]作图(图5),得到1条直线,直线方程为:y=0.044x+0.131,R2=0.9985;以据此方程求得日本鳗鲡NAGase水解底物pNP-β-D-GlcNAc的Km值为0.336 mmol/L,Vmax值为7.634 μmol/(L·min)。

图4 温度对日本鳗鲡NAGase活力的影响Fig. 4 Effects of temperature on the activity of NAGase from intestine of Anguilla japonica

图5 日本鳗鲡NAGase催化底物水解的Lineweaver-Burk双倒数图Fig. 5 The Lineweaver-Burk plot of NAGasefrom Anguilla japonica for the hydrolysis of substrate
2.5 金属离子对日本鳗鲡NAGase活力的影响
从表2可知,Na+、Li+、Cl-、NO3-和SO42-对NAGase活力几乎没有影响;0.5 mmol/L Mg2+、Ca2+、Cu2+和Fe3+可分别使日本鳗鲡肠道NAGase活力提高16.72%、8.34%、4.15%和51.56%,0.1 mmol/L的Mn2+可使酶活力提高34.14%,这些金属离子对NAGase呈现不同程度的激活作用;0.5 mmol/L Ba2+对NAGase活力几乎没有影响;而0.5 mmol/L Zn2+和Fe2+可分别使NAGase活力丧失9.27%和45.38%,对酶呈现抑制作用。10.0 mmol/L Pb2+和1.0 μmol/L Hg2+可分别使酶活力丧失65.17 %和83.69 %,Hg2+的抑制作用最强。
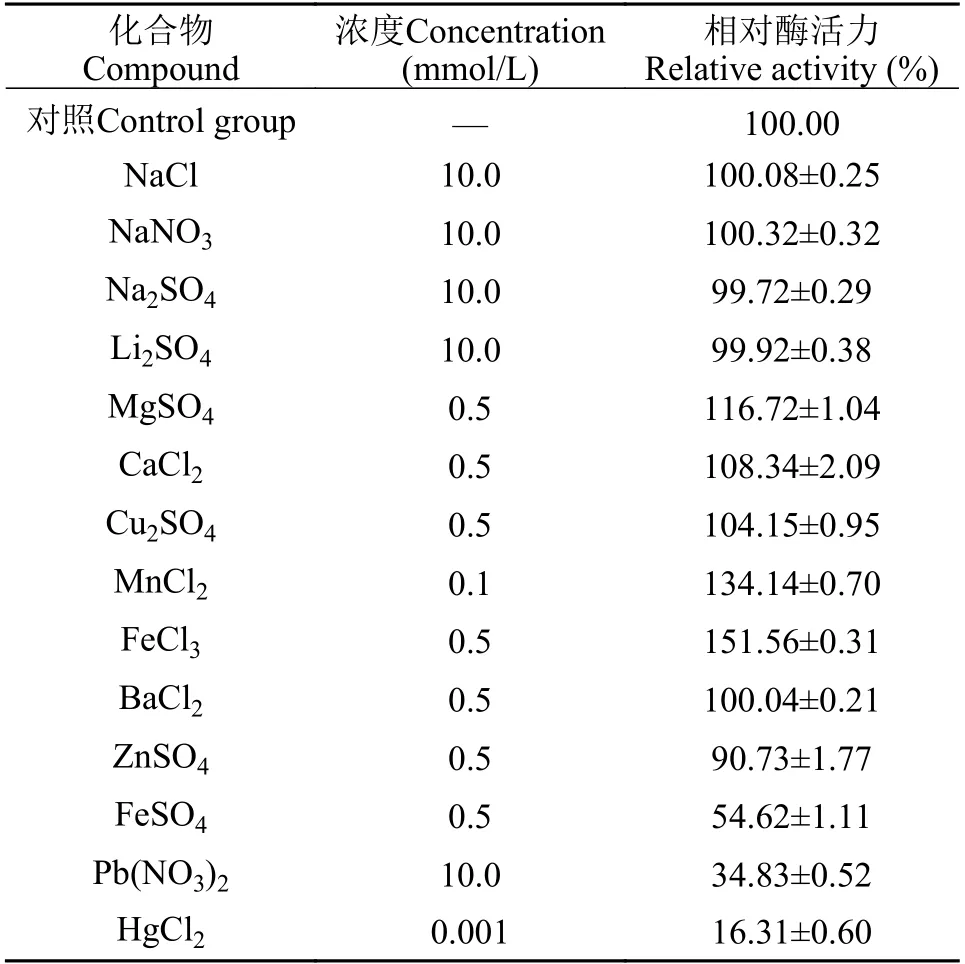
表2 金属离子对日本鳗鲡NAGase活力的影响Tab. 2 Effects of metal ions on the activity of NAGase from intestine of Anguilla japonica
2.6 日本鳗鲡NAGase的必需基团
胍基和氨基的化学修饰AcAc能专一修饰蛋白质Arg中的胍基[11],实验结果(图6a)表明,AcAc在0—200 mmol/L,对NAGase修饰后,酶活力几乎不受影响,由此判断Arg胍基不是日本鳗鲡NAGase活性所必需的。AcAn是蛋白质氨基的修饰剂[16],实验表明,NAGase经AcAn修饰后,酶活力呈不断下降趋势(图6a),说明氨基是日本鳗鲡NAGase活力所必需的;而TNBS是Lys中ε-氨基的一种有效修饰剂[15],随TNBS浓度增大,修饰后NAGase活力不断下降,经20 mmol/L TNBS修饰后酶活力几乎全部丧失(图6b),说明Lys的ε-氨基是日本鳗鲡NAGase的必需基团。
巯基与二硫键的化学修饰pCMB是Cys巯基的专一修饰剂[16],NAGase经pCMB修饰后,随pCMB浓度增大,酶活力呈不断下降趋势,当pCMB修饰浓度达0.5 mmol/L时,酶活力仅剩16.11%(图6c),结果显示,巯基是日本鳗鲡NAGase活性的必需基团。而DTT是蛋白质分子中二硫键的有效修饰剂之一,DTT修饰后酶蛋白的二硫键断裂,酶空间构象可能发生变化[15]。NAGase经DTT修饰后,酶活力呈下降趋势,当DTT浓度达到100 mmol/L时,NAGase活力丧失了81.29%(图6d),说明日本鳗鲡NAGase酶蛋白的二硫键与酶活力息息相关,酶蛋白稳定的空间构象是酶活性所必需的。
咪唑基、羟基和吲哚基的化学修饰BrAc在酸性条件下能专一地修饰蛋白质His的咪唑基[17]。结果表明,随BrAc浓度增大,修饰后NAGase活力不断下降,150 mmol/L BrAc修饰NAGase后,酶几近失活(图6d),His咪唑基是日本鳗鲡NAGase活性的必需基团。PMSF可对蛋白质分子中Ser羟基进行专一修饰[15],不同浓度PMSF修饰NAGase后,酶活力呈不断下降趋势,50 mmol/L PMSF修饰NAGase后,酶活力仅剩4.28%(图6e),说明Ser的羟基与日本鳗鲡NAGase活性密切相关,是酶活性的必需基团。此外,NBS是蛋白质中Trp吲哚基的特异修饰剂[17],NAGase被NBS修饰后,酶活力快速下降,仅100 μmol/L浓度的NBS,可使酶活力下降94.69%(图6f),说明吲哚基为该酶的必需基团。

图6 八种化学修饰剂对日本鳗鲡NAGase活力的影响Fig. 6 The effects of eight chemical modification reagents on the activity of NAGase from intestine of Anguilla japonica
3 讨论
3.1 动物NAGase的基本酶学性质
不种动物来源的NAGase其酶学性质存在差异。尼罗罗非鱼肝脏NAGase是由一个蛋白亚基组成,蛋白亚基分子质量为61.8 kD,Km为0.229 mmol/L[11];而尼罗罗非鱼[18]精巢中的NAGase,分子量则为118.0 kD,Km是0.67 mmol/L;从昆虫类菜青虫(Pieris rapae)[19]外表皮来源的NAGase是由相对分子质量分别为59.5和57.2 kD的两个蛋白亚基组成,Km为0.285 mmol/L;虾类体内的NAGase,如凡纳滨对虾(Penaeus vannamei)[14]内脏NAGase是由两个相同蛋白亚基组成,亚基分子质量为45 kD,Km= 0.254 mmol/L;而来自蟹类节肢动物的NAGase,Zhang等[20]报道的锯缘青蟹(Scylla serrata)内脏NAGase也是由两个相对分子质量均为65.8 kD的蛋白亚基组成,Km为0.424 mmol/L。实验结果表明,日本鳗鲡肠道NAGase酶蛋白亚基分子质量相对较大,为69.98 kD,Km= 0.336 mmol/L。比较不同动物NAGase水解底物pNP-β-D-GlcNAc的Km值大小,说明尼罗罗非鱼肝脏NAGase对底物亲和力相对较大。
在研究pH(3.2—10.0)对日本鳗鲡肠道NAGase活力的影响中,为了尽量减少环境因素对酶活力的影响,分段选用了成分简单的醋酸-醋酸钠、NaH2PO4-Na2HPO4及硼砂-NaOH等3种常用缓冲液。广范围缓冲液(pH 2.6—12.0)组成分包括柠檬酸、KH2PO4、硼酸、巴比妥和NaOH等,成分较为复杂,可能会对酶活力产生影响,引起实验误差。而3种成分简单的缓冲液虽然离子强度有所不同,但都是Na+型的,Na+对NAGase活力几乎没有影响,实验误差相对小些。
pH对来自不同动物NAGase的影响存在差异,本实验表明: 日本鳗鲡肠道NAGase的最适pH为6.0,与菜青虫[19]表皮NAGase最适pH (6.2)及尼罗罗非鱼[11]肝脏NAGase最适pH (5.8)相近,高于凡纳滨对虾[14]内脏NAGase的最适pH (5.2)及中国鲎(Tachypleus tridentatus)[21]内脏NAGase最适pH (5.4),这些来源不同的NAGase最适pH均偏向酸性。
在温度对动物NAGase影响的研究中,尼罗罗非鱼[11]肝脏NAGase和中国鲎[21]内脏NAGase的最适温度均为55℃,蜜蜂(Apis mellifera ligustica)[22]NAGase的最适温度为60℃,而凡纳滨对虾[14]和中华绒鳌蟹(Eriocheir sinensis)[23]内脏NAGase最适温度均是45℃,本实验日本鳗鲡肠道NAGase的最适温度为60℃。这些不同动物来源的NAGase其最适温度存在差异,应该是生物进化中各自长期适应不同生活环境的结果。此外,它们的最适温度均较高(≥45℃),超出普通生存环境的温度,而这些节肢动物或鱼类又都是变温动物,因此,在适宜生存的环境温度下这些动物的NAGase活力都处于较低水平。日本鳗鲡养殖的适宜水温为13—30℃[24],此温度下肠道NAGase活力较低,直接影响鳗鲡肠道对甲壳质类多糖的消化。
3.2 NAGase的酸碱稳定性与热稳定性
凡纳滨对虾[14]内脏NAGase在pH 4.2—10.0稳定,猪[25]精液碱性NAGase在pH 3.0—8.9稳定,锯缘青蟹[20]内脏和尼罗罗非鱼[11]肝脏的NAGase则分别在pH 4.6—8.6、pH 4.0—9.0稳定,这些NAGase在偏酸偏碱性环境中均较稳定;在本实验中,日本鳗鲡肠道NAGase的酸碱稳定范围为pH 4.8—7.2,在pH 8.0下孵育1h后,NAGase活力只剩61.35%,不耐碱性。这说明不同来源的NAGase其最适pH和酸碱稳定范围均存在差异,可能是由于不同动物来源NAGase的分子结构、活性中心构象及其所处微环境不同所致[23]。日本鳗鲡肠道NAGase的最适pH偏酸性,而鳗鲡肠道蛋白酶、淀粉酶的最适pH是偏碱性的[26],说明鳗鲡肠道内消化酶的最适pH值大小主要是由酶自身特性决定的,与所处肠道的内环境关系不大。此外,成鳗又适宜生长在偏碱性(pH 7.2—9.0)水体中[24],偏碱性的养殖水体能否影响到鳗鲡肠道内环境,进而影响肠道内NAGase的活性,还有待进一步研究。
不同动物来源的NAGase热稳定性不同。尼罗罗非鱼[11]肝脏NAGase热稳定性范围为0—55℃,中国鲎[21]内脏NAGase在20—50℃温度内稳定,而中华绒鳌蟹[23]内脏NAGase在10—40℃内酶较为稳定,在本实验中,日本鳗鲡肠道NAGase在4—60℃范围内具有较好的稳定性,热稳定性范围较大,这可能与鳗鲡长期适应了从深海到河流洄游这一较大水温变化的生活习性相关。酶在较低温度下通常较为稳定,但是,随着环境温度升高,酶的空间构象发生了变化,酶开始变性失活,凡纳滨对虾[14]内脏、锯缘青蟹[20]内脏、菜青虫[19]表皮和尼罗罗非鱼[18]精巢的NAGase在45℃以上均迅速失活,尼罗罗非鱼[11]肝脏NAGase在55℃以上稳定性也迅速降低,而日本鳗鲡肠道NAGase在65℃以上也迅速失活,说明不同动物来源的NAGase可能由于空间构象的刚性不同,对温度的敏感性存在差异,酶变性失活所需的温度也不同。
3.3 金属离子对不同动物来源NAGase的影响
Mg2+、Ca2+、Mn2+、Cu2+和Fe3+等5种金属离子对日本鳗鲡肠道NAGase活力有不同程度的激活作用。Mg2+和Ca2+往往是酶的激活剂,对凡纳滨对虾[14]内脏NAGase和锯缘青蟹[20]内脏NAGase均有激活作用,但对尼罗罗非鱼[18]精巢和蜜蜂[22]的NAGase几乎没有影响;Mn2+对凡纳滨对虾[14]内脏NAGase也呈现激活作用,但对尼罗罗非鱼[18]精巢NAGase和中国鲎[21]内脏NAGase又有抑制作用。此外,Cu2+对锯缘青蟹[20]内脏NAGase、菜青虫[19]外表皮NAGase和罗非鱼[18,27]精巢NAGase都有不同程度抑制作用,Fe3+对中国鲎[21]、凡纳滨对虾[14]的内脏NAGase也均呈现较强抑制作用,而本实验结果却有所不同。
实验结果表明,Ba2+对日本鳗鲡肠道NAGase几乎没有影响,与Ba2+对中华绒鳌蟹[23]内脏NAGase没有影响相似,但Ba2+对锯缘青蟹[20]内脏NAGase又有抑制效应。Zn2+、Pb2+和Hg2+这3种重金属离子经常是酶的强烈抑制剂,对凡纳滨对虾[14]内脏和中华绒鳌蟹[23]内表皮的NAGase均具有不同的抑制效应,而Zn2+、Pb2+和Hg2+对日本鳗鲡肠道NAGase也同样呈现不同程度的抑制效应,其中Hg2+对酶抑制作用较强,1.0 μmol/L Hg2+可使日本鳗鲡NAGase活力丧失83.69%。总之,金属离子效应物对动物NAGase具有调控作用。因此,鳗鲡养殖水体中的金属离子,以及养殖饲料中所添加的矿物质或微量元素,通过鳗鲡摄食进入肠道后,均可对肠道NAGase活力产生调控,进而对甲壳质类多糖的消化生理产生影响。
3.4 NAGase活性的必需基团
化学修饰法试验结果表明,Lys的ε-氨基、Cys巯基、His咪唑基、Ser羟基和Trp吲哚基都是日本鳗鲡NAGase活性所必需的,这与中国鲎[15]内脏NAGase活性的必需基团相同,而尼罗罗非鱼[11]肝脏NAGase活性必需基团包含有氨基、His咪唑基和Trp吲哚基;菜青虫[28]表皮NAGase中也包含有Cys巯基、His咪唑基和Trp吲哚基等酶活性的必需基团,但Lys的ε-氨基不是菜青虫表皮NAGase活性所必需;巯基与吲哚基也是槐猪精液NAGase的必需基团[29]。相似的是,Arg胍基均不是这些动物NAGase的必需基团,而二硫键又都是这些动物NAGase活性所必须的,在维系酶蛋白稳定的空间构象中发挥重要作用。
综上所述,日本鳗鲡肠道NAGase经过35%和75%饱和硫酸铵沉淀分级分离、Sephadex G-100分子筛凝胶和DEAE-32离子交换的柱层析分离,可得到比活力为2517.40 U/mg纯酶制剂,该分离纯化方案有效可行;NAGase蛋白亚基分子质量为69.98 kD,其Km值和Vmax值分别为0.336 mmol/L和7.634 μmol/(L·min),酶活力易受环境中酸碱度、温度和金属离子的影响;Lys中ε-氨基、Cys巯基、His咪唑基、Ser羟基和Trp吲哚基是酶的必需基团,二硫键是NAGase活性所必需的,而Arg胍基不是酶的必需基团,日本鳗鲡肠道NAGase与其他不同动物来源的NAGase具有相似的必需基团。
