克氏原螯虾Rab5、Rab6蛋白及其抗体对血淋巴细胞吞噬活性的影响
2022-09-13王欣茹蒋昕彧候利波孔祥会
朱 雷 赵 彤 王欣茹 蒋昕彧 候利波 孔祥会
(河南师范大学水产学院,新乡 453007)
Rab蛋白是Ras样蛋白超家族中最大的分支,到目前为止,已经在人类基因组中成功鉴定到70多个Rab基因[1,2]。Rab蛋白在进化上相对保守,它们在结构上均含有高度保守的G结构域(Guanine-base binding motifs)和PM结构域(Phosphate/magnesiumbinding motifs)及高度可变的N端和C端[3]。研究表明大多数Rab蛋白在真核生物细胞的囊泡运输过程中发挥重要作用,作为Rab蛋白家族的重要成员,Rab5和Rab6在吞噬过程中发挥关键调节作用[4—7]。
在高等哺乳动物细胞中,Rab5存在3种亚型(Rab5A、Rab5B和Rab5C),3种亚型在细胞定位相互重叠,并且功能也密切相关。虽然具有多种细胞功能,Rab5最主要的功能是调节早期吞噬过程中吞噬小体和内吞小体的融合[8]。研究表明,在人类巨噬细胞早期吞噬过程中Rab5会迅速富集到早期吞噬体上,并发挥对外源异物吞噬的调控作用。使用抗体中和胞质Rab5蛋白后,吞噬小体与核内小体的融合明显减少,而过表达Rab5则可以增强吞噬小体与溶酶体的融合。使用干扰技术抑制Rab5基因的正常表达后,细胞吞噬能力会受到显著影响[9,10]。其次,Rab5还参与调控细胞骨架的构建,并且这种调节并不需要PI3-K、Ras、Rac和Cdc42等分子的参与。需要注意的是Rab5调控的细胞骨架结构的改变将导致细胞伪足的形成和迁移,并进一步促进细胞吞噬作用[11]。此外,Rab5还参与了胞内信号转导功能。在外界信号刺激下,Rab5可以调节APPL1和APPL2从核内体转移到细胞核,并进而调节细胞增殖和其他细胞功能[12]。值得注意的是,近期研究表明Rab5也参与了水生动物的先天免疫。大黄鱼(Larimichthys crocea)在受到副溶血弧菌(Vibrio Parahemolyticus)感染后,其脾脏中的Rab5基因的表达量达到对照组的24倍。Rab5可以通过诱导TNFα和IL-6的表达来提高大黄鱼的炎症反应[13]。凡纳滨对虾(Litopenaeus Vannamei)感染传染性皮下和造血坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)和白斑综合症病毒(White spot syndrome virus,WSSV)后,Rab5在对虾组织中发生明显的表达变化。进一步的研究表明,Rab5可以与IHHNV的非结构蛋白NS1相互作用[14]。
Rab6是多种膜运输的关键调控因子,特别是在高尔基体的反向运输途径中。在其他效应分子的参与下,Rab6还可参与调节细胞吞噬、有丝分裂和先天免疫反应[1,15]。Rab6在小鼠(Mus musculus)单核-巨噬细胞吞噬金黄色葡萄球菌(Staphylococcus aureus)的过程中发挥了积极作用[16]。有报道表明Rab6参与调控日本囊对虾(Marsupenaeus japonicus)血淋巴细胞抗菌和抗病毒吞噬作用,且血淋巴细胞吞噬率和吞噬指数与Rab6的表达量呈现正相关。此外,Rab6可以与WSSV囊膜蛋白VP466相互作用,形成的Rab6-VP466复合物可以通过与肌动蛋白的相互作用调控血淋巴细胞的吞噬作用[6,7]。研究人员在果蝇(Drosophila melanogaster)S2细胞中也观察到类似结果,推测无脊椎动物中Rab6在吞噬中的调控作用是相对保守的[6]。
克氏原螯虾(Procambarus clarkii)又名小龙虾,是我国重要的养殖经济物种。然而,随着养殖密度的增加,人工养殖克氏原螯虾不断遭受各种疾病侵袭[17—19]。在前期的研究中,我们克隆了克氏原螯虾Rab5(PcRab5)和Rab6(PcRab6)基因,广泛存在于克氏原螯虾的各个组织中,且在血淋巴细胞和鳃中的表达量较高。WSSV和嗜水气单胞菌(Aeromonas hydrophila)感染后,两者在肝胰腺、鳃和肠道的表达量均出现显著变化。在PcRab5和PcRab6表达受抑制后,感染了WSSV和嗜水气单胞菌的克氏原螯虾死亡率受到明显影响[20]。这些研究均表明甲壳动物Rab5和Rab6可能参与调节血淋巴细胞吞噬功能和对抗原的免疫响应。在此基础上,本研究利用同源重组技术构建了两者的原核表达载体,制备了多克隆抗体,并进一步研究了其对血淋巴细胞吞噬活性的影响。实验结果可为进一步研究克氏原螯虾PcRab5和PcRab6的免疫学功能提供基础。
1 材料与方法
1.1 实验动物
实验用克氏原螯虾购自河南省鹤壁市养殖基地,体重为25—30 g,实验前暂养1周,水温控制在20℃左右,养殖过程中每天换1次水,每次换2/3。实验前选取体表无伤,行动活泼的个体进行实验。
1.2 实验试剂
pET-B2m质粒与表达载体(含有his和B2m标签)购自武汉金开瑞生物工程有限公司;DNA聚合酶、内切酶和琼脂糖购自TaKaRa公司;DNA Marker 购于大连宝生物工程有限公司;质粒提取试剂盒、DNA提取试剂盒和IPTG购自天根生物技术公司;硝酸纤维素膜、弗式完全佐剂、弗式不完全佐剂和辣根过氧化物酶标记的羊抗兔二抗购自美国Sigma公司;FITC标记的荧光微球(1 μm)购自美国Polysciences公司。
1.3 目的基因的扩增与表达质粒的构建
根据克氏原螯虾PcRab5和PcRab6基因[20]的序列特点,利用Primer Premier 5.0软件设计PcRab5和PcRab6的特异性引物(表1),以克氏原螯虾血淋巴细胞cDNA为模板进行PCR获得目的基因片段。使用SalI与BamH I双酶切载体pET-B2m,随后使用同源重组技术构建带GFP标签的重组质粒pET-B2m-PcRab5和pET-B2m-PcRab6,并转化大肠杆菌。挑选阳性克隆进行PCR检测和送至生工生物工程(上海)股份有限公司测序,采用DNAMAN软件对测序结果进行比对分析,以判断目的基因是否正确插入载体。
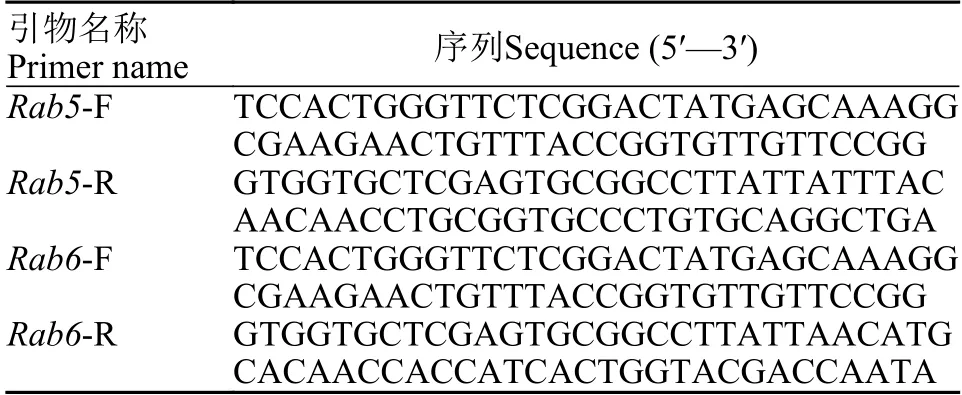
表1 PCR扩增引物Tab. 1 Primers used for PCR amplification
1.4 蛋白质的诱导表达
将验证正确的阳性表达菌接入LB液体培养基中进行小量诱导表达(取部分菌液作为对照),37℃震荡培养至A600约0.6,向其中加入IPTG诱导剂(终浓度0.5 mmol/L)进行诱导表达,37℃震荡培养4h。取上述菌液2 mL,12000 r/min离心20min,收集沉淀。菌体沉淀以40 μL 1×loading buffer重悬裂解,随后使用SDS-PAGE对总菌体、沉淀和上清进行检测。验证外源基因显著表达后,将菌液接入2000 mL的LB液体培养基中按照上述方法进行大量诱导表达,随后使用上述方法进行离心、收集、破碎(200 W、工作3s、暂停3s、时间10min)和检测。
1.5 蛋白纯化和抗体制备
使用Ni-NTA柱对原核蛋白进行纯化。大致过程如下: 使用0.22 μm滤膜过滤蛋白溶液,以1 mL/min的速度在Ni-NTA柱中上样蛋白溶液,随后使用6 mol/L盐酸胍缓冲液(pH 8.0)冲洗柱子,并使用G250检测不变色时停止(流出液不含蛋白)。分别以不同浓度的咪唑的洗脱液(20、60、200和500 mmol/L)洗脱,分段收集洗脱液至G250检测液不变色。随后,使用去离子水冲洗柱料。使用SDS-PAGE电泳检测收集的洗脱液,随后,使用分步透析法对融合蛋白进行复性,蛋白依次经过6、3、2、1 mol/L(375 μmol/L谷胱甘肽和400 μmol/L L-精氨酸)、0.5 mol/L(375 μmol/L谷胱甘肽和400 μmol/L L-精氨酸)和0 mol/L盐酸胍透析,每次透析约12h。选取4只6月龄以上的日本大耳兔进行4次免疫制备抗体,制备抗体之前使用注射器从耳静脉抽取约10 mL血液作为阴性对照。将蛋白浓度调至400 μg/mL,抽取1 mL蛋白与等体积的弗氏完全佐剂混匀至乳白色,随后四点注射大耳兔。初次免疫间隔2周后,抽取1 mL蛋白与等体积的弗氏不完全佐剂混匀至乳白色,随后四点注射大耳兔。第3和第4次免疫方法同第2次免疫,第4次免疫10d后,从耳静脉抽血。
1.6 抗体效价检测
首先,将抗原稀释至2 μg/mL,并加入至96 孔酶标反应板中(100 μL/孔),包被过夜。次日弃去孔内液体,PBST洗3次。向孔内加入200 μL 5%的BSA溶液,封闭2h。将血清按1∶2 K、1∶4 K、1∶8 K、1∶16 K···1∶32768 K进行倍比稀释,并加入酶标板中,孵育1h。洗涤后,加入HRP标记IgG二抗(1∶5000),37℃孵育40min。加入新鲜配制的底物溶液,避光孵育5—20min。加入终止液,随后用酶标仪测定450 nm处各孔的吸光值。
1.7 抗体特异性检测
首先,将PcRab5和PcRab6的原核表达蛋白稀释至10 ng/μL,并分别进行SDS-PAGE,电泳结束后转至PVDF膜中。转移结束后使用5%的封闭液封闭4h,PBST洗涤3次后,将膜放置于一抗稀释液中(1∶2000),孵育2h。PBST洗涤3次,浸泡于HRP标记的二抗(1∶5000)中,孵育1h,最后使用ECL曝光。
1.8 抗体纯化
使用10倍柱床体积的去离子水冲洗ProteinG柱,随后使用0.02 mol/L 磷酸缓冲液(PB)和0.3 mol/L NaCl冲洗柱子,流速控制在1 mL/min。使用0.02 mol/L PB溶液稀释抗血清,0.22 μm滤膜过滤上柱,流速控制在5—7s/滴。分别使用PB溶液和0.1 mol/L甘氨酸(pH 3.0)冲洗柱子至无蛋白流出为止(G250不变蓝)。使用饱和碳酸钠溶液将洗脱物调节至pH中性,使用超滤管进行超滤。最后,使用PBS(0.01 mol/L,pH=7.4)透析过夜,第2天换新PBS液一次,再次透析4—6h后,使用SDS-PAGE鉴定并测定抗体浓度后分装于EP管,保存于-80℃备用。
1.9 克氏原螯虾血淋巴细胞吞噬能力验证
为了验证克氏原螯虾血淋巴细胞对荧光微球的吞噬能力,使用预冷的血淋巴抗凝剂(336 mmol/L氯化钠,27 mmol/L柠檬酸钠,9 mmol/L EDTA,115 mmol/L 葡萄糖,pH 7.2),从克氏原螯虾围心腔处抽取血淋巴。然后,400×g离心10min获得血淋巴细胞,将血淋巴细胞离心洗涤后使用改良的L-15培养基重悬,并在12孔板中进行培养。然后向其中加入荧光微球(细胞∶微球=1∶20),孵育1h,每隔20min轻轻摇晃1次。在孵育结束后,将细胞悬液加在3 mL葡萄糖垫溶液(含3% BSA 和4.5% D-葡萄糖的BSA,pH 7.4)上方,4℃,100×g离心10min,去除未被吞噬的微球,PBS洗涤3次。随后,分别使用荧光显微镜和流式细胞术分析血淋巴细胞吞噬活性。在流式细胞术中,将FL1-H(代表细胞荧光强度大小)设置为横坐标,将Count(代表细胞数量)设置为纵坐标,每个样品分析1×104个细胞。
1.10 PcRab5和PcRab6对克氏原螯虾血淋巴细胞吞噬活性影响
实验方法参照文献[9,21],并进行一些修改。将健康克氏原螯虾平均分成6组,每组3个平行,分别命名为PBS对照组(A)、BSA对照组(B)、PcRab5蛋白过表达组(C)、PcRab5免疫抑制组(D)、PcRab6蛋白过表达组(E)和PcRab6免疫抑制组(F)。其中,A组注射200 μL PBS,而B、C、D、E和F组分别注射200 μL 0.1 mg的BSA、PcRab5蛋白、PcRab6抗体、PcRab6蛋白和PcRab6抗体。在注射4h后,使用预冷的血淋巴抗凝剂,从各组克氏原螯虾围心腔处抽取血淋巴。然后,离心获得血淋巴细胞,离心洗涤后在12孔板中进行培养。随后参照上述方法使用流式细胞数分析各组克氏原螯虾血淋巴细胞吞噬活性情况。
1.11 数据的处理与分析
实验结果表示为平均值±标准差(x±SD;n=3)。用SPSS 25.0软件对结果进行单因素方差分析(Oneway analysis of variance,ANOVA),当P<0.05时认为有显著性差异,随后利用Duncan氏法进行多重比较。
2 结果
2.1 PcRab5、PcRab6表达载体的构建与鉴定
分别以构建的pET-B2m-PcRab5和pET-B2m-PcRab6为模板进行PCR扩增,使用琼脂糖凝胶电泳进行检测,获得的目的片段与预期大小均符合。随后,将PCR产物进行纯化、测序,结果表明PcRab5和PcRab6已经正确插入至表达载体中。
2.2 重组蛋白表达
使用SDS-PAGE分析PcRab5和PcRab6的阳性克隆菌株小量诱导表达情况,结果显示PcRab5和PcRab6的阳性克隆菌株均在67 kD处出现明显的加粗条带,大小与预期大小一致。随后,对阳性菌株进行大量诱导,并使用SDS-PAGE进行检测,结果显示加粗蛋白质条带主要出现在菌体沉淀中,且染色较深,说明重组蛋白质主要以包涵体的形式存在。
2.3 重组蛋白的纯化
对PcRab5和PcRab6的表达菌进行收集、破碎、Ni-NTA柱纯化和超滤后,经稀释后使用SDSPAGE电泳检测,结果表明PcRab5和PcRab6均在67 kD处有一条明显的条带,与预期大小一致,且无明显杂带,纯度较高,可以用来免疫大耳兔制备多克隆抗体。
2.4 兔抗血清效价和特异性检测
采用ELISA检测抗体效价,结果表明PcRab5的兔多克隆抗体效价为1∶2048K(图1A),而Rab6的多克隆抗体效价超过1∶512K(图1B)。以上实验结果表明,重组的PcRab5和PcRab6蛋白均诱导了大耳兔产生了较强的免疫反应,获得了效价较高的抗体。
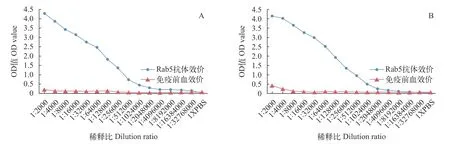
图1 克氏原螯虾PcRab5和PcRab6多克隆抗体效价检测Fig. 1 Titer of polyclonal antibody against Rab5 or Rab6 of Procambarus clarkii
采用Western Blot检测PcRab5和PcRab6多抗血清特异性,结果显示,PcRab5多抗血清可以识别原核表达的PcRab5,PcRab6多抗血清可以识别原核表达的PcRab6。以上实验结果表明,制备的PcRab5和PcRab6抗血清中抗体可以分别与PcRab5和PcRab6蛋白相互作用,且特异性较强。
2.5 抗体纯化
使用Protein G亲和层析柱对PcRab5和PcRab6的抗血清进行纯化,并使用SDS-PAGE检测,结果表明纯化的PcRab5和PcRab6多抗均出现两条明显的条带,其中较大的条带为55 kD左右,较小的条带约为25 kD左右,片段大小与兔抗体的重链与轻链大小相一致,且未见明显杂带。纯化后抗体浓度约为10 mg/mL,纯度为90%以上,实验结果为开展抗体相关实验奠定基础。
2.6 克氏原螯虾血淋巴细胞对荧光微球的吞噬能力
本实验使用流式细胞术和荧光显微镜验证克氏原螯虾血淋巴细胞对荧光微球的吞噬活性。流式细胞术实验结果表明分离的血淋巴细胞杂质少,可以用于吞噬实验(图2A)。进一步分析表明血淋巴细胞可以吞噬荧光微球,且能吞噬微球的细胞比例约为20%(图2B),荧光显微镜实验结果表明在血淋巴细胞内部观察到荧光信号,表明其可吞噬荧光微球(图2C)。

图2 克氏原螯虾血淋巴细胞对荧光微球的吞噬能力检测Fig. 2 Detection of phagocytosis ability of haemocytes of Procambarus clarkii against fluorescent microspheres
2.7 PcRab5、PcRab6对血淋巴细胞吞噬活性的影响
研究表明PcRab5和PcRab6蛋白在调控细胞吞噬功能方面发挥重要作用,为研究克氏原螯虾PcRab5和PcRab6对血淋巴细胞吞噬活性的影响,本实验将PcRab5和PcRab6原核表达蛋白和抗体分别注射至健康螯虾体内,并使用流式细胞术研究其对血淋巴细胞吞噬活性的影响(图3)。结果表明,相对于PBS对照组,注射PcRab5蛋白的螯虾血淋巴细胞吞噬率上升至约33.6%(P<0.05),而注射PcRab6原核蛋白的血淋巴细胞吞噬率升至约28.5%(P<0.05)。虽然PcRab5蛋白注射组血淋巴细胞吞噬水平高于PcRab6蛋白注射组,但是两组之间并不存在显著性差异。与此同时,当健康对虾分别注射PcRab5和PcRab6蛋白多克隆抗体时,其血淋巴细胞吞噬率明显下降,并分别降至13.1%(P<0.05)和13.9%(P<0.05),且两组也不存在显著性差异(图4)。

图3 流式细胞术分析不同处理对血淋巴细胞吞噬活性的影响Fig. 3 The representative histograms of different treatment on the phagocytic activity of haemocytes

图4 不同处理对血淋巴细胞吞噬活性的影响检测Fig. 4 Effect of different treatments on phagocytic activity of haemocytes
3 讨论
3.1 PcRab5和PcRab6的原核表达和抗体制备
Rab5和Rab6均是Rab蛋白家族中的重要成员,几乎存在于所有真核生物中,主要功能是参与调控机体细胞内各个细胞器之间的囊泡运输过程[1,2]。除此之外,这两个蛋白还参与调节细胞信号转导和细胞程序性死亡等。因此,Rab5和Rab6的结构和功能受到广泛关注。本实验使用同源重组技术构建了原核表达载体并进行诱导表达和抗体制备,并以此研究了其对克氏原螯虾血淋巴细胞吞噬活性的影响。
Rab蛋白通常以单体形式存在,分子量介于20—30 kD,因此被称为小G蛋白。在前期研究中,本课题组克隆得到克氏原螯虾PcRab5和PcRab6基因,两个基因编码的蛋白相对分子质量均为23 kD左右[19]。本实验构建PcRab5和PcRab6的原核表达载体时,偶联了GFP标签(分子量约为27 kD),再加上pETB2m表达载体自带的his和B2m标签(分子量约为17 kD),因此,原核表达的分子量应约为67 kD。但是,阳性菌株经IPTG诱导后,SDS-PAGE检测目的条带分子量与理论大小略有差异,造成这一现象的原因可能是不同蛋白之间的电荷效应造成的[22,23]。随后,采用SDS-PAGE对纯化的原核表达蛋白进行检测,结果显示其分子量与理论大小基本保持一致。原核表达蛋白通常以包涵体和可溶性蛋白两种形式存在,其中,可溶性形式一般具有活性功能,而包涵体常被认为是高级结构错误折叠而失去活性。然而,研究发现包涵体中的蛋白大部分也具有活性功能,并且经纯化和复性后,可以用于抗体制备和其他方面的研究[24]。另外,原核表达的融合蛋白纯化后使用分步透析法进行复性,蛋白需经过不同浓度的盐酸胍依次透析,每次透析约12h,融合蛋白复性后具有良好的溶解性,且注射进螯虾体内后显著影响其血淋巴细胞的吞噬活性,而无关蛋白BSA没有影响,这说明原核表达的Rab5和Rab6具有良好的蛋白活性,且与血淋巴细胞的吞噬变化密切相关。本研究使用原核表达的PcRab5和PcRab6蛋白免疫兔子,获得了抗体效价高和特异性好的多克隆抗体,并且纯化后的抗体浓度均在10 mg/mL以上,这为在体外水平对其研究提供了保障。
3.2 PcRab5和PcRab6对克氏原螯虾血淋巴细胞吞噬的影响分析
目前,关于Rab5和Rab6在吞噬中的作用研究多数集中在高等哺乳动物中。在人体巨噬细胞中的研究表明,当使用抗体中和胞质Rab5后,吞噬小体与核内小体的融合明显减少,并且吞噬效率也会下降。向细胞系中加入外源活化的Rab5蛋白,吞噬会恢复至正常水平[9,10]。同样,小鼠胸腺细胞在进行吞噬时,Rab5在吞噬体中的活性也是不断增加的,而Rab5表达缺陷细胞的吞噬活性存在明显滞后和效率低下的现象,表明Rab5在小鼠胸腺细胞吞噬过程中发挥关键作用[25]。在果蝇(Drosophila melanogaster)S2细胞系中,使用基因干扰和质粒转染过表达技术干预Rab6的正常表达后,结果发现Rab6表达受抑制后细胞吞噬效率下降,而过表达Rab6后血淋巴细胞吞噬效率升高。而且,使用Rab6蛋白拯救干扰的Rab6基因其吞噬恢复正常水平[6]。在甲壳动物中,关于Rab蛋白的研究较少,斑节对虾(Penaeus monodon)Rab5可以通过参与血淋巴细胞内黄头病毒(Yellow head virus,YHV)的早期转运过程从而在该病毒感染的早期阶段发挥作用[26]。传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)感染凡纳滨对虾(Litopenaeus vannamei)后Rab5蛋白在肝胰腺中出现显著的表达变化,并且Rab5可以与IHHNV的非结构蛋白NS1相互作用[14]。采用RNAi技术干扰日本囊对虾Rab6基因的正常表达后,其血淋巴细胞对副溶血性弧菌吞噬率和吞噬指数均显著下降[7]。同样,通过与肌动蛋白、肌球蛋白及WSSV囊膜蛋白VP466等形成复合物,Rab6基因可以调控日本囊对虾血淋巴细胞抗病毒吞噬作用[6]。为了进一步厘清Rab5和Rab6在甲壳动物细胞吞噬中的作用,本文检测了这两个蛋白对克氏原螯虾血淋巴细胞吞噬活性的影响。结果表明,在体内加入外源的PcRab5或PcRab6蛋白后,克氏原螯虾血淋巴细胞的吞噬活性均有显著提升。将纯化的PcRab5和PcRab6多克隆抗体注射进螯虾体内后,其血淋巴细胞的吞噬活性出现显著下调。研究结果表明,克氏原螯虾PcRab5和PcRab6蛋白参与了血淋巴细胞的吞噬功能,并发挥了积极作用。此外,PcRab5蛋白注射组和PcRab6蛋白注射组之间的吞噬率,以及PcRab5抗体封闭组与PcRab6抗体封闭组之间的吞噬率不存在显著性差异。实验结果表明,外源PcRab5与PcRab6蛋白可能对血淋巴细胞吞噬活性发挥相近的影响效果。
虽然PcRab5蛋白注射组血淋巴细胞吞噬水平高于PcRab6蛋白注射组,但是两组之间并不存在显著性差异。与此同时,当健康对虾分别注射PcRab5、PcRab6蛋白多克隆抗体时,其血淋巴细胞吞噬率明显下降,并分别降至13.1%(P<0.05)和13.9%(P<0.05),且两组也不存在显著性差异。
综上所述,本研究采用同源重组技术获得克氏原螯虾PcRab5和PcRab6的原核表达蛋白,并制备了效价高和特异性强的多克隆抗体。实验结果表明,PcRab5和PcRab6在克氏原螯虾血淋巴细胞吞噬调节中发挥重要作用,本文可为理解甲壳动物Rab蛋白家族的功能奠定基础。然而,Rab5和Rab6分别通过什么通路对甲壳动物细胞吞噬作用进行调控? 目前并不清楚。在后续研究中,仍需开展更多实验,以厘清Rab5和Rab6调控血淋巴细胞的吞噬机制。
