雄激素受体缺乏抑制肝脏Vtg合成导致卵巢发育障碍
2022-09-13李天慧贺江燕娄气永杜震宇肖武汉
李天慧 翟 刚 贺江燕 娄气永 金 霞 杜震宇 肖武汉 殷 战 ,
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072;2. 中国科学院大学,北京 100049;3. 华东师范大学生命科学学院,上海 200241;4. 中国科学院种子创新研究院,武汉 430072)
鱼类卵巢发育的完整过程包括卵发生、卵黄发生、卵巢成熟和排卵[1]。在卵巢发育过程中,母体营养物质转移到卵母细胞中,形成卵黄,作为胚胎重要的母体营养来源。鱼的卵黄主要由蛋白质、脂质、碳水化合物和维生素组成[2]。由于母体营养运输缺陷而引起的卵巢发育不良,将严重影响女性生育能力、胚胎质量及卵巢发育的诸多方面。卵黄原蛋白(Vtgs)是一类高分子量的糖磷脂蛋白,是卵黄蛋白的前体,主要在肝脏中合成[3,4]。Vtgs不仅是卵黄蛋白的主要成分,也是将含有矿物质的脂质和脂溶性维生素运送到卵巢的重要转运体[5,6]。母体通过Vtgs的营养运输和卵黄形成对女性生育有很大的影响,可能直接损害卵母细胞的健康和分化[7]。传统上,一般认为vtg的转录和合成是由雌激素/雌激素受体信号通路,通过对vtg基因启动子中的雌激素反应元件(Estrogen response elements,ERE)进行调控[8]。也有报道表明,类胡萝卜素使鱼卵呈现黄色或橙色,并且是支撑卵母细胞成熟的重要营养成分[9—12],鱼的类胡萝卜素可从食物中吸收,在大多数鱼类中,Vtgs被认为是类胡萝卜素从肝脏向卵巢转运的主要载体[13—15]。
卵黄发生后,卵母细胞走向成熟。伴随着促黄体生成素(LH)的激增,生发泡破裂(Germinal vesicle breakdown,GVBD)是卵母细胞成熟的特征[16]。Gata4通过与Nr5a1互作,上调anti-Müllerian hormone(amh)的表达来影响斑马鱼(Danio rerio)卵巢的成熟[17]。在小鼠和人类卵巢中,有报道称Nr4a1和Insl3都是卵母细胞成熟的重要调节因子[18]。雌激素受体和孕激素受体在卵巢发育中都扮演着重要的角色,然而,目前对Ar与斑马鱼卵巢发育关系的研究还较少。
雄激素受体(Ar)是由其配体包括睾酮或双氢睾酮(Dihydrotestosterone,DHT)激活的核受体[19,20]。在小鼠模型上的研究表明ar在精子发生中是不可缺少的[19,21—23]。最近两个独立的研究团队在斑马鱼ar敲除模型上的研究表明,ar信号在性别决定、精子发生和卵巢发育中发挥了调节作用[20,24]。特别是在卵巢发育方面,在ar敲除斑马鱼上观察到,与卵巢发育相关的性腺指数(Gonadosomatic index,GSI)、受精率、成熟卵母细胞比率均显著降低[20]。
在本研究中,我们进一步探索了ar缺乏,即雄激素信号通路缺乏,对斑马鱼肝脏中Vtg产生、母体营养通过Vtg运输、卵黄形成和卵巢成熟的影响。
1 材料与方法
1.1 斑马鱼养殖和处理
所有实验斑马鱼(Danio rerio)饲养在28.5℃的循环水系统中,光照14h,黑暗10h。每天喂食新孵化的丰年虫(Artemia salina)两次。斑马鱼ar突变系由中国科学院水生生物研究所淡水生态与生物技术国家重点实验室肖武汉团队构建[20]。斑马鱼的发育阶段以受精后几个月(Months post-fertilization,mpf)来确定。
为了验证Vtg1抗血清的有效性,我们设计了雌激素处理实验。将17β-雌二醇(E2,E2758,Sigma-Aldrich,St. Louis,Missouri,USA)溶解在二甲亚砜(DMSO,D2650,Sigma-Aldrich,St. Louis,Missouri,USA)中,制备10 mg/L的原液。5 mpf 的ar+/+和ar-/-雌性斑马鱼分别分为两组,一组突变系或对照组暴露在50 ng/L (168.7 pmol/L)的E2中7d,另一组突变系或对照组暴露在DMSO对照组的(20 μL加4 L系统水)处理系统水中。食物和养殖密度等条件保持一致。本实验设计主要参考已有的文献描述[25]。
1.2 总RNA提取和qPCR
使用TRIzol试剂从斑马鱼不同组织中提取总RNA,使用RevertAid Firststrand cDNA Synthesis Kit (K1622,Thermo Scientific,Waltham,MA,USA)
用oligo-dT引物合成cDNA。PerfectStartTMGreen qPCR SuperMix购自Transgen Biotech有限公司(AQ601-02,Transgen Biotech,北京,中国),按照制造商提供的方案进行。使用BioRad实时系统热循环仪(BioRad Systems,Berkeley,CA,USA)进行qPCR。qPCR使用的引物见表1。通过常规PCR、电泳和测序验证每对引物具有特异性。以ef1α基因的表达水平作为归一化对照。数据分析采用ΔΔCt方法[26]。

表1 qPCR引物Tab. 1 Primers used for qPCR
1.3 类胡萝卜素的测定
本实验为类胡萝卜素含量粗测量,方法参考文献[27,28]。用无水乙醇从新鲜卵巢中提取类胡萝卜素,每0.01 g卵巢中加入100 μL无水乙醇。涡流振荡,然后在4℃的黑暗环境中过夜。在此过程中振荡样品两次。第2天,将样品在4000 r/min下离心10min。转移上清液200 μL到96孔板上,在450 nm处测定样品的吸光度。类胡萝卜素的含量按以下公式计算。

式中,ω. 类胡萝卜素含量 (mg/g);∊. 类胡萝卜素经验消光系数[250 L/(g·cm)];d. 96孔板直径200 μL(0.6 cm);F. 稀释比例;W. 样品质量 (g);V. 萃取缓冲液体积 (L)。
1.4 卵巢总脂测定
卵巢总脂质参照Folch法测定[29]。将新鲜卵巢称量为湿重,然后将样品快速放入液氮中至少15min。将样品放入-80℃的冰箱中24h。用冷冻干燥机将样品冷冻干燥24h,然后称取干重。用1 mL CM缓冲液(氯仿∶甲醇 2∶1)匀浆,将匀浆移入试管。用CM缓冲液洗涤匀浆管,转移洗涤液至试管,最终体积为6 mL。将样品在室温下涡旋1min,4℃过夜。加入2 mL 0.37 mol/L KCl,涡旋5 min,1500 r/min离心20min。提取下层,用氮气干燥。测定卵巢脂肪的质量,计算卵巢脂肪的质量百分比。
1.5 激素测定
采用ELISA试剂盒(Testosterone: 582701,Estrodial: 501890,Cayman Chemicals,Ann Arbor,MI,USA),并按照制造商的说明使用检测睾酮和雌二醇。采集ar+/+和ar-/-雌性斑马鱼肝脏标本,将每条鱼的组织放入装有磁珠的破碎管中,加入300 μL PBS破碎匀浆。匀浆后,按照制造商的说明使用有机溶剂提取性类固醇。通过涡旋和离心分离层,将有机层转移到新管中,重复提取4次。有机部分在温和的氮气流下于30℃下蒸发。最后,将提取液溶解在200 μL ELISA缓冲液中,准备样品用于测量。所有样本均通过3个独立实验在3个重复中进行测量。
1.6 蛋白质免疫印迹分析
使用蛋白提取缓冲液(P0013B,Beyotime,上海,中国)提取肝脏蛋白。兔抗斑马鱼Vtg1血清由本团队委托公司制备,稀释倍数为1∶1000。β-actin抗体(AC026,ABclonal,武汉,湖北,中国)稀释倍数为1∶1000。使用辣根过氧化物酶标记的二抗产生化学发光信号,该信号由CCD相机成像仪检测(Chemidoc MP Imaging System,Bio-Rad,Berkeley,CA,USA)。β-actin作为上样对照,所有样本重复3次。
1.7 数据分析
所有分析均使用GraphPad Prism 8软件(Graph-Pad软件)进行。采用Student’st检验评估统计学意义。所有统计学比较,P<0.05为差异有统计学意义。
2 结果
2.1 制备Vtg1抗血清的有效性检测及对ar敲除雌性斑马鱼肝脏Vtg蛋白水平的观察
雌激素浸泡处理实验可以检验Vtg1抗血清的有效性。通过采用斑马鱼在正常养殖或雌激素浸泡处理的对比实验,取处理组和对照组雌性斑马鱼肝脏组织进行Western Blot分析,结果显示: E2处理的ar+/+雌鱼肝脏Vtg1高于未经E2处理的ar+/+雌鱼,说明雌激素信号通路增强,从而使Vtg生成增多,这一结果也说明了本实验所用抗血清的有效性(图1,泳道1,2)。同时,利用ar-/-的雌性斑马鱼,在正常养殖或雌激素浸泡处理的对比实验,也发现E2处理和E2未处理的ar-/-雌鱼肝脏Vtg1均无变化,说明增加雌激素不足以改变ar敲除对肝脏Vtg1合成的影响(图1,泳道3,4)。

图1 Vtg1抗血清有效性检测Fig. 1 Detection of Vtg1 antiserum effectiveness
2.2 ar敲除导致斑马鱼肝脏Vtg蛋白合成下降
与对照组相比,ar-/-雌鱼肝脏中vtg 1,2,4-7和vtg3的相对表达水平显著下调(图2A和2B)。采用Western Blot检测,以及对其监测信号的量化分析,也发现ar-/-雌鱼肝脏Vtg1蛋白水平低于野生型对照组(图2C和2D)。

图2 ar敲除损害雌性斑马鱼肝脏中Vtg的产生Fig. 2 ar-deficiency impairs the hepatic Vtg production in female zebrafish
2.3 ar敲除干扰斑马鱼肝脏中的雌激素信号通路
肝Vtgs的产生主要源于雌激素受体(Esr)响应雌激素的刺激,尤其是雌激素受体中的Esr1[30]。我们发现ar-/-雌鱼肝脏中esr1和esr2b转录本的水平显著低于对照组(图3A和3C) ,但esr2a的相对表达量没有明显变化(图3B)。另一方面,肝脏样本中的睾酮和雌二醇水平在ar-/-雌鱼和对照组之间没有显著变化(图3D和3E)。这些结果表明,由于Ar缺乏,雌性斑马鱼肝脏中整体雌激素信号应是下调的。
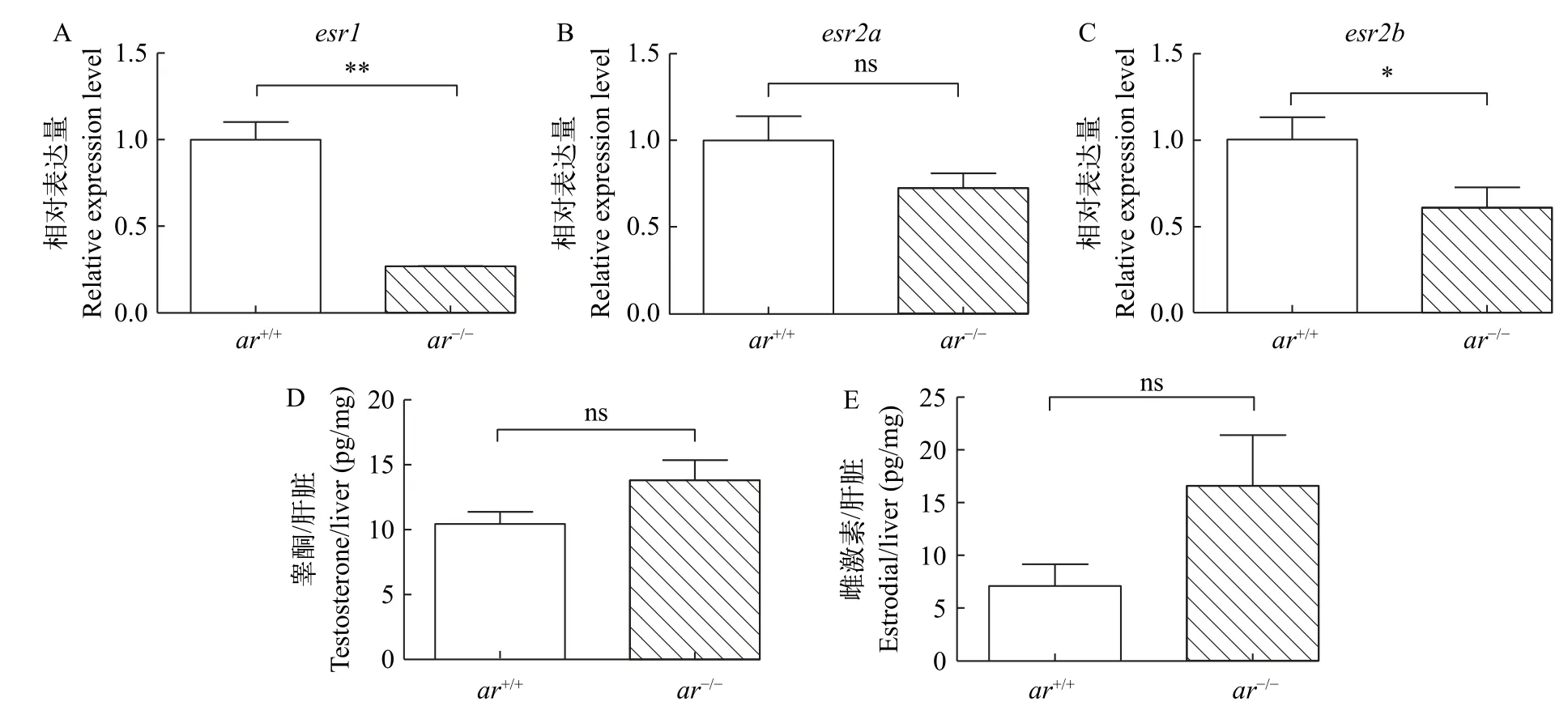
图3 ar敲除对斑马鱼肝脏中的雌激素信号通路和性激素水平的影响Fig. 3 Influences of ar-deficiency on the estrogen signaling and gonadal hormone level in the liver of zebrafish females
2.4 ar-/-雌性斑马鱼卵巢特征
由于ar-/-雌鱼肝脏的Vtg产生受损,有理由推测卵巢的营养成分也因此受到影响。在3 mpf 的斑马鱼中,与对照组相比,我们发现ar-/-雌鱼卵巢的大小和重量都有所下降(图4A和4B)。我们也发现,ar-/-雌鱼的含水量高于对照组(图4C)。我们还发现ar-/-雌鱼的卵巢变得明显透明(图4A),并同时伴随在ar-/-雌性斑马鱼的卵巢中,类胡萝卜素和总脂水平比对照组显著降低(图4D—F)。

图4 ar敲除斑马鱼卵巢特性变化Fig. 4 Characterization changes of the ovarian composition in ar-/- females
2.5 ar-/-卵巢中与卵巢发育相关的关键基因转录表达水平下调
选取多个卵巢发育相关基因检测相对表达量,其中发现nuclear receptor subfamily 4,group A,member 1 (nr4a1),GATA binding protein 4 (gata4),nuclear receptor subfamily 5,group A,member 1a(nr5a1a) 和hydroxysteroid 11-beta dehydrogenase 2(hsd11b2)等4个基因的表达出现了显著变化。我们发现在性成熟后,与对照组相比,ar-/-雌性斑马鱼卵巢中nr4a1、gata4、nr5a1a和hsd11b2的转录水平显著下调(图5),这表明ar敲除显著损害了许多与卵巢发育相关的关键基因的转录表达模式。

图5 ar敲除对若干重要卵巢发育关联基因表达的影响Fig. 5 Transcriptional expression patterns of the key genes related with fish ovaries in ar-/- zebrafish ovaries
3 讨论
3.1 ar对性腺的发育不可或缺
在小鼠模型[19,31,32]和斑马鱼模型[20,24]中,Ar或者雄激素信号通路对性腺的发育甚至性别发育带来影响。在斑马鱼中,ar缺乏导致雌性比例增加和卵巢早衰。ar-/-斑马鱼的卵巢变得透明,GSI显著降低,以及卵母细胞成熟出现缺陷[24],这说明Ar参与卵巢发育和卵母细胞成熟。同时,有报道称类胡萝卜素的含量决定了卵巢的鲜艳颜色和卵巢的正常发育[9—12]。比较ar-/-雌鱼和对照组的卵巢外观,突变体中小而透明的卵巢表明ar缺乏引起卵巢营养成分的受损和特征的改变。
ar也是人类不孕的相关基因之一,因此,研究ar在卵巢发育中的功能,对解决一些与ar有关的不孕不育症状非常关键。
3.2 ar参与调控雌激素信号通路和Vtgs的生成
在肝脏中合成的Vtgs是碳水化合物、脂类、脂溶性维生素和类胡萝卜素的主要转运体[5,6,13—15],因此,我们针对ar-/-雌鱼中的Vtg生成水平开展研究。在ar-/-雌性斑马鱼的肝脏中,确实观察到vtg转录表达水平的显著下降和Vtg1蛋白水平的显著降低(图2)。此外,与对照组相比,ar-/-雌性斑马鱼肝脏中esr1和esr2b的转录表达水平显著下调(图3),说明Ar缺乏会干扰斑马鱼肝脏中的雌激素信号。然而,E2处理并没有上调ar-/-雌性Vtg1的产量(图1),这表明单独增加E2并不能拯救ar突变体的表型。由于esr1已被认为是肝脏Vtg产生的主要调控者,而我们发现在斑马鱼肝脏中Ar的存在,对雌激素信号通路调控肝脏Vtg合成也是必需的,只是其相关机制尚未在本研究中得以探明。
Ar缺乏导致的肝脏Vtg生成缺陷进一步支持了ar-/-雌鱼卵巢营养成分的改变(图4)。已有报道指明类胡萝卜素在卵巢发育中起着至关重要的作用[9,11,13],而ar-/-雌性卵巢中脂质和类胡萝卜素含量显著降低,因此,Vtg的合成障碍的确影响了ar-/-的卵巢中营养组分,从而导致发育受损和卵母细胞成熟。
3.3 ar敲除影响卵巢发育相关基因表达
性腺发育是一系列复杂的发育过程,一系列的关键基因的依序和适当地表达是必需的。例如,gata4被认为是调节小鼠性腺发育的因子,在颗粒细胞中表达并促进其增殖[33]。在人类和大鼠中,NR5A1与性腺中的Gata4蛋白相互作用,激活amh的启动子,促进性腺发育。而在斑马鱼中,nr5a1a的表达又需要amh,所以这3个基因很可能形成了一个反馈的通路[17,34,35]。insl3是卵母细胞成熟的关键基因,在小鼠中,核受体Nr5a1被认为是调节insl3启动子的第一个转录因子[36,37]。随后在小鼠和人中发现了新的insl3启动子调控因子Nr4a1[18]。虽然糖皮质激素在卵巢生长中的作用尚未得到证实,但糖皮质激素在卵母细胞成熟过程中也表现出活性,有两种酶参与到皮质醇和可的松的转化[38,39]。在此方面,羟类固醇11-β脱氢酶2(Hydroxysteroid 11-beta dehydrogenase 2,Hsd11b2)是参与此过程的两种酶之一,可将皮质醇转化为可的松[40]。我们的研究结果显示,与对照组相比,ar-/-雌鱼卵巢中nr4a1、gata4、nr5a1a和hsd11b2的转录水平显著下调(图5)。这表明,ar-/-雌鱼中与卵巢发育相关的许多关键基因的转录表达模式都受到ar缺乏的显著影响,而卵巢营养成分的缺陷则可能是造成这些卵巢发育障碍的原因,或者是其中的原因之一(图4)。
4 结论
基于已观察到的斑马鱼ar敲除模型上卵巢发育不良的表型,我们开展了进一步的探索。本项工作研究了 Ar缺乏对斑马鱼卵巢发育的影响,发现在ar-/-雌鱼肝脏中的Vtg生成受到抑制,因此揭示了Ar对雌鱼肝脏Vtg生成的调控,至少是Ar调控斑马鱼卵巢发育和成熟的重要信号之一,对该信号通路在卵巢发育方面的影响,我们加以简单概况(图6)。值得注意的是,本研究发现了ar与肝脏卵黄蛋白原形成之间的联系,对探索ar基因功能提供了一个新的视角,但是,ar如何具体调控雌激素信号通路还需要更多深入研究。

图6 ar通过影响肝脏Vtgs的产生来调节卵黄发生和卵母细胞成熟Fig. 6 ar regulates vitellogenesis and oocyte maturation via its effects on hepatic Vtg production
