食物相铬在豹纹鳃棘鲈鱼不同脑区的生物累积
2022-09-13郭志强
李 钰 郭志强 韩 冬 韦 露
(1. 南方海洋科学与工程广东省实验室(湛江),湛江 524025;2. 海南大学生命科学学院,南海海洋资源利用国家重点实验室,海口 570228;3. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072)
随着工业污染的加剧,电镀、钢铁生产、阳极氧化浴、木材防腐和皮革制造等[1]活动导致重金属铬不断进入环境,铬(Cr)已经成为环境中常见的污染物之一。Cr可以通过食物链富集,环境中铬 (Cr)浓度的升高具有较高的风险,严重威胁着生态系统安全[1—4]。Cr稳定的价态通常为Cr(Ⅲ)和Cr(Ⅳ)[2,3]。Cr(Ⅵ) 即使在较低浓度下也会对水生生物产生神经、遗传、生殖和环境等多种急性和慢性的毒性作用[5—7]。并且,Cr作为一种不可被细菌降解的金属累积污染物,由于其在生物体中的累积能力而对水生生物的健康问题造成毁灭性的危害[8—10]。Cr会对海洋生物的代谢产生显著影响,如尼罗罗非鱼(Oreochromis niloticus)和南美白对虾(Litopenaeus vannamei)的Cr暴露研究中都证明了Cr (Ⅵ)其对海洋生物的潜在毒性[11,12],此外,食物相三价Cr暴露被证明对豹纹鳃棘鲈(Plectropomus leopardus)脂代谢有显著的毒性影响等[13]。
尽管在肝脏、肾脏和肠等各种内脏器官中,Cr对鱼类的毒性已得到广泛研究[11,13—15],但对鱼类神经系统的重要器官大脑的报道却很少。而且,关于重金属对鱼脑的毒性仍仅限于少数研究,如斑马鱼(Danio rerio)在1.0 mg/L的CdCl2中暴露16d后,鱼脑中Cd明显累积量,神经组织形态发生显著改变[16]。金属汞对鱼脑有神经退行性损害,包括感觉能力障碍[17]、脂质过氧化损伤[21]、脑坏死病变及行为改变[18]。现有的研究报告了金属毒性剂可能损害鱼类中枢神经系统,导致鱼的攻击性行为[19,20]。此外,Mieiro等[22]发现鱼脑在生物放大过程中的重要作用,揭示其在环境风险评估中的重要性。
鱼脑结构与其功能密切相关,同种金属不同情景下在鱼脑中的毒性累积量数据有助于评估Cr污染食物诱导的神经毒性。考虑到金属不同形态及价态在对鱼类生理影响的差异,不同形态及不同价态Cr对海洋硬骨鱼类脑部造成危害的差异目前尚不清楚,尤其是对不同的脑区带来的差异,因此研究有机Cr、无机Cr(三价和六价)在鱼脑的累积十分重要。豹纹鳃棘鲈幼鱼对环境变化敏感,易受到重金属污染物威胁(如Cr),人类活动导致其野生资源下降,已被列入《濒危物种红色名录》[23]。为了研究Cr摄入在鱼类大脑不同脑区的累积差异,以及区别不同Cr形态在鱼类脑部的累积差异,本研究以豹纹鳃棘鲈幼鱼为研究对象,探究食物相Cr暴露对其大脑的慢性累积效应。在食物相中添加不同浓度(0、10、50和250 mg/kg)的有机Cr[以吡啶甲酸Cr(CrPic)的形式]和无机Cr[以 CrCl3(Cr(Ⅲ)) 和K2Cr2O7(Cr(Ⅵ))为例]制成的10种饲料对海水幼鱼豹纹鳃棘鲈幼鱼的生物累积,该豹纹鳃棘鲈幼鱼在饲养66d期间,于不同时间点收集大脑不同脑区样品,利用原子吸收分光光度法[Atomic absorption spectrometry (AAS) ]测得金属 Cr 在豹纹鳃棘鲈幼鱼4个不同脑区的分布特征,即下丘脑、前脑、中脑和后脑。研究为进一步研究食物中的重金属对中枢神经系统的作用及涉及的各种毒理机制奠定基础。
1 材料与方法
1.1 含铬饲料制备
本研究选择3种典型的铬化合物: 吡啶甲酸铬(C18H12CrN3O6,纯度≥98%),氯化铬(CrCl3·6H2O,纯度≥ 99%)和重铬酸钾(K2Cr2O7,纯度 ≥ 99.5%),购买自中国上海Sigma-Aldrich贸易有限公司(https://www.sigmaaldrich.cn/CN/zh)。商业饲料购自中国山东省海通生物科技饲料有限公司。 在日粮中添加的Cr源化合物的浓度分别为10、50和250 mg/kg,在商业饲料基础上分别添加低、中、高浓度的CrPic、Cr(Ⅲ)、Cr(Ⅵ)(Sigma-Aldrich)形成处理饲料,处理Cr含量的实测值见表1。处理组中Cr添加量根据实验室前期的数据和已经发表的研究来决定的[24—26]。通过将商业日粮粉碎并分别与3种Cr化合物按浓度梯度混合,商业饲料和CrPic、Cr(Ⅲ)、Cr(Ⅵ)分别研磨并充分混合,然后用直径为3 mm的实验室压缩机压碎,粉碎后的实验用饲料在60℃烘箱下干燥,干燥后储存在-20℃备用。
1.2 实验材料与食物铬暴露
豹纹鳃棘鲈幼鱼[体重(15.5±1.8) g,平均值±标准误差,n=300]购自蓝海水产养殖场(陵水,海南,中国),该实验用鱼被暂养在实验室水族箱(0.8 m ×0.6 m × 0.6 m)两周驯化以适应环境[11],驯化过程每天喂养商业饲料2次。实验室水质条件: 总Cr浓度<0.045 mg/L,溶解氧5.5—7.4 mg/L,pH 7.3—8.4,水温28.5—29.7℃,光周期12h。
豹纹鳃棘鲈幼鱼在适应2周后,随机分为对照组和处理组,每个处理组又各分为3组不同浓度:10、50和250 mg/kg,共10组: 对照组(Control)、饲料添加有机铬处理组(CrPic10、CrPic50和CrPic250)、饲料添加无机三价铬处理组[Cr(Ⅲ)10、Cr(Ⅲ)50和Cr(Ⅲ)250]、饲料添加无机六价铬处理组[Cr(Ⅵ)10、Cr(Ⅵ)50和Cr(Ⅵ)250)。每组有3个平行,每组18条鱼,每个平行有6条鱼放在一个鱼缸里。在对照组中,豹纹鳃棘鲈幼鱼喂养商业饲料[商业饲料总Cr浓度为(2.21±0.14) mg/kg,这是Cr的基线水平浓度,表1],9个处理组饲喂相对应的Cr处理饲料。实验喂养期间,每天换水6次,每次用新鲜的过滤后的海水代替1/3水箱中的海水,水中总Cr浓度<0.045 mg/L。在饲养期间,分别在7d、12d、18d、40d和66d,同时对实验组和对照组进行取材,对豹纹鳃棘鲈幼鱼实施安乐死并在冰上操作,快速分离豹纹鳃棘鲈幼鱼大脑4种脑区组织(下丘脑、前脑、中脑和后脑),迅速在液氮中冷冻备用。
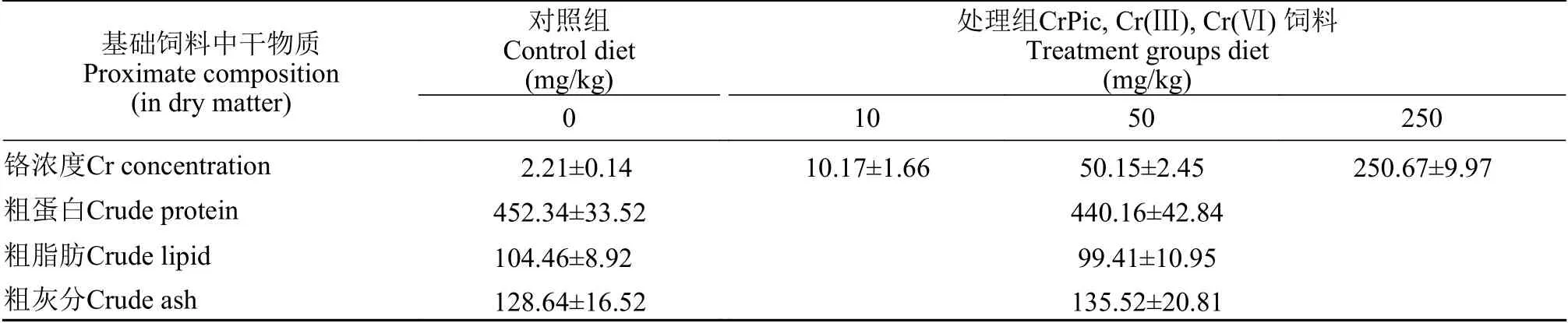
表1 饲喂幼年豹纹鳃棘鲈幼鱼的饲料配方表(平均值±标准差,n=3)Tab. 1 The proximate composition of diets (mg/kg) fed to the juvenile coral trout (P. leopardus;mean±SD,n=3)
1.3 生长指标的计算
以鱼体重4%标准进行投喂的饲料,随着鱼体重的增长,饲料的投喂量也随着增加,因此,投喂实验结束(第66天),鱼初始体重为(15.5±1.8) g,总摄食量WF以及终末体重为如表2所示。

表2 总摄食量以及终末平均体重表Tab. 2 Total food intake and final mean weight (n=6)
在试验开始及结束时分别将鱼饥饿24h后,使用电子天平称量鱼体质量(MP200B型电子天平,精确至0.01 g),并按下式进行各项摄食生长指标的计算[26]:

式中,W0和Wf分别为试验初始和终末时的鱼体质量(g);WF为总摄食量(g);t为试验时间(d)。
1.4 重金属含量的测定方法(AAS)
将液氮保存的组织样品取出放置室温,随后在60℃烘箱干燥48h,将样品(干重: 0.06—0.1 g)在1 mL的HNO3(69%,超纯,Fisher Scientific,Geel,比利时)中电热板内60℃消解48h,样品干重和浓HNO3的质量比为1 g∶10 mL,用含1%硝酸的dH2O梯度稀释至10 mL,消化后,将样品用去离子水稀释100倍。标准曲线由购自国标(北京)检测认证有限公司的标准样品Cr(1000 μg/mL)绘制。样品中总Cr的浓度采用原子吸收分光光度法(AAS-Y193S)计算(AAS-Y193S-2003005,AA-3600型,上海Metash Instruments Co.,Ltd.)。在分析过程中,每30个样品分析一次标准曲线。对每个样品进行2次分析测量,结果以μg/kg表示。每批样本(30个/批)均含试剂空白和标准品,所有处理组均有3个平行性试验,数据的质量得以保证,其中Cr背景值以对照组为参考(表3)。
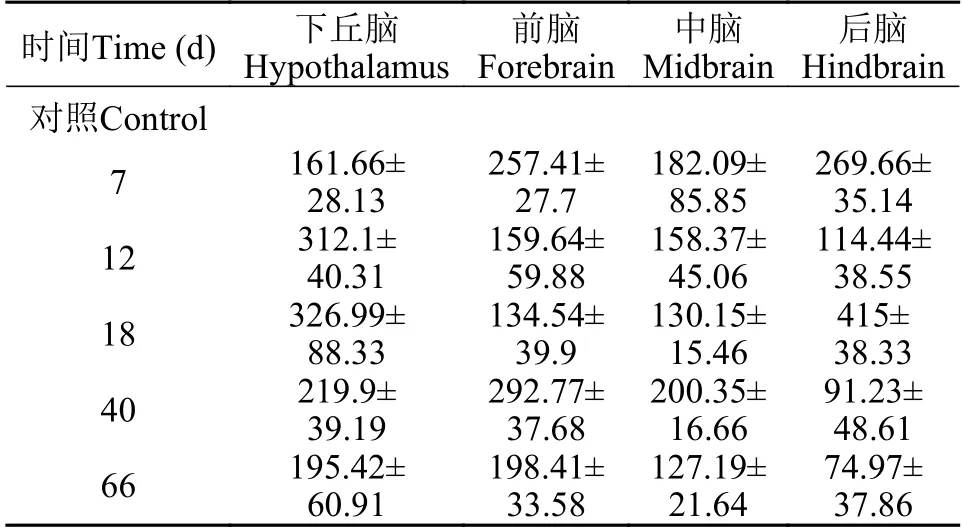
表3 幼年豹纹鳃棘鲈幼鱼不同脑区Cr含量的背景值(μg/kg,干重)Tab. 3 Total Cr concentration (mg/kg,dry weight) in different brain sections of juvenile coral trout (μg/kg,dry weight)
1.5 数据分析
本研究的数据处理、多元统计分析和作图主要运用IBM SPSS Statistics 19、Origin 8.0、Graph-Pad Prism 8.0 (https://www.graphpad.com/)和Excel 2010等软件完成。所有实验数据均显示为平均值±标准差(Mean±SD),首先用Kolmogorov-Smirnov检验数据的正态分布性和用Levene’s检验数据的同质性,然后通过单因素方差分析(One-Way ANOVA)分析各实验铬源处理组之间重金属的生物累积量的差异,如果P<0.05,则为显著差异;如果P<0.01,则为极显著差异;如果P>0.05,则为差异不显著。
2 结果
2.1 不同食物相铬豹纹鳃棘鲈幼鱼摄食、生长和饲料利用的影响
由图1可知,经过66d的饲养,各组豹纹鳃棘鲈幼鱼的摄食率相似,即该实验保证了各组摄食基本相似,也保证了不同铬源在摄入量上的一致。
图1 食物相铬[CrPic、Cr(Ⅲ)、Cr(Ⅵ)]对豹纹鳃棘鲈幼鱼摄食的影响Fig. 1 Effect of food intake of juvenile coral trout under dietary Cr [CrPic,Cr(Ⅲ),Cr(Ⅵ)] exposure
如图2所示,经过66d的饲养,发现投喂不同形式的铬源的确对豹纹鳃棘鲈幼鱼的生长以及饲料利用产生了一定的影响。值得注意的是,尤其是有机三价铬(CrPic)与无机三价铬(Cr(Ⅲ))组的变化相似,都在10 mg/kg时低于对照组,在250 mg/kg时高于对照组。无机六价铬(Cr(Ⅵ))组的特定生长率与饲料转化效率随着浓度的增加而降低。

图2 食物相铬[CrPic、Cr(Ⅲ)、Cr(Ⅵ)]暴露对豹纹鳃棘鲈幼鱼生长及饲料利用的影响Fig. 2 Effect of Specific growth rate and food conversion efficiency of juvenile coral trout under dietary Cr [CrPic,Cr(Ⅲ),Cr(Ⅵ)]exposure
2.2 总铬在豹纹鳃棘鲈幼鱼下丘脑组织的生物累积
由图3可知,在有机铬CrPic、无机铬Cr(Ⅲ)和无机铬Cr(Ⅵ) 处理下,豹纹鳃棘鲈幼鱼下丘脑的总铬含量随着摄食时间的增加,基本呈先升后降的趋势,分别在18d、12d和66d达顶峰;随着饲料中CrPic、Cr(Ⅲ)和Cr(Ⅵ)浓度的增加基本呈上升的趋势(图3)。铬累积量最大值出现在250 mg/kg浓度,在此浓度下,CrPic、Cr(Ⅲ)和Cr(Ⅵ)处理组中累积量达最大值分别为1159.41(18d)、598.91(12d)和827.92 μg/kg(40d)。此外,总铬累积量在所有CrPic处理下的最小值为135.55 μg/kg (10 mg/kg,40d),在无机Cr(Ⅲ)和Cr(Ⅵ)处理下的最小值分别为212.08 μg/kg(10 mg/kg,7d)和157.12 μg/kg(250 mg/kg,7d)。
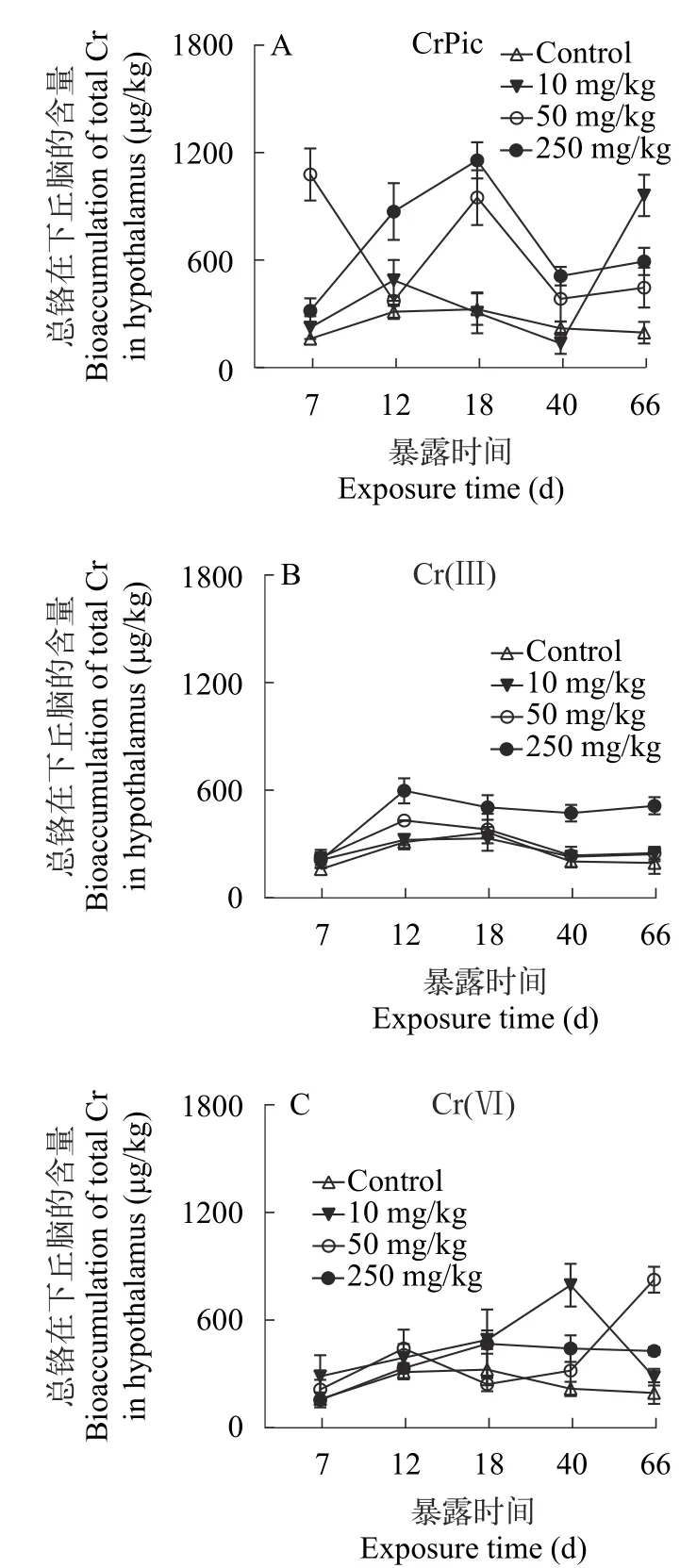
图3 食物相CrPic,Cr(Ⅲ)和Cr(Ⅵ)暴露下幼年豹纹鳃棘鲈下丘脑的总铬含量Fig. 3 The time-course total Cr concentration (μg/kg,dry weight)in hypothalamus of juvenile coral trout under dietary CrPic (A),Cr(Ⅲ) (B),and Cr(Ⅵ) (C) exposure.
2.3 总铬在豹纹鳃棘鲈幼鱼前脑组织的生物累积
由图4可知,在有机铬CrPic处理下,豹纹鳃棘鲈幼鱼前脑的总铬含量随着摄食时间的增加,基本呈先降后升的趋势;且随着饲料中CrPic浓度的增加而增加,最高值为894 μg/kg(250 mg/kg,40d),最低值为214.88 μg/kg(10 mg/kg,12d;图4A)。然而,在无机铬Cr(Ⅲ)处理下,总铬在前脑组织的含量并未随着摄食时间的增加而增加,且随着Cr(Ⅲ)浓度增加,其波动幅度也较小,最大值为604.71 μg/kg(50 mg/kg,40d),最小值为119.85 μg/kg(50 mg/kg,12d;图4B)。在无机铬Cr(Ⅵ)处理下,总铬在前脑组织的含量总体上随着摄食时间呈先升后降的趋势,且属于非浓度依赖型,最大值为601.04 μg/kg(250 mg/kg,12d),最小值为199.95 μg/kg(10 mg/kg,18d;图4C) 。
2.4 总铬在豹纹鳃棘鲈幼鱼中脑组织的生物累积
由图5可知,在有机铬CrPic、无机铬Cr(Ⅲ)和无机铬Cr(Ⅵ) 处理下,豹纹鳃棘鲈幼鱼中脑的总铬含量随着摄食时间的增加,基本呈先升后降的趋势,都在40d达峰值(图5)。随着饲料中CrPic浓度的增加基本呈上升的趋势,最大值达884.26 μg/kg (250 mg/kg,40d;图5A);在Cr(Ⅲ)和Cr(Ⅵ)处理下,在40d时总铬累积量随着饲料中Cr(Ⅲ)和Cr(Ⅵ)浓度的升高而下降,最大值分别为700.66 μg/kg (10 mg/kg,40d)和903.51 μg/kg (10 mg/kg,40d)。此外,总铬累积量在所有CrPic处理背景下的最小值为49.04 μg/kg (10 mg/kg,12d),在无机Cr(Ⅲ)和Cr(Ⅵ)处理背景下的最小值分别为71.03 μg/kg(10 mg/kg,18d)和104.48 μg/kg(250 mg/kg,7d)。
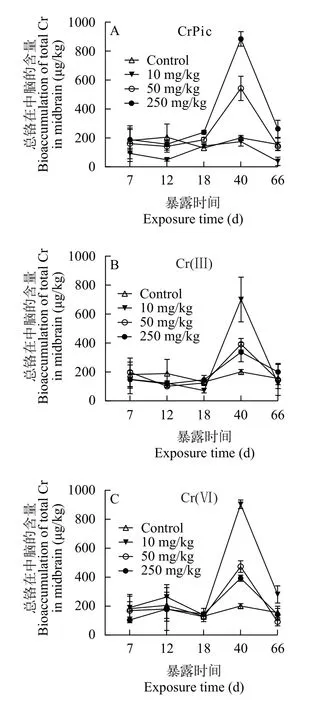
图5 食物相CrPic,Cr(Ⅲ)和Cr(Ⅵ)暴露下幼年豹纹鳃棘鲈中脑的总铬含量Fig. 5 The time-course total Cr concentration (μg/kg,dry weight)in midbrain of juvenile coral trout under dietary CrPic (A),Cr(Ⅲ)(B),and Cr(Ⅵ) (C) exposure
2.5 总铬在豹纹鳃棘鲈幼鱼后脑组织的生物累积
由图6可知,在有机铬CrPic 处理下,豹纹鳃棘鲈幼鱼后脑的总铬含量随着摄食时间和饲料浓度的增加,呈不规律的波动状态,最大值为1131.05 μg/kg(10 mg/kg,40d;图6A)。但是,在Cr(Ⅲ)和Cr(Ⅵ)处理背景下,总铬累积量随着摄食时间的增加,呈先升后降的趋势,分别在18d和40d达峰值;并且随着饲料浓度的增加,铬累积量也增加,最大值分别为726.81 μg/kg (250 mg/kg,18d)和2155 μg/kg (250 mg/kg,40d;图6B和6C)。此外,总铬累积量在所有CrPic处理背景下的最小值为87.99 μg/kg (10 mg/kg,66d),在无机Cr(Ⅲ)和Cr(Ⅵ)处理背景下的最小值分别为93.94 μg/kg(10 mg/kg,40d)和176.99 μg/kg(10 mg/kg,7d)。
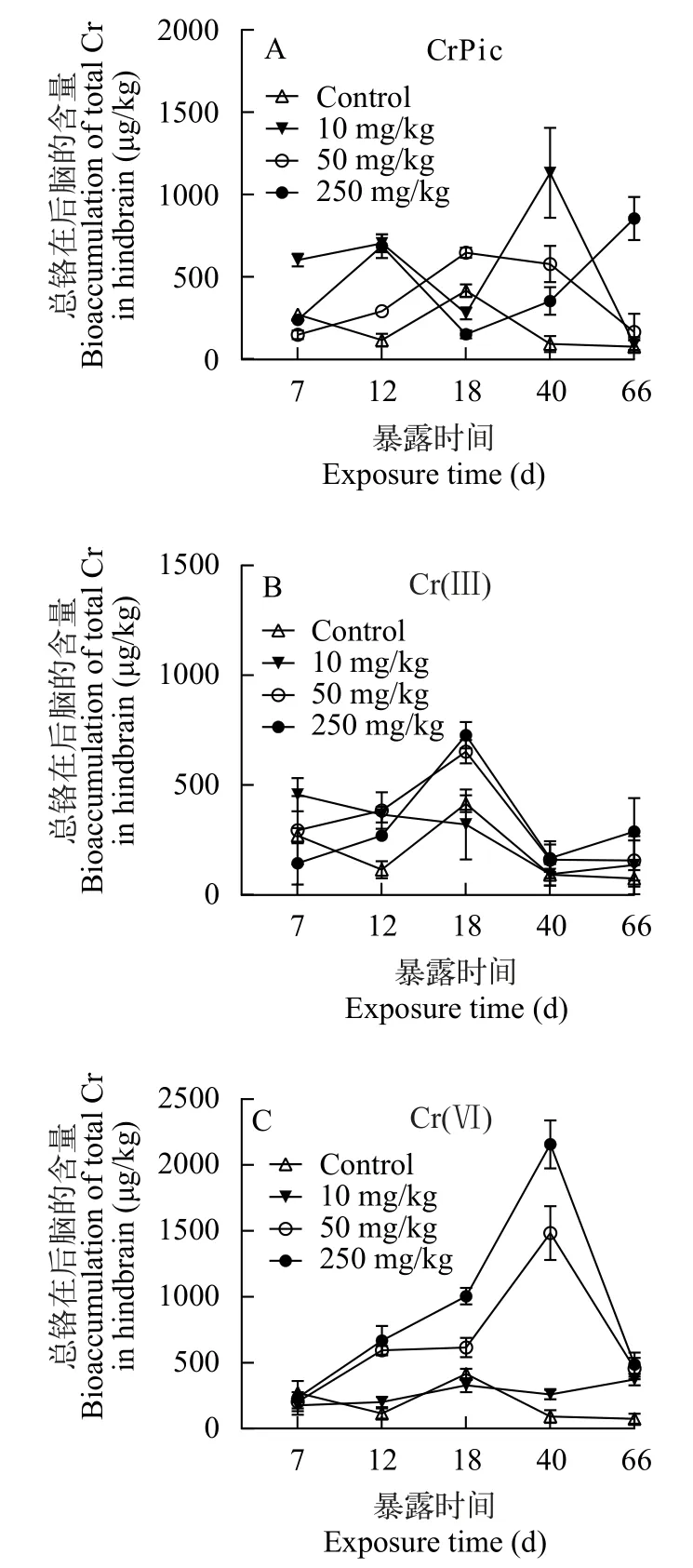
图6 食物相CrPic、Cr(Ⅲ)和Cr(Ⅵ)暴露下幼年豹纹鳃棘鲈后脑的总铬含量Fig. 6 The time-course total Cr concentration (μg/kg,dry weight)in hindbrain of juvenile coral trout under dietary CrPic (A),Cr(Ⅲ)(B),and Cr(Ⅵ) (C) exposure
3 讨论
3.1 不同食物相铬对豹纹鳃棘鲈幼鱼生长的影响
本次研究发现,食物相CrPic、Cr(Ⅲ)和Cr(Ⅵ)在保证相同摄食暴露下对幼年豹纹鳃棘鲈的生长及饲料利用率产生了一定的影响。这可能是由于其作为三价铬的葡萄糖耐量因子(GTF)对豹纹鳃棘鲈幼鱼起到的促进生长作用[13]。而高浓度的无机六价铬(Cr(Ⅵ))对于豹纹鳃棘鲈幼鱼的生长及饲料利用率起到的抑制作用,这可能是由于六价铬的强氧化性、致癌及突变性[4],导致幼鱼的生长被抑制。
对于鱼类大脑中的食物来源的金属的累积,本文首次尝试探索海水鱼豹纹鳃棘鲈大脑对同一金属不同浓度、不同价态和不同形态之间含量的比较。并且,最重要的是,本文第一次将食物来源的金属Cr在鱼类大脑的累积进行细分(为4个不同大脑区域,即下丘脑、前脑、中脑和后脑。我们的研究表明,食物中不同铬源在不同脑区的累积差异很大,具有高度组织差异性,主要累积区域集中在后脑(图4),但并无明显的剂量效应或时间效应。本文首次发现食物中金属Cr在海水鱼类不同脑区对Cr的累积具有选择性。大多数关于铬的神经毒性的研究都集中于哺乳动物身上[3,27],在水生动物如鱼类的研究很少[2,28]。并且,通过食物途径研究金属在鱼类大脑不同脑区累积的报道基本没有,仅仅发现Mieiro等[29]2010年报道低剂量的食物中甲基汞可以引起三文鱼脑的氧化还原防御,即诱导SOD活性增加。
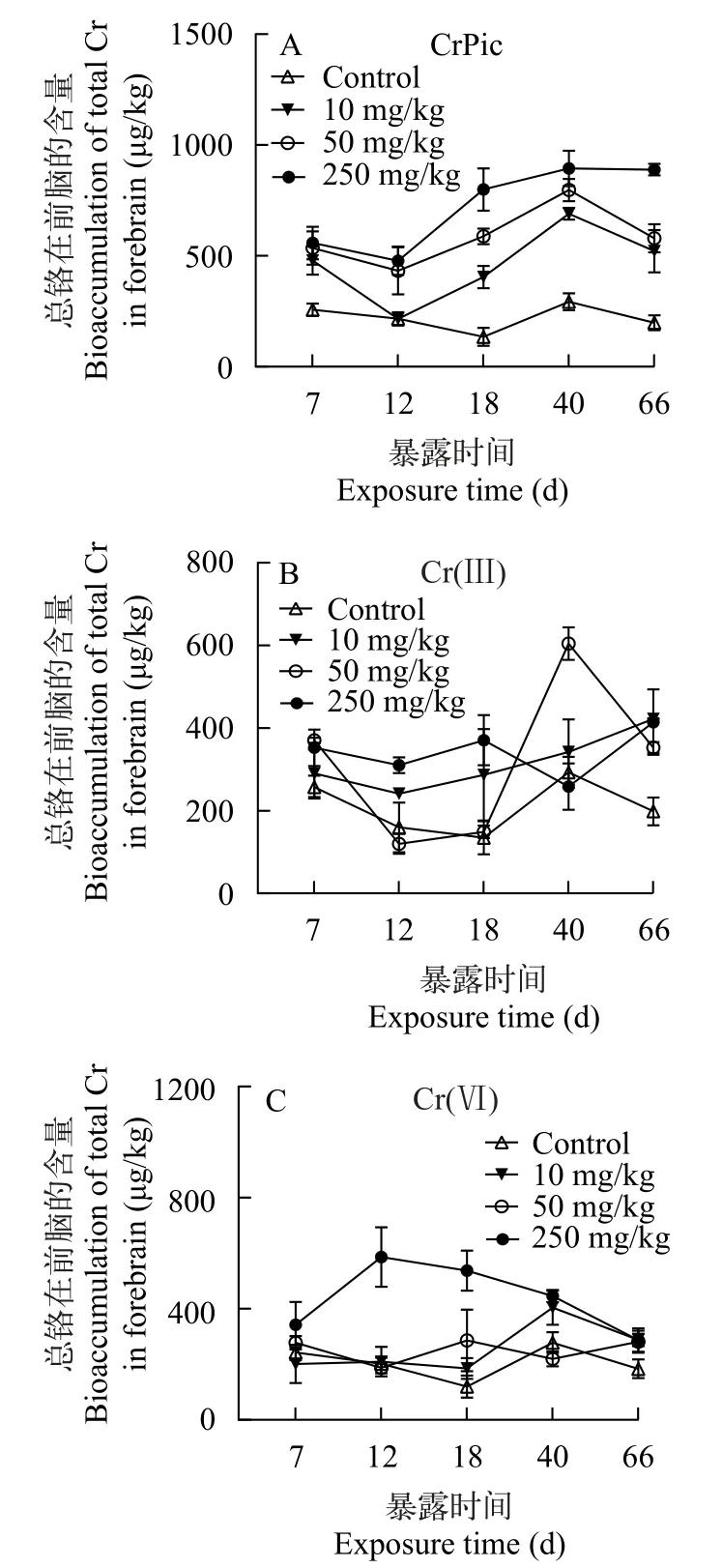
图4 食物相CrPic,Cr(Ⅲ)和Cr(Ⅵ)暴露下幼年豹纹鳃棘鲈前脑的总铬含量Fig. 4 The time-course total Cr concentration (μg/kg,dry weight)in forebrain of juvenile coral trout under dietary CrPic (A),Cr(Ⅲ)(B),and Cr(Ⅵ) (C) exposure
3.2 不同形态食物相铬对豹纹鳃棘鲈幼鱼不同脑区的影响
此外,值得注意的是,食物中有机铬和无机铬源的金属Cr在不同脑区之间的累积含量存在明显差异。有机铬CrPic的生物富集在下丘脑、前脑或中脑累积呈现了一定的规律性,在后脑中没有规律,但各时间段的累积量整体高于中脑(图1—3)。下丘脑和前脑会随着食物相CrPic浓度增加,Cr含量也随之增加,两种脑区之间的食物Cr累积观察到相似的差异(图1A和图2A)。另外,对于无机铬的生物富集,则是中脑或后脑比较敏感(图3)。值得注意的是,中脑随着饲料中CrPic浓度的增加基本呈上升的趋势。但是,在Cr(Ⅲ)和Cr(Ⅵ)处理背景下,不属于浓度依赖型,且在40d时,随着饲料中Cr(Ⅲ)和Cr(Ⅵ)浓度的升高,总铬累积量反而下降(图3),这可能是机体尤其是脑部在面对过量铬的威胁时,会产生一定的排除机制,当铬在体内的排除量大于累积、吸收量时,总铬累积量就会呈现下降的趋势。这和Yin等[30]的研究结果相似,他们发现在0—14d的Cr6+暴露实验中,鳙(Aristichthys no-bilis) 10种组织中肾脏、皮肤和心脏这3种组织出现铬含量下降的情况;在14—28d的排出净化实验中,8/10的组织已累积的铬含量也呈现下降趋势。然而,后脑对食物相Cr(Ⅲ)和Cr(Ⅵ)的累积,基本随着食物铬浓度的增加而增加;并且随着摄食时间的延长表现出先升后降的趋势(图4B—C)。另外还发现,在所有脑区中,总铬含量在有机铬CrPic饲料下波动较大,而在无机Cr(Ⅲ)和Cr(Ⅵ)饲料下较为稳定,通常为累积峰值在有机铬是无机铬的2倍,可能是有机铬比无机铬更容易积蓄在体内[14,15]。目前,基本没有研究报道重金属的不同形态对鱼类大脑不同脑区的累积情况,本研究第一次提出在食物相金属累积方面,有机铬和无机铬在不同脑区表现出不同的累积特征。
3.3 不同价态食物相铬对豹纹鳃棘鲈幼鱼不同脑区的影响
食物中不同价态的金属在食物途径中在组织中的累积具有差异性。本研究中无机Cr(Ⅲ)和Cr(Ⅵ)的金属Cr在不同脑区之间的累积含量存在明显差异。在Cr(Ⅲ)食物相处理下总铬易在前脑和中脑产生生物富集,尤其是食物相低浓度的Cr(Ⅲ)处理下,最高值出现在50和10 mg/kg(图2—3)。在Cr(Ⅵ)食物相处理下总铬易在后脑产生生物富集,最高值出现在250 mg/kg(图4)。目前,基本没有研究报道重金属的不同价态对鱼类大脑不同脑区的累积情况,本研究第1次提出在食物相金属累积方面,无机铬三价和六价在不同脑区表现出不同的累积特征。
尽管已经有人发现海水鱼的大脑是食物中Cr(Ⅵ)累积的重要影响组织之一[31],在其他金属如Hg、Cd也有报道[16,32]。但是在前人所述的研究中,还未发现将大脑进行细分,只是对大脑的超微结构进行初步的研究。最新发现,对大脑的电镜观察,发现在斑马鱼中,水中高Cd暴露会诱导大脑组织发生改变。这种变化主要出现在神经的顶盖、心室和延髓,具体表现为线粒体肿胀、嵴的消失等特征,表明了细胞受损,机体表现出的防御机制[33]。在鱼类中,镉Cd在肠道中的累积很显然会通过血液循环系统主动转移到血液中,从而可以通过血脑屏障积聚在大脑中。尽管已经报道鳃是水途径中重金属累积的第一个存储靶器官[34],但是大脑也会遭到攻击,大脑中Cd水平反映出虹鳟的肾脏和肝脏中暴露时间的延长[35]。此外,一项关于直接Cd污染对斑马鱼基因表达影响的比较研究表明,在Cd水相暴露后,鳃的生物累积最高,其次是肝脏,最后是大脑[36]。
因此,与任何以往的研究相比,本文第1次报道了同一金属铬的不同形态、不同价态、不同浓度、不同时间处理下,对海水鱼类大脑细分出的4个不同脑区(下丘脑、前脑、中脑和后脑)进行金属元素铬的累积测定,第1次得出食物相金属在海水鱼类不同脑区的累积差异,随着时间和浓度变化表现出各自独特的累积特征。这些结果表明,金属元素铬对豹纹鳃棘鲈幼鱼大脑不同脑区的损伤程度是不同的,与金属的剂量、形态、价态及刺激的时间长短有关。
4 结论
本文研究了豹纹鳃棘鲈幼鱼摄食3种铬源[CrPic、Cr(Ⅲ)和Cr(Ⅵ)]各3种浓度(10、50和250 mg/kg)的饲料下饲喂66d,首次分析了食物相金属Cr在海鱼4个不同脑区组织在不同摄食时间和不同饲料浓度的累积情况,即下丘脑、前脑、中脑和后脑。本研究主要发现食物源铬Cr累积在大脑不同脑区具有组织差异性,说明同一金属对同个组织不同部位的累积选择具有偏好性。下丘脑、前脑或中脑对食物相来源的有机铬比无机铬敏感。另外,对于食物中无机铬Cr(Ⅲ)和Cr(Ⅵ)铬的生物富集,则是后脑比较敏感。在所有食物相铬源背景下,铬累积量随时间先升后降的特征在中脑表现最明显。我们的研究丰富了食物来源的金属对水生生物神经系统毒性的认识,为进一步研究食物中的重金属对中枢神经系统的作用及涉及的各种毒理机制奠定基础。
