五价砷胁迫处理对普通小球藻的急性毒性效应
2022-09-13李立杰余佳妮谭凤霞
李立杰 彭 梦 杨 帆 余佳妮 金 巍 谭凤霞 柴 毅
(1. 长江大学湿地生态与农业利用教育部工程研究中心,荆州 434025;2. 长江大学农学院/动物科学学院,荆州 434025)
砷(Arsenic,As)是全球水环境中毒性最强的重金属污染物之一,主要以As3+和As5+两种无机形式存在于水体中,其中As3+主要存在于地下水等还原性环境中,而As5+在河流和湖泊等氧化性环境中占主导地位[1]。毒性试验研究表明,As5+毒性比As3+毒性较弱,但As5+进入机体后经历一系列的还原和甲基化过程,导致产生其他毒性更强的产物,如As3+、有机单甲基(MMA)和二甲基(DMA)代谢物等,从而放大毒性,并且As5+在水环境中稳定性和含量均高于As3+[2],具有低剂量高毒性、难降解和生物富集放大等特征,其主要来源于地表径流和工业“三废”排放等途径[3]。近年来,我国水环境的As污染呈现出集中、多发的趋势,云南省阳宗海As浓度高达179.6 μg/L[4];长江中游江北平原和鄱阳湖平原浅层地下水As含量为0.65—956.72和0.09—267.45 μg/L[5];河南省大沙河As浓度为0.002—0.530 mg/L[6]。As的检测浓度均高于我国地表水环境质量标准0.05 mg/L,然而,这些As的风险评估仅依赖于总砷,这可能不适合于不同形式的As潜在风险评估[1]。研究表明As5+会显著影响浮游植物的群落演替,从而通过食物链间接影响水生生物[7],并且水体过量As5+会直接导致水生生物产生毒性效应,如改变运动行为、导致生长发育迟缓、影响生理生化和改变遗传基因表达等[8—11],给水生生物带来生态压力,同时As5+污染会在水生生物体内富集,并通过食物链传递[12],最终危害人类健康。因此,从生态毒理学的角度来看,开展基于不同价态的As浓度监测和水环境质量标准是非常迫切和必要的。
浮游植物(主要是微藻)是水域生态系统的初级生产者,也是环境污染物在食物链中富集的起点,其多样性和生物量直接影响着水生生态系统的结构和功能[13]。且大多数微藻结构简单、世代时间短和对环境敏感等特点。近年来,藻类作为水环境指示生物已被广泛应用于水安全评价和环境污染物检测中[14]。普通小球藻(Chlorella vulgaris)属绿藻门(Chorophyta),小球藻科(Chlorellaceae),小球藻属(Chlorella),分布广泛,可大量繁殖形成水华,也是富营养化水体的指示生物,是研究生态毒理学的经典生物学模型[15]。本研究以普通小球藻(Chlorella vulgaris)作为受试生物,探究As5+胁迫下普通小球藻的藻密度、Chl.a、抗氧化酶活性、活性氧自由基等指标的变化规律,揭示典型指示种普通小球藻在As5+环境胁迫中的生理生化反应,进一步探究重金属As污染对水生生物的致毒作用及机理提供理论参考,为水环境中重金属污染的修复及制定相关环境标准提供基础数据,进而实现水域生态系统的可持续发展与利用。
1 材料与方法
1.1 实验材料
藻种: 普通小球藻(Chlorella vulgaris,FACHB-2338)购自中国科学院水生生物研究所淡水藻种库(FACHB-Collection)。
As5+标准品(1000 mg/L)购自北京坛墨质检科技股份有限公司;其他试剂均为分析纯。
1.2 藻种扩培
普通小球藻在BG11培养基中培养,并在光照培养箱(GZX-250BSH-Ⅲ,上海新苗医疗器械制造有限公司)中进行扩大培养,培养条件: 温度为(25±1)℃,光暗比为12h ∶12h,光强为5000—8000 lx,每天摇动培养瓶3—4次,每隔1—2周转接,使藻类生长进入对数生长期。在整个培养过程,均经过灭菌处理。
1.3 五价砷对普通小球藻毒性效应
设置浓度梯度为0(对照组)、0.1、0.5、1、1.5和2 mg/L。选取处于对数生长期的普通小球藻藻液,离心3000×g下离心15min,蒸馏水重悬,再离心,重复3次,去除细胞表面吸附培养基营养盐,培养藻液体积为100 mL,初始藻密度为1×106cells/mL(初始A680=0.122),每组设3个重复,每天摇动培养瓶3—4次,试验周期为96h。
1.4 藻细胞密度测定
通过血球计数板进行藻细胞计数,并在波长680 nm下测定藻液光密度,建立不同藻细胞浓度和光密度之间的线性关系(y=84.8931x-0.3361,R2=1),实验中以测定的光密度根据线性方程计算出的藻细胞密度表示生物量,每24h在OD680检测各处理组和对照组藻培养液的吸光度。通过藻密度绘制生长曲线并计算抑制率I(%)。

式中,ACK指对照组的藻密度,AX指实验组的藻密度。
采用Graphpad Prism 8.0软件,使用非线性回归模型拟合浓度-响应曲线,计算IC50值和相关参数[16]。
1.5 叶绿素a(Chl.a)质量浓度测定
各浓度组取5 mL藻液,3000×g下离心15min,并用预冷的磷酸盐缓冲液(PBS;0.01 mol/L,pH=7.3)清洗3次,去除上清液,加入5 mL体积分数为95%的乙醇在75℃水浴锅中水浴3min。再次离心后用紫外分光光度计测定在665和649 nm处吸光度,并依据公式进行计算[17]
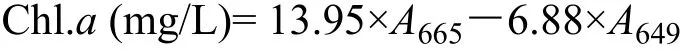
1.6 生理生化指标测定
暴露96h时取50 mL藻液离心3000×g下离心15min,PBS缓冲溶液重悬离心,重复3次,藻泥加入1 mL PBS和0.3 g氧化锆珠(R=0.05 mm),低温条件下在高效组织细胞破碎仪(Tissue Cell-distroyer D1000,湖北新纵科病毒疾病工程技术有限公司)破碎,5000×g下工作30s,间隙10s,重复3次,低温离心上清液为粗酶液。总抗氧化能力(T-AOC,A015-3-1)、总超氧化物歧化酶(T-SOD,A001-3)活性、三磷酸腺苷酶(ATP,A070-1)活性、丙二醛(MDA,A003-1)含量及总蛋白含量(TP,A045-2)用南京建成生物工程研究所相应的试剂盒进行测定。
1.7 活性氧自由基(ROS)和藻细胞膜通透性测定
活性氧自由基(ROS)测定采用DCFH-DA(2,7-Dichlorofuorescin Diacetate)探针法,南京建成生物工程研究所相应的试剂盒(E004-1-1)进行测定。
用二乙酸荧光素(Fluorescein Diacetate,FDA)法测定细胞通透性[14]。将5 mL的藻细胞悬液离心(12000×g,2min),用PBS洗涤3次,然后加入最终浓度为10 μg/mL的FDA。将悬液在室温黑暗条件下孵育30min,离心(12000×g,2min),用PBS洗涤3次。荧光样品用全自动酶标仪(SpectraMax iD3)检测,激发波长为488 nm,发射波长为530 nm。结果显示为荧光强度与藻细胞数的比值作为单个藻细胞通透性水平(对照组为1)。
1.8 透射电镜(TEM)超微结构分析
96h时,As5+胁迫2 mg/L处理组和对照组,藻液10 mL在3000×g下离心10min,藻泥弃去培养液加入电镜固定液(武汉百仟度生物科技有限公司,B0012)4℃固定2—4h,依次入50%—70%—80%—90%—95%—100%—100%乙醇脱水,每次15min,最后渗透、包埋、切片和染色,使用透射电子显微镜(TEM,日立,HT7800)下进行微观结构分析。
1.9 数据分析
实验数据为平均值±标准差(Mean±SD,n=3)表示,使用Graphpad Prism 8.0绘图和非线性曲线-最小二乘法回归分析,SPSS 20.0采用单因素(One-way Anova)和Duncan法进行方差分析和多重比较,与对照组相比具有统计学意义: *P<0.05,**P<0.01,***P<0.001。
2 结果
2.1 不同浓度As5+对普通小球藻藻密度的影响
由图1可知,在试验所设浓度梯度下,普通小球藻藻密度随As5+浓度及暴露时间的增加,均显著降低,普通小球藻在96h生长抑制最为严重,0.1、0.5、1、1.5和2 mg/L处理组抑制率分别达到了4.1%、6.9%、15.0%、32.0%和52.9%。通过非线性曲线-最小二乘法对As5+暴露浓度和各时间段普通小球藻生长抑制率进行拟合,得到拟合效应曲线(图1),A5+对普通小球藻96h-IC50为1.94 mg/L。
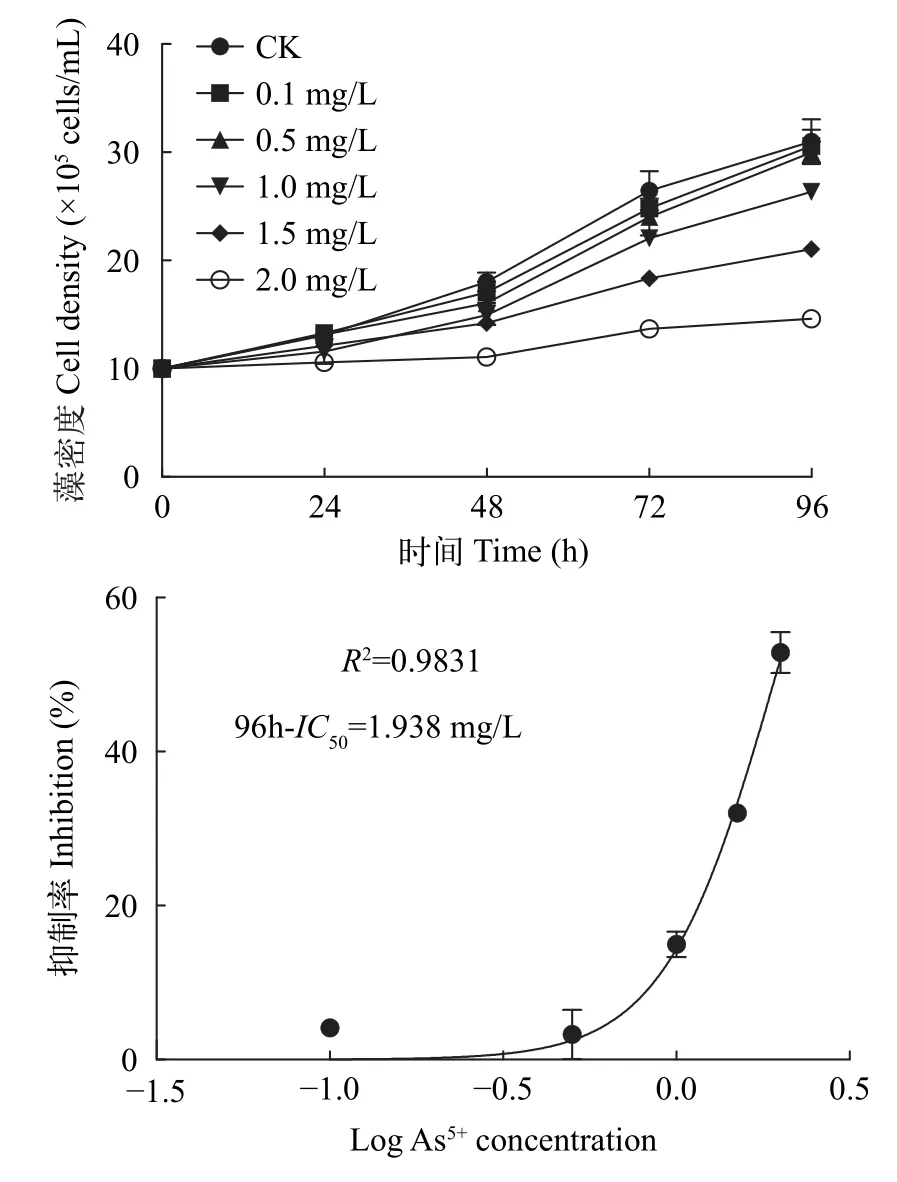
图1 As5+对普通小球藻生长的影响及各时间段抑制率曲线拟合Fig. 1 Effect of As5+ on the growth of C. vulgaris and curve fitting of inhibition rate in different time periods
2.2 不同浓度As5+对普通小球藻Chl.a的影响
由图2可知,As5+对普通小球藻Chl.a含量的影响与其对普通小球藻生长的影响呈现相似的变化规律,96h时,随暴露浓度的增加,Chl.a受到的抑制作用越强,表现出剂量-效应关系。0.1 mg/L处理组与对照组相比无显著性差异;0.5、1、1.5和2 mg/L处理组均表现出显著抑制,Chl.a含量分别下降了17.7%、26.6%、42.3%和68.6%。
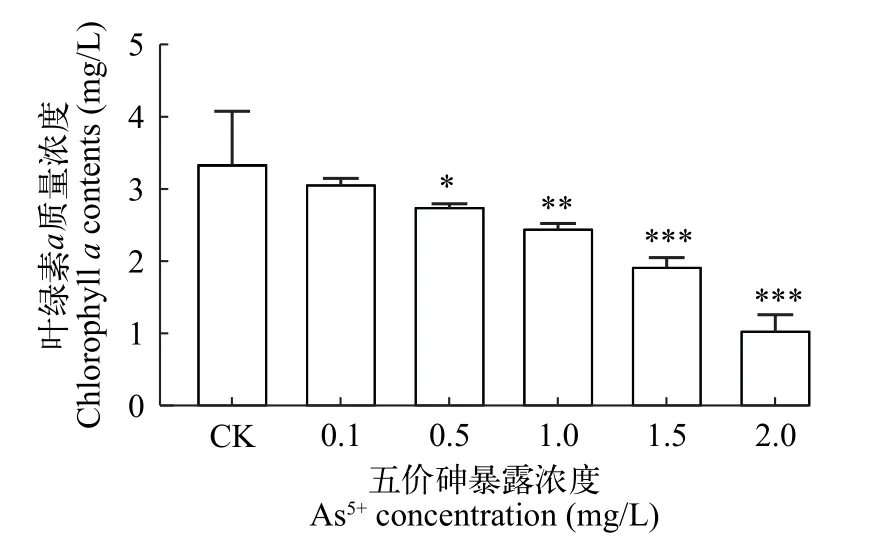
图2 As5+对普通小球藻叶绿素a的影响Fig. 2 Effect of As5+ on chlorophyll a content of C. vulgaris
2.3 不同浓度As5+对普通小球藻细胞膜通透性的影响
由图3可知,在不同浓度As5+处理96h后,单个藻细胞通透性水平随As5+浓度的增加呈显著升高趋势。0.1、0.5和1 mg/L处理组与对照相比无显著性差异;1.5和2 mg/L处理组通透性显著增加,分别为对照组的1.7倍和2.2倍。
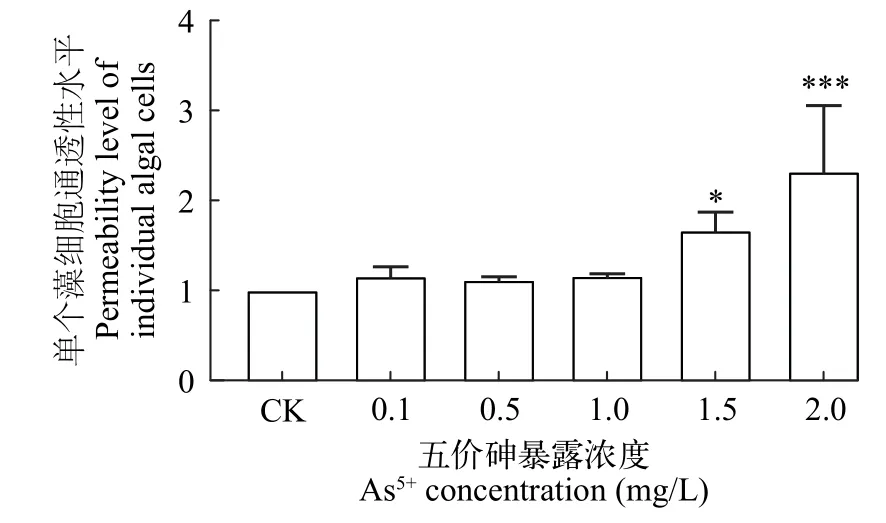
图3 As5+对普通小球藻细胞通透性水平的影响Fig. 3 Effect of As5+ on the permeability of C. vulgaris cells
2.4 不同浓度As5+对普通小球藻ROS和MDA含量的影响
由图4可知,在不同浓度As5+处理96h后,ROS和MDA含量均随暴露浓度的增加而递增。2 mg/L处理组ROS含量与对照组相比显著增加,为对照组的4.0倍。1、1.5和2 mg/L处理组MDA含量分别为对照组的1.6倍、2.0倍和2.6倍,呈显著性差异。
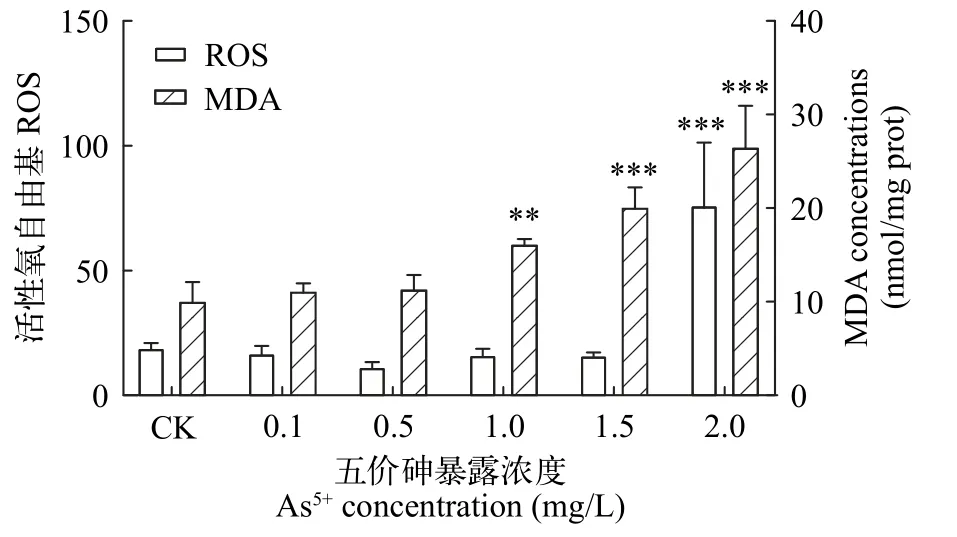
图4 As5+对普通小球藻ROS和MDA含量的影响Fig. 4 Effects of As5+ on ROS and MDA contents of C. vulgaris
2.5 不同浓度As5+对普通小球藻抗氧化酶和能量代谢的影响
As5+胁迫处理96h后,TP和ATP含量随暴露浓度的增加而降低,0.1、0.5和1 mg/L处理组与对照组相比无显著性差异,1.5和2 mg/L处理组呈显著降低,TP含量分别为对照组的68.4%和35.0%,ATP含量分别为对照组的60.6%和48.1%。T-AOC和T-SOD活性均随暴露浓度的增加而增加,0.1—1.5 mg/L处理组T-AOC和T-SOD活性与对照组相比没有显著性差异,而2 mg/L处理组T-AOC和T-SOD活性分别为对照组的2.8倍和1.6倍,呈显著性差异(图5)。
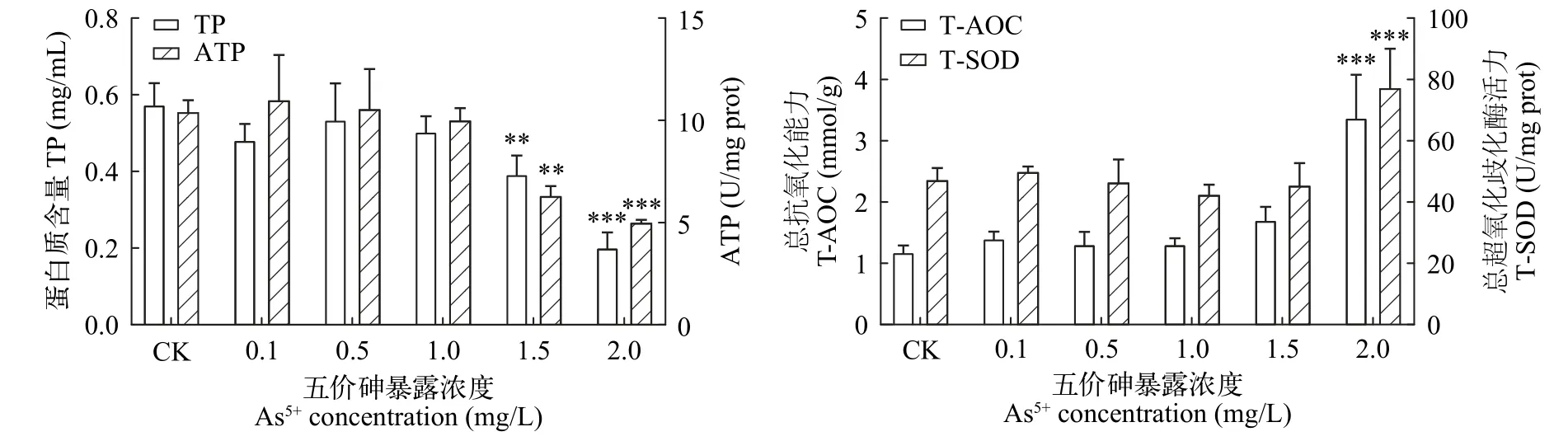
图5 As5+胁迫对普通小球藻TP、ATP、T-AOC和T-SOD含量的影响Fig. 5 Effects of As5+on the contents of TP,ATP,T-AOC and T-SOD in C. vulgaris
2.6 As5+胁迫对普通小球藻超微结构的影响
As5+胁迫96h后普通小球藻透射电镜(TEM)图观察如图6所示,对照组藻细胞形态完整,细胞器结构完好清晰可见,细胞壁和质膜结构紧密。暴露于As5+2 mg/L处理组藻细胞结构形态异常,胞质部分呈空泡化,类囊体片层结构模糊不清,部分溶解消失,叶绿体结构紊乱,仅蛋白核和淀粉鞘结构完好。
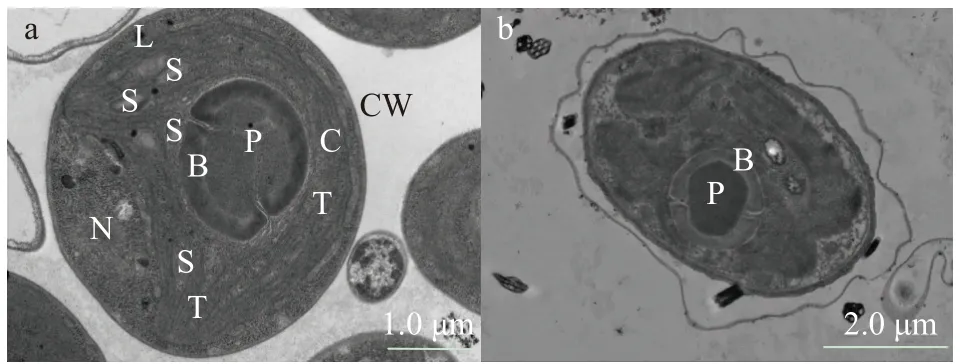
图6 As5+胁迫对普通小球藻超微结构的影响Fig. 6 Effects of As5+ stress on ultrastructure of C. vulgaris
3 讨论
重金属污染是全球水环境的主要问题之一,藻类作为水生生态系统的主要初级生产者,能够最大限度地将光能转化为有机能,对维持整个生态系统的平衡和稳定起着十分关键的作用,同时对栖息环境变化极为敏感,因而成为监测评价水环境质量的重要指标。在本研究中,不同浓度As5+胁迫下,普通小球藻生长均表现出抑制作用,抑制作用随浓度的增大和胁迫时间的延长而增强,说明抑制作用具有时间-剂量依赖性。通过非线性曲线拟合参数,As5+胁迫对普通小球藻96h-IC50为1.94 mg/L。李莉霞等[18]研究发现As5+对大型溞的96h-LC50为4.25 mg/L;Silva等[19]研究表明As5+对中肋骨条藻的72h-EC50为4.46 mg/L;Ghadersarbazi等[20]研究表明As5+对鲤96h-LC50为9.48 mg/L,与本试验结果相似,并且与前人结果相比,普通小球藻对As5+更为敏感。不同受试生物对As5+存在敏感性差异,可能与受试生物的规格、健康状况及生命阶段等诸多因素有关,此外,水环境的理化性质也会对水生生物的毒性效应产生影响。当水环境处于还原性条件下时,As3+占主导地位,根据其化学性质,As3+毒性比As5+更强,Karthikeyan等[21]研究表明As3+对纺锤水蚤和斑节对虾的96h-LC50分别为0.132和0.66 mg/L,He等[22]研究表明As3+对水蚤的48h-LC50为0.554 mg/L,与本试验结果相比,As3+毒性较强与前人结果一致,As3+对水生生物的具体毒性效应机制后续会进一步研究。
光合色素是微藻进行光合作用的物质基础,Chl.a是微藻光合色素的主要色素,其含量可以直接反映微藻的光合作用效率和生长状况[23]。TP作为渗透调节物质和营养物质,是衡量藻细胞代谢水平的重要指标[24]。ATP是微藻最重要的高能化合物之一,其主要来源于呼吸作用中的氧化磷酸化和光合作用中的光磷酸化,因此其含量可直接反应藻类细胞的活性[25]。在本研究中,As5+96h胁迫后,普通小球藻Chl.a、TP和ATP含量与藻细胞生长趋势一致,随着暴露浓度的增加,Chl.a和TP含量显著下降,ATP能量代谢紊乱,藻细胞活性降低。分析其原因,一方面,可能是As5+胁迫诱导ROS积累,抑制叶绿素酸脂还原酶和丙酮酸脱氢酶等物质的活性,阻碍光合色素和ATP酶的合成,导致用于蛋白质合成的碳骨架缺乏[26];另一方面,通过电镜结果可知,As5+胁迫损伤藻细胞膜及胞内类囊体和叶绿体等结构,光合作用机能遭到破坏,ATP酶活性中心的结构发生变化,从而影响藻细胞能量代谢等生理功能的发挥,最终促使藻细胞凋亡[27];再者,As5+与磷酸盐具有相似的结构和性质,能够通过磷酸蛋白转运通道进入细胞内,在许多生化反应中取代磷酸盐,并对细胞磷代谢产生干扰,从而影响高能磷酸键ATP的合成,导致蛋白结构异常和多种酶促反应受阻等[28]。已有研究表明,当微藻遭受不同污染物胁迫时,TP和Chl.a含量变化与污染物剂量呈效应关系[29]。张仁璇等[30]研究表明紫球藻ATP酶活性随Cd2+浓度的增加而显著降低,与本试验结果一致。
在正常条件下,机体产生的活性氧自由基(ROS)含量低,可被机体的抗氧化系统有效地清除,ROS产生速率和抗氧化系统的运作处于动态平衡,以避免机体损伤。然而,当机体受到超过其抗氧化系统能力的环境胁迫时,机体代谢过程中产生的过量ROS无法消除,从而导致膜脂质过氧化和光合器官损伤等[31]。在本研究中,2 mg/L处理组ROS水平为对照组的4.0倍。这说明普通小球藻在As5+胁迫下,自身抗氧化系统无法完全清除污染物产生的自由基,致使藻细胞受到氧化损伤。在微藻中,ROS主要由环境胁迫下叶绿体和质膜中的电子传递活动产生的,当光合作用相关基因被抑制、电子传递受阻时,多余的电子被输送到分子氧中,由此产生活性氧[32]。正如本试验电镜结果可知,经As5+胁迫处理的藻细胞ROS的增加,可能是叶绿体和类囊体等结构被破坏的结果一致,与本试验藻细胞中Chl.a含量与ROS水平呈负相关一致。
丙二醛(MDA)是脂质过氧化的重要产物,可以反映生物体受活性氧自由基攻击的程度,间接反映组织过氧化损伤程度[33]。在本研究中,1、1.5和2 mg/L处理组MDA含量显著增加,分别为对照组的1.6倍、2.0倍和2.6倍,同时1.5和2 mg/L处理组通透性显著增加,分别为对照组的1.7倍和2.2倍。这表明脂质过氧化损伤加剧,改变膜酶、离子通道的脂质微环境,从而使细胞膜的流动性和通透性增强,影响细胞内平衡,最终导致细胞结构和功能的改变,这与透射电镜结果相一致。推测原因,其一,可能是重金属会影响藻细胞金属硫蛋白的结合能力,致使细胞膜脂质过氧化和膜电位去极化,破坏细胞膜完整性,损伤细胞内部结构,进而干扰机体代谢和生长[34];其二,藻细胞在胁迫环境下,Chl.a含量下降,MDA的积累与活性氧的氧化损伤有关[32]。吕金平等[35]研究发现随As3+浓度不断增加,黄花水龙叶片细胞的脂质过氧化程度不断加深,细胞膜系统受到不可逆损坏,导致细胞生长和光合作用均受到抑制,与本试验结果一致。
T-AOC是总抗氧化能力,由生物机体抗氧化系统和非酶促系统组成,是衡量机体抗氧化系统功能状况的综合指标,其中T-SOD是抗氧化系统中的重要组成部分,可以将超阴离子自由基(O2-)转化为H2O和O2,防止机体受到活性自由基的攻击,在机体的自我保护系统中发挥着极为重要的作用[36]。在本研究中,暴露于As5+96h后,藻细胞ROS呈浓度依赖性增加,同时藻细胞T-AOC和T-SOD有相似的活性变化,2 mg/L处理组T-AOC和T-SOD活性受到显著诱导,分别为对照组的2.8倍和1.6倍,表明随着As5+浓度的增加,对藻细胞机体的刺激增大,ROS产生速率增强,抗氧化酶被激活以平衡ROS的产生,其活性增高是为一种典型的清除过氧化物、维持细胞功能的应激反应。因此,T-AOC和T-SOD活性的提高为代偿性增高,用以清除As5+胁迫时ROS产生过量的毒害,以维持细胞内的氧化还原平衡,增强藻细胞的自我保护机制。张鹏等[37]研究发现无机砷胁迫对铜藻产生氧化损伤,为缓解砷胁迫,铜藻的抗氧化酶(SOD、POD)活性和抗氧化物(GSH、NPT)含量也相应提高;蔡卓平等[38]研究表明,较低浓度的重金属Cd2+和Pb2+胁迫米氏凯伦藻时,机体抗氧化酶系统对其产生应激性,SOD活性会显著升高,清除机体产生过多的自由基,抗氧化酶活性相对增强,本试验结果与前人结果相似。
叶绿体的数量和结构变化可以直接反映光合作用能力,其中类囊体是光反应的场所,是叶绿体的核心结构,类囊体的有序排列可以保证较大的光面积和光合速率[39]。本研究透射电镜结果显示,2 mg/L As5+胁迫下藻细胞胞质部分呈空泡化,类囊体片层结构模糊不清,部分溶解消失,叶绿体结构紊乱。这主要是类囊体膜中富含不饱和脂肪酸,容易受到过量ROS的攻击,脂质过氧化程度不断加深,导致膜的崩溃,光合作用机能遭到破坏以及能量供应不足,造成氧化磷酸化和电子传递受阻,严重影响藻细胞自身的正常生长以及代谢活动,促使细胞凋亡[40],这与上述本试验结果相一致。这一结果与Gu等[23]报道增塑剂邻苯二甲酸二丁酯会破坏斜生栅藻和小球藻的内部结构(叶绿体、细胞膜和蛋白核)的完整性及唐学玺等[41]研究发现2,2’,4,4’-四溴联苯醚(BDE-47)胁迫米氏凯伦藻,造成藻细胞胞内基质出现许多高电子密度区域及透明空泡,线粒体和叶绿体等细胞器受到明显破坏作用,与本试验结果一致。
4 结论
由于重金属对人类、水生生物和其他生物的毒性,水体重金属污染对水环境生态系统的平衡和稳定是一个潜在威胁。因此,以水环境为重点的污染影响研究受到越来越多的关注。本研究证实了As5+浓度高于1.5 mg/L胁迫下普通小球藻表现出显著的响应,表现为藻细胞生长受到抑制,Chl.a、TP和ATP含量下降,ROS和MDA含量升高,脂质过氧化程度加深导致细胞膜通透性增大,藻细胞内部结构紊乱。但在As5+胁迫下,小球藻可以通过改变T-AOC和T-SOD活性来适应和调节,从而提高小球藻对As5+胁迫的抗性。因此,普通小球藻在As5+胁迫下的一系列生理反应可作为水生态系统中As5+污染的天然生物标志物或生物指示物。但是,重金属砷对微藻毒性作用机制复杂,仅从浓度、受试生物死亡率和抗氧化酶活性等指标去判断有所欠缺,需要后续进一步研究,同时水环境实际污染物呈多元化,重金属As与其他污染物的联合毒性试验亟待开展。
