神经干细胞来源的外泌体在神经疾病诊治中的应用
2022-09-13江张胜赵晨玲
江张胜,赵晨玲,董 婷
(1.安徽中医药大学研究生院,中国安徽 合肥 230038;2.安徽中医药大学第一附属医院,中国安徽 合肥 230031)
细胞外囊泡(extracellular vesicle,EV)是指包括外泌体(exosome)、微囊泡(microvesicle)和凋亡小体(apoptotic body)在内的一系列囊泡。其中,外泌体是指多泡体(multivesicular body,MVB)与细胞膜融合时释放到细胞外空间的大小为40~100 nm的腔内囊泡,其不仅可以由包括神经元细胞在内的不同类型细胞从晚期内体细胞区室分泌,还可从诸如脑脊液、血浆和尿液等的条件细胞培养基或体液中分离。外泌体作为疾病诊断和治疗的生物标志物及细胞间通信的重要介质,可在膜细胞与胞浆蛋白质、脂质与RNA的转运中发挥关键作用[1]。
目前,中风(stroke)、阿尔茨海默病(Alzheimer’s disease,AD)、脊髓损伤(spinal cord injury,SCI)和帕金森病(Parkinson’s disease,PD)等神经疾病,被认为是危害较大的神经系统疾病,已成为世界性卫生保健难题[2~3]。迄今为止,上述神经疾病尚不能完全治愈,仅可通过药物改善其症状。近年来,神经干细胞(neural stem cell,NSC)在神经疾病损伤修复中的作用逐渐得到了业内人士的普遍认可。NSC不仅可参与神经发生、突触发生、少树突发生、轴突连接和髓鞘形成等过程,而且在灰质和白质损害方面也有作用[4]。尽管NSC治疗神经疾病的机制尚不清楚,但有研究表明,其可能与细胞外环境中的分泌因子通过旁分泌功能实现的远距离细胞间通信有关[5]。NSC和受损器官之间的细胞间通信被认为是通过释放自由分子来调控的,这些分子通过与受体结合传递信号[6]。虽然当前外泌体发挥作用的机制仍不清楚,但不可否认的是其为细胞间通信开辟了一个新的研究前沿。众多研究表明,外泌体可以作为反映神经疾病病理进展和促进康复的生物标志物,其可通过脑细胞的合成与释放,透过血脑屏障,流入到外周血或脑脊液中[7~8]。由于NSC来源的外泌体可为神经疾病的诊断和治疗提供新的途径,故本文重点介绍了NSC来源的外泌体的性质和特征,以及它们作为神经疾病诊断与治疗的生物标志物在临床前模型中的作用(图1)。
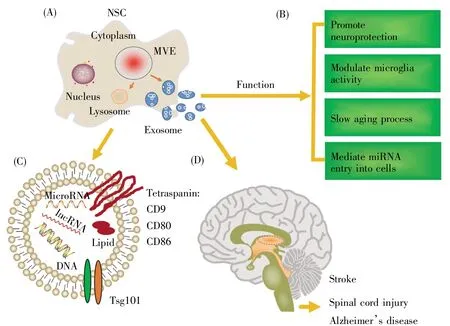
图1 NSC分泌的外泌体的结构、功能和在神经疾病治疗中的应用(根据参考文献[47~49]、[52~53]修改)(A)NSC分泌的外泌体;(B)外泌体在神经疾病中的治疗作用;(C)外泌体的结构和组成成分;(D)外泌体在神经疾病治疗中的应用。Fig.1 Structure,function and application of exosomes secreted by NSCs in the treatment of neurological diseases(modified according to References[47~49]and[52~53])(A)Exosomes secreted by NSCs;(B)Function of exosomes in the treatment of neurological diseases;(C)The structure and composition of exosomes;(D)Application of exosomes secreted by NSCs in the treatment of neurological diseases.
1 外泌体
1.1 外泌体的生物学合成及基本特性
外泌体生物发生的第一步是质膜向内出芽,形成一个膜结合的液泡。该液泡在成熟过程中经历几个变化,形成一个晚期核内体,晚期核内体的限制膜随后向内芽出,并夹断形成被膜包裹的囊泡,称为管腔小泡(intraluminal vesicle,ILV),即MVB。最后,部分MVB与细胞膜融合释放到胞外,形成大小均一的囊泡,即外泌体[9]。
多个研究表明,不同来源的外泌体根据其生物发生释放特定的脂类(胆固醇、磷脂酰丝氨酸、磷酸甘油酯和脂质等[10])、核酸(DNA、编码RNA、非编码RNA和microRNA[11])和蛋白质(CD9、CD80、CD86和Tsg101等[12])。目前,检测外泌体的主要方法包含蛋白质免疫印迹、透射电镜、免疫荧光染色和纳米粒子追踪分析等技术。
1.2 外泌体的分离和纯化
自30多年前发现外泌体以来,人们已经清楚地认识到外泌体对生理和病理的许多方面都有作用,为了提高其应用效率,外泌体的高效分离和纯化是十分必要的。目前,高效分离和纯化外泌体的主要方法有:1)差速离心法。这也是最常见的一种方法,其操作简单,产量适中。大容量样本根据颗粒的大小和密度,采用低速离心、高速离心交替进行的方法,分离得到大小相近的囊泡,但回收率不稳定,且重复离心可能会损坏囊泡膜结构[13~14];2)抗体亲和捕获法。该方法利用抗原、抗体之间高度的特异性结合对外泌体进行分离,在获得高纯度外泌体的同时,可分离不同亚型的外泌体,但外泌体表面抗原可能因阻断和覆盖而不能被识别[15];3)微控流芯片法。该方法利用外泌体特异性构建三维微环境,进而从复杂的细胞基质分离出外泌体。虽然其获得的外泌体纯度高,但临床样品缺乏标准、规模化测试与方法验证,同时样本容量较低[16]。
2 NSC及其分泌的外泌体
2.1 NSC的特征及功能
NSC是神经系统中最不稳定的细胞之一,具有自我更新的功能特性,可产生3种基本的神经外胚层谱系,在整个生命过程中以发育阶段的方式产生神经元、星形胶质细胞和少突胶质细胞。研究证实,NSC能够促进神经元产生神经营养因子和神经生长因子等[17~19],这些因子可减少宿主内源性神经元的细胞死亡,促进轴突/树突连接、神经营养和炎症调节、细胞替代和神经可塑性修复,增强神经系统再生的能力。除了替代失去的神经元,NSC还可能发挥神经保护和免疫调节剂的功能,并且NSC移植作为一种潜在的神经退行性疾病的治疗方法已被广泛探索[20]。但是,NSC治疗也可能带来一些安全风险,主要包括畸胎瘤形成、异常细胞生长、免疫排斥和炎症,以及不希望的细胞分化表型,这些都限制了NSC在临床上的应用[20]。因此,NSC分泌的外泌体在神经疾病中的诊断和治疗受到了极大的关注。
2.2 NSC分泌的外泌体
研究表明,在中枢神经系统中,NSC分泌的外泌体参与神经元和小胶质细胞之间广泛的相互作用[21]。此外,NSC分泌的外泌体可将神经元中的活性物质转移到脑内星形胶质细胞中,这可能会调节星形胶质细胞的功能,对突触活性、神经血管完整性的维持和髓鞘形成等方面产生影响。例如:携带miR-124a的NSC外泌体进入星形胶质细胞与兴奋性氨基酸转运体-2/谷氨酸转运体-1的表达增强有关[22];NSC外泌体可通过转移miR-132到血管内皮细胞调控脑血管的完整性,导致黏附连接蛋白Cdh5的表达上调[23]。
在某些病理环境中,外泌体被认为是疾病的介质,这种现象在多种神经疾病中都有存在[24]。此外,NSC分泌的外泌体已被报道携带特定颗粒从其来源的细胞到其他细胞,导致大脑病理改变的增加,这包括AD中的β-淀粉样蛋白(amyloidβ-protein,Aβ)和tau蛋白、海绵状脑病中的朊蛋白、PD中的α-突触核蛋白和富含亮氨酸的重复激酶-2、肌萎缩侧索硬化中的超氧化物歧化酶-1[25]。另一方面,NSC分泌的外泌体也被证明具有神经保护作用,因为它们是周围神经再生和神经元损伤修复的一部分[26]。Alvarez-Erviti等[27]研究表明,NSC分泌的外泌体表面携带的活性物质(如小的RNA)可以作为神经疾病诊断的纳米信号。
同时,NSC分泌的外泌体可以作为神经疾病药物治疗的载体[28]。与NSC本身相比,使用NSC分泌的外泌体作为药物载体有几个优点。首先,通过鼻内给药,大量的外泌体可靶向大脑的不同区域[29];其次,与细胞治疗不同,外泌体在给药后发生肿瘤或恶性转化的可能性几乎为零,因为它们不是有核细胞,不能复制,在释放载物后迅速分解[30];最后,静脉或鼻内给药不太可能导致血栓形成,因为静脉给药能够穿过血脑屏障并通过胞吞作用穿过内皮细胞形成小泡。因此,提供无细胞疗法的外泌体可以改变人们看待药物的方式,可以在没有显著副作用的情况下拯救许多生命。
3 NSC分泌的外泌体在神经疾病中的应用
3.1 外泌体作为诊断的标志物
神经疾病的监测、诊断及治疗,需要一个准确、高效且容易检测的标志物。外泌体能成为中枢神经系统中的生物标志物主要有以下几个原因。第一,外泌体可以比较容易地通过血脑屏障,特异的中枢神经系统来源的外泌体和外周外泌体均可作为中枢神经系统疾病相关的生物标志物[27,31];第二,外泌体中的核酸、蛋白质和脂质在疾病进展过程中发生改变;第三,外泌体可以从尿液、血液和唾液等容易获取的生物液体中无创分离出来,可用于疾病的早期诊断,这在中枢神经系统疾病中特别重要;第四,外泌体内容物被保护在膜状结构中,这比传统标本更有优势,因为潜在的生物标志物被保护起来不容易被降解;第五,外泌体高度稳定,这使应用于临床分析的样品可以长期保存;第六,外泌体可以被浓缩,从而显著提高检测灵敏度。
在中枢神经系统的微环境中,外泌体不仅可以介导大脑功能和神经保护,而且也涉及中枢神经系统疾病的发病机制[27,32]。Guo等[33]通过纯化PD患者脑脊液中的外泌体,证实外泌体中存在能够诱导神经元中α-突触核蛋白聚集的α-突触核蛋白寡聚体。Shi等[34]观察到,PD患者血浆外泌体中的α-突触核蛋白浓度与健康对照组相比会有所增加。因此,人们通过检测外泌体中的α-突触核蛋白在一定程度上可判断PD患者的病情。另外,Fiandaca等[35]报道,在AD患者血源性外泌体中检测到磷酸化tau蛋白和Aβ的增加。Jia等[36]验证了脑脊液与血源性外泌体生物标志物的一致性,证实血源性外泌体与脑脊液中的Aβ42和磷酸化tau蛋白具有相同的AD诊断能力。因此,人们可以通过检测外泌体中Aβ的表达水平来监测AD患者的发病情况。
3.2 外泌体治疗神经疾病的潜力
3.2.1 外泌体在中风治疗中的应用
中风是导致死亡和长期残疾的主要原因之一。到目前为止,临床唯一批准治疗脑卒中的药物是组织型纤溶酶原激活剂。然而,这种药物仅适用于及时住院治疗的一小部分患者[37]。此外,组织型纤溶酶原激活剂的使用可能会增加一些患者发生出血性转化的风险。因此,非侵入性的、有希望修复受中风影响的大脑的替代疗法是必需的。从这个角度出发,少数研究分析NSC分泌的外泌体在脑卒中模型中的疗效具有重要意义。生物标志物对于预测中风的严重程度和预后(包括可能形成的出血和其他并发症)非常有价值。
NSC已知在各种中枢神经系统疾病的组织再生和修复中有效,其可通过分泌外泌体发挥抗炎和神经营养作用[38~39]。Webb等[40]的研究表明,在血栓栓塞性中风后静脉注射NSC来源的外泌体可以改善中年小鼠的细胞与组织功能。NSC外泌体创造了小胶质细胞向M2型极化的有利环境,这可能与其促进碎片清除和减少慢性炎症有关,由于中风是通过局部神经免疫反应打开血脑屏障,从而导致慢性神经变性,故在中风后接受外泌体的动物记忆会有所改善[41]。随后,同一组研究人员在猪脑卒中模型中研究了NSC分泌的外泌体的疗效[41],他们通过永久性大脑中动脉闭塞诱导缺血性卒中,并在卒中后2 h、14 h和24 h静脉给予外泌体,发现受损组织在功能水平上有显著改善,同时给予的外泌体能够消除缺血性病变及颅内出血,减少脑损伤体积和脑肿胀,维持了脑白质的完整性。总的来说,中风后使用NSC来源的外泌体可以给患者提供显著的神经与运动功能保护。
3.2.2 外泌体在AD治疗中的应用
AD是一种进行性神经退行性疾病,以记忆丧失和多种认知障碍为主要临床表现。长期以来,AD病理被认为是有毒的Aβ异构体积累在脑实质。Aβ导致小胶质细胞和星形细胞激活,从而使炎症反应扩散到整个大脑[42]。遗憾的是,目前尚无有效的方法可以预防或治愈AD患者的神经元细胞死亡、Aβ沉积和认知功能下降。近年来,研究人员发现NSC具有分化为中枢神经系统各种类型细胞的潜能,为神经退行性疾病的治疗带来了希望。自从最初发现外泌体与AD有关[43]以来,多项研究证明了外泌体在AD中的多方面作用。
Dinkins等[44]研究发现,外泌体蛋白质在AD患者大脑的斑块中积累,它们通过抑制nSMase2,减少外泌体的分泌,从而在体内减少AD患者大脑中的淀粉样斑块负荷。有证据表明,Aβ在突触上结合可导致突触功能中断,最终导致树突棘的收缩和认知障碍[45]。Micci等[46]研究发现,NSC分泌的外泌体可阻止突触与Aβ受体的结合,并防止相关功能障碍(如记忆回忆缺陷);用NSC外泌体治疗小鼠的突触可塑性和记忆功能均对Aβ诱导的损伤有保护作用;此外,在诱导性转基因小鼠模型中敲除NSC可导致突触对Aβ的易损性增加,而外源性给药NSC外泌体可完全修复该易损性。这些结果表明,由NSC特异性释放的外泌体在促进或维持突触对Aβ损伤影响的恢复中发挥关键作用,NSC分泌的外泌体通过诱导受体神经元的变化来缓解Aβ介导的毒性。目前已有研究表明,外泌体(包括NSC分泌的外泌体)引发的许多效应可归因于其特定的microRNA载体作用,包括对衰老[47]、认知、突触功能[48]的调节以及对神经的保护[49]。因此,NSC分泌的外泌体中特定的microRNA可能介导其对靶神经元突触的保护作用,提示了开发新的治疗途径促进AD患者认知功能恢复的可能性。
3.2.3 外泌体在SCI治疗中的应用
SCI会促使轴突分离和神经元死亡,导致永久性功能损伤。目前,SCI尚无根治方法,但干细胞移植常被认为是缓解SCI发展的最具吸引力治疗方法之一。成人脊髓中内源性NSC的发现,为未来SCI的无创治疗带来了希望。但在常规临床应用前,人们仍需解决移植细胞存活率低、细胞去分化、肿瘤形成等诸多问题。有研究表明,移植的干细胞主要通过旁分泌机制来减轻炎症反应、提供神经保护和促进修复,而外泌体在促进SCI缺氧缺血后功能恢复的这一过程中发挥重要作用[50]。
自噬对细胞的再生至关重要,基础或生理的自噬有助于细胞稳态的维持、蛋白质和亚细胞细胞器的控制,且可减少细胞损伤[51]。Rong等[39]研究表明,NSC来源的外泌体可通过提高LC3B和beclin-1表达所介导的自噬,抑制SCI模型大鼠的神经元凋亡、神经炎症和小胶质细胞激活过程,从而促进功能恢复。因此,未来可将NSC来源的外泌体作为一种新型SCI生物治疗途径。
4 总结和展望
外泌体是目前基础科学和转化研究中发展最快的领域之一。然而,来自特定细胞类型的外泌体在不同条件下的功能差异性仍有待探索。在本文中,我们特别指出NSC来源的外泌体的特性、诊疗潜力及其在生理和病理条件下可能介导的多种功能,为临床诊疗提供理论基础。深入了解外泌体的组成和发展先进的方法来调节外泌体的载体,将进一步提高外泌体对不同神经疾病的治疗效果。使用NSC在特定培养条件下分泌的特性良好的外泌体和携带所需microRNA、mRNA和蛋白质的外泌体,在治疗多种神经疾病方面有很大的前景。
此外,使用NSC外泌体的非侵入性治疗方法可能比NSC移植更有效,因为在静脉或鼻腔给药后,外泌体可以很容易地穿过血脑屏障到达病变部位。在未来,针对大脑中特定神经元类型或区域的外泌体可能有助于治疗不同的神经疾病。但是,NSC外泌体的研究还面临诸多挑战,有关NSC外泌体诊断和治疗神经疾病方面的研究仍任重道远。
