金霉素分子印迹电化学传感器的制备与应用
2022-09-13韩双张楠王慧张璇杨金栾张蔓琳张志超
韩双,张楠,王慧,张璇,杨金栾,张蔓琳,张志超
(沈阳化工大学理学院,辽宁 沈阳 110142)
引 言
金霉素(CTC)是一种四环素类抗生素,可以保护动物及促进其生长或预防动物的寄生虫、细菌感染,曾作为兽药被广泛添加到动物饲料中[1-8]。然而,大多数动物不能完全代谢CTC,部分CTC残留在动物体内或通过动物尿液和粪便被排出体外。这给自然环境和人类健康造成严重的不良影响[9-10]。虽然一些国家和地区已经通过立法规范了CTC 的使用,但仍需要一种可靠、高效、简单的方法来检测食品和环境中的CTC残留。
目前已有多种方法和技术来测定CTC,包括高效液相色谱-荧光检测法[11-13]、高效液相色谱-紫外可见光谱检测法[11]、高效液相色谱-化学发光检测法[14]、液相色谱-质谱检测法[15-19]、液相色谱-二极管阵列检测法[20-23]、液相色谱-电化学检测法[24]、毛细管电泳法或毛细管电色谱-紫外可见光谱检测法[25-26]、流动注射-安培检测法[27],以及荧光方法等[8,28]。虽然这些方法的检出限较低,但它们通常需要大型仪器和复杂操作,对样品的处理和对结果的分析需要很好的知识技能。鉴于电分析方法具有仪器小型、操作简单、灵敏度高、成本低廉等优点,研究人员设计了检测CTC 的电化学传感器,如氧化钌-氰化钌修饰玻碳电极(GCE)[24]、阳极化硼掺杂金刚石薄膜电极[27]、核壳结构碳球@二氧化锰修饰GCE[29]、滴汞电极[30]等。但电化学传感器对CTC 的选择性检测结果不是很令人满意。
分子印迹技术对模板分子的形状、大小和官能团的记忆具有高度的选择性与亲和性[31-33]。合成分子印迹聚合物(MIPs)的方法有电聚合[34-35]、自组装[36-37]、化学接枝[38-39]和光化学聚合等[40]。电化学分子印迹传感器中分子印迹膜的构建主要采用电聚合方法[41]。为了提高电化学传感器的灵敏度,具有高电子迁移率和大比表面积的石墨烯及其复合材料被广泛应用于电化学传感器[42-46]。Atar 等[47]在还原型氧化石墨烯-金属氧酸盐-Pt 纳米粒子复合材料修饰电极上,利用吡咯为功能单体,电聚合制备了桔青霉素分子印迹电化学传感器。Yola 等[48]制备了Ag 纳米粒子-2-氨基乙烷硫醇氧化石墨烯修饰电极,利用苯酚为功能单体,开发了酪氨酸分子印迹电化学传感器。
本研究将构建一种电化学分子印迹传感器用于CTC 的检测。以CTC 为模板分子,将邻苯二胺电聚合在还原型氧化石墨烯-聚乙烯亚胺复合物(RGO-PEI)修饰的GCE 上,后将聚邻苯二胺薄膜修饰电极浸入乙醇中洗脱除去模板分子CTC (图1)。含有大量富电子氨基的支化PEI将通过共价键或物理吸附作用附着在氧化石墨烯上形成RGO-PEI 复合材料[49]。由于RGO-PEI 具有良好的电导率、高比表面积和富含电子的氨基,为聚邻苯二胺分子印迹膜的稳定性提供了强有力的平台,提高了检测CTC的灵敏度,将能快速高效地实现样品中CTC 含量的测定。

图1 CTC分子印迹电化学传感器的构建过程(邻苯二胺电聚合反应式和RGO-PEI反应式)Fig.1 Schematic representation of the fabrication procedures of the CTC MIP sensor
1 实验材料和方法
1.1 材料
石墨粉(质量分数为99%)购自Sigma-Aldrich 公司。聚乙烯亚胺(PEI,30%,树枝状,MW70000)购自阿法埃莎。盐酸金霉素(CTC)、盐酸多西环素(DOC)和盐酸土霉素(OTC)购自阿拉丁实业有限公司。卡那霉素(Kana)购自西亚试剂公司。邻苯二胺(o-PD)、铁氰化钾、磷酸氢二钠、磷酸二氢钠和氯化钾购自国药化学试剂有限公司。醋酸和无水醋酸钠购自天津博迪化工有限公司。所有试剂均为分析纯。利用磷酸、磷酸氢二钠和磷酸二氢钠配制磷酸盐缓冲溶液。利用醋酸和无水醋酸钠配制醋酸盐缓冲溶液。所有溶液均用二次蒸馏水配制。
1.2 仪器
CHI660E 电化学工作站(上海辰华仪器有限公司)。三电极系统:工作电极为玻碳电极(GCE,直径5 mm),对电极为铂片电极,参比电极为饱和甘汞电极。红外光谱,NEXUS 470 红外光谱仪(美国);紫外可见光谱,UV-2550 分光光度计(日本岛津公司);扫描电子显微镜,XL-30 ESEM FEG(FEI COMPANYS,USA);能 量 色 散X 射 线 光 谱 仪(EDX),Oxfordinstruments X-Max(UK)。
1.3 RGO-PEI的制备
根据文献[50]方法合成了高纯度的氧化石墨烯(GO)。为了合成RGO-PEI复合物,将1 ml 30%(质量分数)的PEI 水溶液与2 ml 水混合。向20 ml 水中加入2 mg GO,超声混合30 min,得到均匀的黄褐色GO 溶液。将稀释后的PEI溶液1 ml与上述GO 溶液混合,室温下超声30 min。然后在95℃下加热搅拌2 h,离心,保留下层固体,干燥,得到RGO-PEI 复合物。
1.4 RGO-PEI复合物修饰电极的制备
先后用1.00、0.30、0.05 μm 氧化铝粉末将GCE抛光至镜面,分别在乙醇和水中超声清洗电极,氮气吹干。用移液枪移取10 μl 1 mg/ml RGO-PEI 溶液滴加在上述GCE 表面,室温下晾干,得到RGOPEI复合物修饰电极(GCE/RGO-PEI)。
1.5 分子印迹传感器和非分子印迹传感器的制备
在GCE/RGO-PEI 表面电聚合分子印迹单体o-PD,生成聚邻苯二胺(PPD)。具体做法如下:在含有5.0 mmol/Lo-PD 和1.0 mmol/L CTC 的醋酸盐缓冲液(pH 4.8)中,以0.05 V/s的扫描速率,在0~0.8 V之间循环伏安扫描30 圈,制备分子印迹传感器MIP GCE/RGO-PEI/PPD。电聚合后,MIP GCE/RGOPEI/PPD 在乙醇中浸泡10 min,从MIP 膜上洗脱除去CTC。
在不含有CTC 的5.0 mmol/Lo-PD 溶液中,相同电聚合条件下,制备非分子印迹传感器NMIP GCE/RGO-PEI/PPD。
1.6 CTC的检测
将洗脱后的MIP GCE/RGO-PEI/PPD 在不同浓度的CTC 标准溶液中吸附10 min,取出电极并冲洗干净,将电极浸入5.0 mmol/L K3Fe(CN)6/0.1 mol/L KCl 的探针溶液中进行循环伏安扫描,扫描速率为0.05 V/s。扫描结束后,该电极在乙醇中洗脱10 min以去除CTC,此后重复使用。
2 实验结果与讨论
2.1 GO和RGO-PEI的表征
2.1.1 SEM 表征 图2 显示了GO 和RGO-PEI 的SEM 图像。可以看出,GO 在结构上是分层的。RGO-PEI 在结构上也是分层的,片层上存在一些微小的颗粒,可能是附着的PEI。RGO-PEI 的EDX 光谱表明,在0.39 keV处存在对应于N元素的Kα峰,这正是PEI的氨基对应的N元素。

图2 GO和RGO-PEI的SEM图像及RGO-PEI的EDX图像Fig.2 SEM images of GO and RGO-PEI and EDX image of RGO-PEI
2.1.2 红外吸收光谱表征 图3 为GO 和RGO-PEI的红外吸收光谱图。GO 具有高度的亲水性,在3415 cm-1附近出现一个GO 醇羟基O—H 伸缩振动峰。GO 与PEI 反应后,3415 cm-1附近的峰值明显减弱,说明GO 被PEI 部分还原,PEI 分子覆盖在还原后生成的RGO 表面。对于GO 来说,1721 cm-1、1374 cm-1和1165 cm-1处的几个吸收带可以分别归属于羧酸(或羰基)的C O 伸缩振动、羧酸的O—H变形振动和环氧基的C—O 伸缩振动[51-52]。GO 与PEI 反应后,1721 cm-1处的特征带几乎完全消失,同时1374 cm-1(O—H)和1165 cm-1(C—O)处的两个峰明显减弱。GO 中1622 cm-1的强带与未氧化的石墨骨架振动有关,它被1650 cm-1的强带所取代,该强带证明了酰胺的形成[50,53]。此外,RGO-PEI 出现了一个1561 cm-1的新带(C—N 拉伸振动),证明了PEI与GO 形成共价键。红外光谱的这些变化证实了PEI 存在于RGO 表面,其中一些是通过酰胺键与RGO表面共价连接的。

图3 GO和RGO-PEI的红外吸收光谱图Fig.3 FTIR spectra of GO and RGO-PEI
2.1.3 紫外可见吸收光谱表征 如图4 所示,GO 在231 nm处有一个特征吸收峰,为芳香族C C的π→π*跃迁;300 nm 处有一个弱的吸收峰,为C O 的n→π*跃迁。而RGO-PEI 的特征吸收峰则红移到260 nm。这表明GO 被PEI 还原和共轭结构的恢复[54-55],与红外的结果一致。

图4 GO和RGO-PEI的紫外可见吸收光谱图Fig.4 UV-Vis spectra of GO and RGO-PEI
2.2 在GCE/RGO-PEI 上电聚合o-PD 形成PPD薄膜
在含有CTC 模板剂和不含CTC 的条件下,采取o-PD 单体电聚合方法在pH4.8 的醋酸盐缓冲溶液中分别制备了PPD 薄膜(图5)。由于o-PD 的电氧化具有完全不可逆性,其氧化峰电流随着循环伏安扫描圈数的增加而减少,表明电极表面形成了不良导电性的PPD 薄膜,即成功制备了MIP GCE/PEIRGO/PPD 传感电极。当扫描圈数接近30 圈时,o-PD氧化峰电流几乎消失。研究表明,在不含CTC模板分子的情况下得到的循环伏安曲线与含有CTC模板分子的情况下的电聚合过程相似。

图5 5.0 mmol/L o-PD在GCE/RGO-PEI修饰电极表面电聚合的循环伏安图Fig.5 Cyclic voltammograms for the electropolymerization of 5.0 mmol/L o-PD on GCE/RGO-PEI in the presence(a)and in the absence(b)of CTC in pH4.8 acetate buffer(scan rate:0.050 V/s)
2.3 MIP GCE/PEI-RGO/PPD 的电化学表征
图6 显示了不同电极在5.0 mmol/L K3Fe(CN)6/0.1 mol/L KCl溶液中的循环伏安曲线。在GCE上观察到一对明显的K3[Fe(CN)6]可逆氧化还原峰(图6a)。当RGO-PEI 被修饰在GCE 表面后,由于RGO-PEI具有良好的导电性和较大的比表面积,K3[Fe(CN)6]的氧化还原峰电流增加(图6b)。然而,在o-PD 电聚合到GCE/RGO-PEI 电极表面后,K3[Fe(CN)6]的氧化还原峰完全消失了(图6c),表明通过电聚合形成了PPD 薄膜,这种薄膜阻止了K3[Fe(CN)6]扩散到电极表面,阻碍了K3[Fe(CN)6]与电极表面的电子转移。然而,在乙醇溶液中清洗MIP GCE/RGO-PEI/PPD后,K3[Fe(CN)6]峰电流强度增加了(图6d),说明PPD薄膜中的模板分子CTC 被成功去除,形成了多孔薄膜,有利于K3[Fe(CN)6]的扩散和随后与底层电极的电子转移。研究表明,将洗脱后的MIP GCE/RGOPEI/PPD 浸入CTC 溶液中,K3[Fe(CN)6]峰电流信号下降(图6e)。这是因为CTC 进入PPD MIP 薄膜中的空穴位置,阻碍了K3[Fe(CN)6]与电极表面的电子转移从而导致K3[Fe(CN)6]峰电流下降。
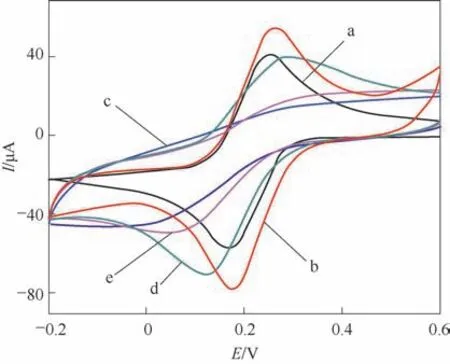
图6 不同电极在5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl中的循环伏安图Fig.6 Cyclic voltammograms of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl on the bare GCE(a),GCE/RGO-PEI(b),GCE/RGO-
同时,研究了扫描速率对MIP GCE/RGO-PEI/PPD 的影响。如图7 所示,随着扫描速率从0.050 V/s 增大到0.50 V/s,K3[Fe(CN)6]的峰电流也随之增加。如图8所示,K3[Fe(CN)6]的峰电流与扫描速率成线性关系,线性回归方程表示为I= - 292.38ν- 68.38(R=0.9981),表明这是一种典型的表面控制电化学行为。然而,K3[Fe(CN)6]的峰电位随着扫描速率的增大而发生负向或正向移动。因此,在随后的实验中选择0.050 V/s作为后续研究的扫描速率。

图7 不同扫描速率下MIP GCE/RGO-PEI/PPD 在5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl中的循环伏安图Fig.7 Cyclic voltammograms of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl on the MIP GCE/RGO-PEI/PPD at different scan rates
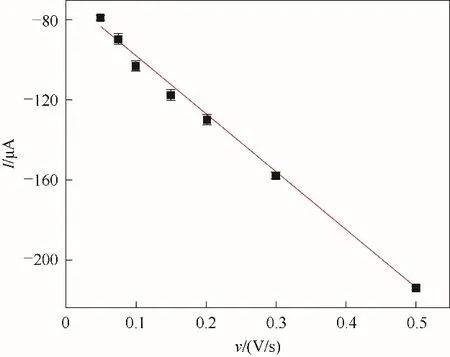
图8 不同扫描速率与K3[Fe(CN)6]在MIP GCE/RGO-PEI/PPD上峰电流的关系曲线Fig.8 Relationship between the scan rate and peak currents
2.4 实验条件优化
2.4.1 电聚合圈数优化 在制备MIP GCE/RGOPEI/PPD 的过程中,电聚合o-PD 循环伏安扫描圈数影响了电化学传感器的灵敏度。为了获得最优电聚合扫描圈数,以不同的循环伏安扫描圈数制作电极。如图9所示,响应电流比值在30个圈数时达到最小。进一步增加扫描圈数会导致过厚的PPD膜,影响电子转移。因此,30 被选为后续电聚合的最佳圈数。

图9 电聚合圈数的优化Fig.9 Effect of the electropolymerization cycles on the peak
2.4.2 pH 优化 磷酸盐缓冲液的pH 对该传感器检测CTC有显著影响。为了优化pH,将该传感器置于一系列pH 从4.0 到10.0 的磷酸盐缓冲液中进行测试。如图10所示,传感器对CTC 的响应电流比值随着pH 的增加而显著增大,pH8.0 时达到最大,然后从pH8.0 到10.0 略有下降。这可能是由于在较低pH 时,CTC 和PPD 薄膜的氨基被酸化,导致它们之间静电排斥,从而产生较小的电流响应。在pH8.0时,CTC和PPD薄膜酸化强度减弱,这使静电排斥力降到最低,导致了大的电流响应。因此,在随后的实验中选择了缓冲溶液pH 为8.0。

图10 pH的优化Fig.10 Effect of pH on the peak current of CV response in the presence of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl(ΔI=I0-I)
2.4.3 洗脱时间优化 为了获得理想的灵敏度、选择性和重现性,完全洗脱模板是非常重要的。图11显示了洗脱时间和响应电流比值之间的关系。响应电流比值随着洗脱时间的延长而增加,并在洗脱时间超过10 min 后逐渐接近一个稳定状态。为了获得更高的洗脱效率,选择10 min 作为洗脱模板分子CTC的最佳时间。

图11 洗脱时间的优化Fig.11 Effect of elution time on the peak current of CV response in the presence of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl(I′is the current of the GCE/RGO-PEI/PPD after electropolymerization)
2.4.4 吸附时间优化 CTC的吸附时间也是该传感器检测的一个重要参数。将模板分子CTC 从PPD薄膜上洗脱之后,将MIP GCE/RGO-PEI/PPD 浸泡在待测CTC 溶液中吸附0 ~ 10 min。如图12 所示,随着吸附时间的延长,探针分子K3[Fe(CN)6]在MIP GCE/RGO-PEI/PPD 上的峰电流比值急剧下降,10 min 后趋于平稳。这表明PPD 薄膜对CTC 分子的快速识别能力和高亲和力。因此,选择10 min 作为测定CTC的最佳吸附时间。

图12 吸附时间的优化Fig.12 Effect of incubation time on the peak current of CV response in the presence of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl
2.5 MIP GCE/RGO-PEI/PPD 检 测CTC 过 程分析
在优化条件下,洗脱后的MIP GCE/RGO-PEI/PPD在不同浓度CTC标准溶液中进行了吸附。如图13所示,在0~100.0 μmol/L范围内,I随着CTC浓度的增加而减小。图14 显示了ΔI与CTC 浓度的线性关系。这里,ΔI=I0-Ic,I0和Ic分别是CTC 浓度为0和c(μmol/L)时的电流。CTC 的线性回归方程为ΔI=-9.32853-0.24939c(c的单位是μmol/L),回归系 数(R)为0.99609。 CTC 的 检 测 限 为0.167 μmol/L。
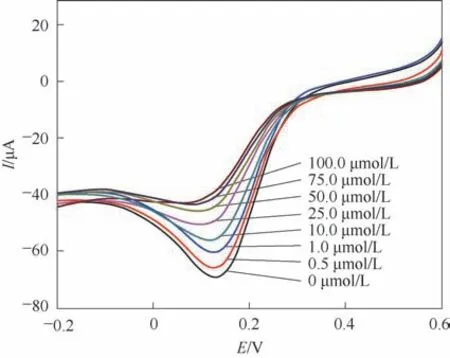
图13 MIP GCE/RGO-PEI/PPD 在不同浓度CTC标准溶液中的线性扫描伏安图Fig.13 Linear sweep voltammograms of 5.0 mmol/L

图14 MIP GCE/RGO-PEI/PPD 检测CTC的标准曲线Fig.14 Linear calibration curve of ΔI with CTC concentrations
为了评估该分子印迹传感器对CTC 的选择性检测和对其他抗生素的抗干扰能力,测试MIP GCE/RGO-PEI/PPD 对CTC、Kana、OTC 和DOC 存在下的响应。如图15所示,100.0 μmol/L Kana、100.0 μmol/L OTC 和100.0 μmol/L DOC 对25 μmol/L CTC 的测定影响不大。表明该传感器对CTC 具有较好的选择性,可以实现对CTC的特异性识别。

图15 MIP GCE/RGO-PEI/PPD 对其他抗生素的抗干扰能力检验Fig.15 The the current change of MIP GCE/RGO-PEI/PPD in the presence of 5.0 mmol/L K3[Fe(CN)6]/0.1 mol/L KCl after incubation in 25.0 μmol/L CTC,25.0 μmol/L CTC+100.0 μmol/L kanamycin,25.0 μmol/L CTC+100.0 μmol/L DOC,25.0 μmol/L CTC+100.0 μmol/L OTC(ΔI0=I0-ICTC;ΔI=I0-ICTC+others)
在最优条件下,取一支MIP GCE/RGO-PEI/PPD电极对100.0 μmol/L CTC 溶液测定6 次,电流响应的标准偏差(RSD)约为2.78%。取8 支MIP GCE/RGO-PEI/PPD 电极检测100.0 μmol/L CTC 溶液,结果显示RSD 约为2.52%。这说明该印迹传感器具有较好的重复使用性和制备重现性。
2.6 实际样品检测
为检验分子印迹传感器在实际样品中的应用,对湖水进行了CTC 加标回收实验。取湖水样品,过滤,用0.1 mol/L 的磷酸盐缓冲溶液调至pH8.0。用该湖水分别配制浓度为10.0 μmol/L 和50.0 μmol/L CTC 溶液进行实验。如表1 所示,实验得到的回收率为102.7% ~ 104.7%,RSD 为1.22% ~ 2.49%。实验表明,该分子印迹电化学传感器对实际样品中CTC的检测是可行的。

表1 湖水样品中CTC的回收实验Table 1 Recoveries for CTC detection in lake samples
3 结 论
提出了利用分子印迹电化学方法对CTC 进行高灵敏和选择性检测。电极最初由RGO-PEI 复合材料修饰,使电极具有良好的导电性、高表面积和丰富的氨基基团。随后,在模板分子CTC 存在下,通过电聚合在修饰电极上形成分子印迹聚合物PPD薄膜,制备了选择性检测CTC 的分子印迹电化学传感器。所制备的传感器对CTC 的检测具有很好的线性范围,对其他抗生素有很强的抗干扰能力,重现性好,能够实现对实际样品的高灵敏高选择性检测。
