TEM8在卵巢癌血管生成和侵袭迁移中的分子机制研究
2022-09-13张贵媛罗翠华李林株吴玉燕周素华
张贵媛 罗翠华 李林株 吴玉燕 周素华
卵巢癌是我国较为常见女性生殖系统恶性肿瘤,卵巢癌其发病原因可能与致癌物质、自身免疫情况、体内激素水平、遗传、环境等多因素有关,其发病率与死亡率均处于较高水平[1]。且在一些流行病学统计中,经手术及化疗、放疗治疗后患者5年生存期仍不足30%[2],因此国内外众多学者也一直在积极寻找新的治疗策略。其原因不仅是缺乏有效的治疗手段,同时也是由于癌细胞的侵袭、迁移及造成大量肿瘤血管生成有关[3]。近些年来影响肿瘤血管生成已成为癌症治疗新的方向[4]。与VEGF不同,TEM8是一个在癌相关细胞中表达且在正常血管组织中未进行表达的因子[5],因此本研究旨在通过建立裸鼠卵巢癌皮下移植瘤模型,探究TEM8在卵巢癌血管生成和侵袭迁移中的分子机制,具体报告如下。
1 材料与方法
1.1 一般材料
SPF级BALB/C裸鼠20只,由江苏艾菱菲生物科技有限公司提供。按随机原则将裸鼠分为对照组与实验组,每组10只。纳入标准:(1)为BALB/C雌性裸鼠;(2)体质量为(20±3)g。排除标准:年龄>5周或<4周。
1.2 方法
1.2.1 实验材料 TRIzol Reagent总 RNA 提取试剂盒、逆转录试剂盒和实时定量聚合酶链反应试剂盒购自美国英杰公司;PCR基因引物合成购自上海生工生物工程股份有限公司;Transwell小室(0.4 μm)购自美国Corning公司;siRNA-TEM8购自北京华泰生物科技有限公司;BD Matrigel基质胶购自北京博蕾德生物科技有限公司;青霉素-链霉素双抗购自美国Signa Alderich生物科技有限公司;胎牛血清购自美国Gibco公司。
1.2.2 细胞培养 卵巢癌人脐静脉内皮细胞(HUVEC)细胞购自上海中科院细胞库,将解冻后的细胞转移至含1%青霉素、链霉素与10%胎牛血清的DMEM培养基中进行悬浮培养,在5% CO2、37 ℃恒温条件下进行培养,当细胞处于对数生长期时进行传代,其中部分细胞经siRNA-TEM8转染。
1.2.3 癌组织体积及重量 采用标准饲料与饮用水喂养,饲养温度保持在(25±2)℃,相对湿度保持在(40±2)%。总共进行适应性饲养7 d后进行实验。对照组与实验组分别向裸鼠腋窝中部外侧皮下接种处于对数生长期的正常HUVEC细胞与沉默TEM8的HUVEC细胞100 μl建立卵巢癌皮下移植瘤模型,接种完成后继续饲养14 d。饲养过程中对照组死亡2只,剔除;实验组有2只裸鼠未成瘤,剔除;最终每组选取8只动物进行后续实验。待模型建立完成2周后处死裸鼠,通过游标卡尺测量模型建立后各时期的肿瘤体积,随后处死裸鼠并分离皮下卵巢癌肿瘤组织并称重,根据组织肿瘤计算抑瘤率,抑瘤率=[(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%]。
1.2.4 实时荧光定量 PCR(real-time PCR) 将两组卵巢癌组织分别置于液氮中磨碎,加入适量TRIzol试剂,通过匀浆机进行匀浆处理,随后进行分层、沉淀、清洗及溶解等步骤制得RNA备用。随后通过逆转录试剂盒将总RNA逆转录为cDNA,再通过实时定量聚合酶链反应试剂盒与TEM8、VEGF及CD34上下游引物混合离心,随后于PCR仪上进行扩增,循环完成后做溶解曲线。以采集到的荧光信号值(Ct值)进行相对定量分析。引物信息(5’-3’):TEM8上游引物TGCTGCACCACTGGAATGAAATC,下游引物CTCCTCCTGGCAGAACTTTCTGG;VEGF上游引物TCGAGACCCTGGTGGACATC,下游引 物 CACACAGGACGGCTTGAAGA;CD34上 游引物TCCTGCTGTGCAAAGTGTTC,下游引物AGTAAGGAGGAGGGGGAGAC;β-actin上游引物TCAGGTCATCACTATCGGCAAT;下游引物AAAGAAAGGGTGTAAAACGCA。
1.2.5 血管生成实验 将BD Matrigel基质胶提前1 d放入4 ℃冰箱过夜,使其复溶成液态,次日取出胶体以 1 200 r/min 离心 5 min。离心后加入 6 孔板,在37 ℃恒温箱放置45 min。随后将经过处理的两组细胞分别消化成细胞悬液后加入孔中,每孔200 ml,重复3孔,静置一定时间,使所有细胞都沉淀至BD Matrigel基质胶表面后放入37℃恒温箱中孵育12 h,结束后通过显微镜观察血管生成情况。
1.2.6 Transwell试验 将Transwell小室的上室中加入无血清的DMEM培养基并培养1 h使膜层亲水,随后弃去培养基,上室加入200 μl的HUVEC细胞悬液,随后向下室按分组加入含有不同成分的培养基,每组设置5组复孔,将培养板置于培养箱中放置过夜。次日取出小室,用PBS清洗2次,加入浓度为5%的多聚甲醛在4 ℃条件下进行固定,随后再次使用PBS清洗2次,加入0.1%结晶紫室温条件下开始染色,放置5 min后于显微镜下观察聚碳酸酯膜表面上下左右和中间5个视野范围的细胞并计数,然后计算出每个视野范围内的平均值作为各组细胞迁移数量。
1.3 统计学处理
2 结果
2.1 两组肿瘤组织体积与重量比较
在建立模型2周内,可见实验组裸鼠各时间点卵巢癌肿瘤体积均小于对照组,差异有统计学意义(P<0.05),见图1、表1。模型建立2周后,实验组裸鼠肿瘤平均重量为(0.185±0.021)g,明显低于对照组的(0.317±0.032)g,差异有统计学意义(P<0.05),其抑瘤率为(41.38±0.54)%。
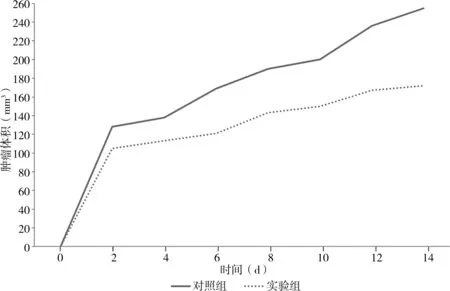
图1 各时间点两组裸鼠卵巢癌肿瘤体积生长曲线
表1 两组各时间点裸鼠卵巢癌肿瘤体积比较[mm3,(±s)]
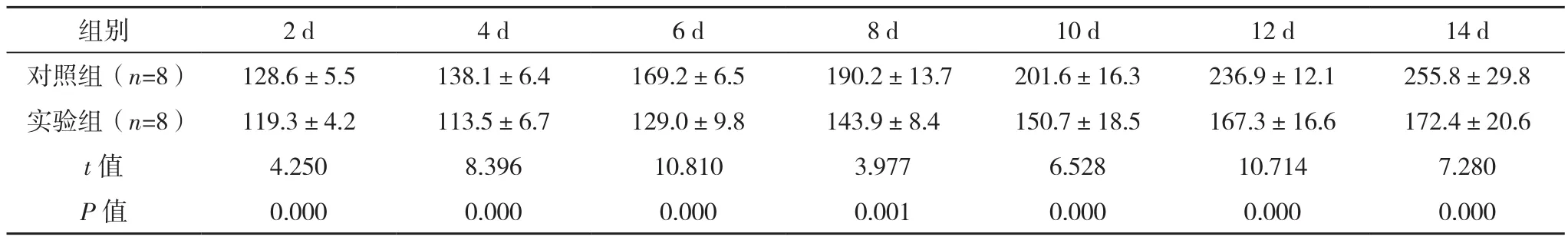
表1 两组各时间点裸鼠卵巢癌肿瘤体积比较[mm3,(±s)]
组别 2 d 4 d 6 d 8 d 10 d 12 d 14 d对照组(n=8) 128.6±5.5 138.1±6.4 169.2±6.5 190.2±13.7 201.6±16.3 236.9±12.1 255.8±29.8实验组(n=8) 119.3±4.2 113.5±6.7 129.0±9.8 143.9±8.4 150.7±18.5 167.3±16.6 172.4±20.6 t值 4.250 8.396 10.810 3.977 6.528 10.714 7.280 P值 0.000 0.000 0.000 0.001 0.000 0.000 0.000
2.2 两组卵巢癌组织中TEM8、VEGF及CD34水平比较
RT-PCR结果显示,经TEM8沉默后,实验组裸鼠卵巢癌组织中TEM8、VEGF与CD34水平均明显低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组卵巢癌组织中TEM8、VEGF与CD34水平比较(±s)
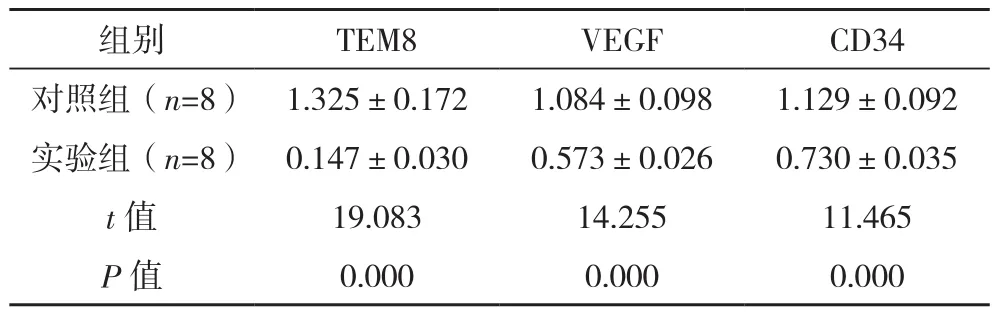
表2 两组卵巢癌组织中TEM8、VEGF与CD34水平比较(±s)
组别 TEM8 VEGF CD34对照组(n=8) 1.325±0.172 1.084±0.098 1.129±0.092实验组(n=8) 0.147±0.030 0.573±0.026 0.730±0.035 t值 19.083 14.255 11.465 P值 0.000 0.000 0.000
2.3 两组HUVEC细胞肿瘤血管生成比较
血管生成实验结果显示,经处理的HUVEC细胞在BD Matrigel基质胶中孵育后,实验组细胞管状结构生成数量(22.5±4.4),明显少于对照组的(53.7±8.2),差异有统计学意义(t=9.483,P<0.05),见图 2。
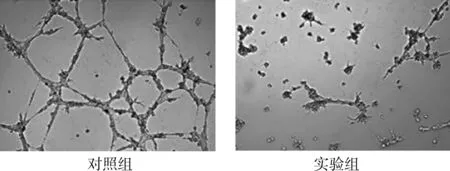
图2 两组细胞血管生成情况(×200)
2.4 两组卵巢癌HUVEC细胞迁移与侵袭能力
Transwell结果显示,沉默TEM8后,实验组细胞迁移率为(12.5±2.3)%,与对照组细胞迁移率(32.7±6.2)%相比明显较少,差异有统计学意义(t=8.640,P<0.05)。
3 讨论
卵巢癌细胞发生恶性增殖转移是多步骤、多因素、多机制参与的过程,这与细胞侵袭和迁移等恶性生物学行为有关[6]。卵巢癌作为女性生殖系统发病率第三、死亡率第一的恶性肿瘤而受到广大关注,通常情况下患者的5年生存率不超过45%。近些年来随着医疗技术的不断进步,越来越多的肿瘤治疗方法从基础研究发展成为临床疗法。其中手术治疗联合化疗作为传统的卵巢癌临床治疗技术虽然已经较为成熟,由于症状出现时往往是疾病的中晚期,因此卵巢癌的治疗效果往往受到易复发转移、新生血管生成等特点所产生的不良影响[7],因此开发出新型的抗卵巢癌药物,从靶点阻止卵巢癌血管生成与侵袭迁移是一种较为可行的办法。
血管生成是指从现有的毛细血管生成新的血管的过程,血管生成是非常复杂而又重要的生物学过程,它是很多生物学功能的基础,包括血管的发展、再生和修复等。血管生成是机体发育的正常现象,但在肿瘤组织中,新生血管的生成往往与肿瘤发展具有紧密的联系[8]。与正常的新生血管不同,肿瘤新生血管往往不具备完整的结构,是由血管盲端与体内动静脉短路形成,并会使血管壁通透性增强,向肿瘤组织延伸。且肿瘤组织新生血管虽然尤为密集,但缺少组织供氧,这些微环境的变化会继而引起癌细胞的侵袭与迁移。
在一些研究中,新生肿瘤血管生成后会引起肿瘤组织加速增长,且发生转移的概率随着肿瘤血管的增加而增加,因此抑制肿瘤血管生成或许能够作为肿瘤治疗的新的方向[9]。目前VEGF是国内外研究肿瘤血管生成的重要靶点[10],与在血管中表达的VEGF及与在新生血管内高表达的CD34不同[11-12],TEM8是近些年来被发现仅仅表达于肿瘤相关血管中的因子,属于Ⅰ型跨膜蛋白,能够与细胞骨架蛋白相互作用从而介导细胞的运动如增殖、迁移及血管的生成,且在一些研究中发现TEM8在卵巢癌组织中高表达[13]。在本研究中,笔者通过沉默卵巢癌HUVEC细胞中的TEM8,观察其表现。本研究结果显示,在体内实验中,沉默TEM8不仅能够抑制肿瘤发展的速度与程度,同时能够降低裸鼠卵巢癌组织中血管生成相关因子VEGF及CD34的表达水平。体外实验结果同样说明,沉默TEM8后卵巢癌HUVEC细胞的血管生成及迁移侵袭能力受到了明显的抑制。
综上所述,在本研究中卵巢癌组织中TEM8表现出的高表达水平提示TEM8或许拥有作为卵巢癌的治疗靶点的潜力,此外低水平的TEM8能够显著抑制卵巢癌细胞的血管生成与侵袭迁移能力,进一步说明了TEM8可能以促肿瘤因子的身份作为卵巢癌的治疗靶点。本研究为卵巢癌的分子靶向治疗提供了一定依据。
