H型高血压患者血浆Hcy水平、凝血因子与动脉硬化、心室肥厚的相关性
2022-09-13邓小如钟海洋练露萍
邓小如,钟海洋,练露萍
(惠州市中心人民医院,1.医学检验科;2.心血管内科;3.超声医学科,广东 惠州 516001)
高血压是临床最常见的心血管疾病,其发病率逐年升高且发病年龄趋于年轻化,其冠心病、脑病、慢性肾病等并发症是影响患者预后的主要原因[1]。H型高血压是指合并外周血同型半胱氨酸(Hcy)水平升高的原发性高血压,患者机体并存高血压和高同型半胱氨酸血症(HHcy)的双重疾病状态,故危害性高于单纯原发性高血压。H型高血压患者会出现冠心病、脑卒中风险的明显提升,国外的学术观点已将HHcy作为心脑卒中一级预防中的危险因素[2],而在我国高血压的患者中,H型高血压患者的比例高达75%~80%[3],HHcy与高血压均为冠心病、脑卒中的独立危险因素且存在协同作用[4],但其确切机制并未完全阐明。因此,深入分析H型高血压针对靶器官的损害机制,对于指导临床预防和治疗工作具有重要的意义。动脉硬化和心室结构改变是导致冠心病持续进展、心功能下降的主要病理机制,近年来的大量研究证实了H型高血压患者的血浆Hcy水平与其动脉硬化、心室肥厚的发生和进展密切相关,多种损害机制假说应运而生[5],凝血功能异常是其中的重要组成部分,但相关研究一般选取常规凝血纤溶指标作为观察指标,研究结果分歧较多,且缺乏针对凝血因子异常作用机制的临床研究证据。因此,本研究拟探讨H型高血压患者血浆Hcy水平与凝血因子及动脉硬化、心室肥厚的相关性。
1 资料与方法
1.1 一般资料
选取2019年5月至2021年5月在惠州市中心人民医院就诊的436例高血压患者作为研究对象,根据是否为H型高血压将患者分为研究组(H型高血压患者,n=220)和对照组(单纯高血压患者,n=216),选取同期在医院接受体检的300名非高血压受检者作为体检组,3组研究对象均签署知情同意书自愿参与本研究。纳入标准:(1)高血压的诊断依据《中国高血压防治指南(2018年修订版)》[6],诊断标准:在未应用降压药物情况下非同日3次测量诊室血压,收缩压(SBP)>140 mmHg和(或)舒张压(DBP)>90 mmHg,在既往有高血压史且目前正在应用降压药物情况下,血压低于上述标准仍诊断为高血压。(2)H型高血压的诊断依据《H型高血压诊断与治疗专家共识》[7],诊断标准:在确诊原发性高血压的前提下血浆Hcy水平>10 μmol/L。体检组研究对象均经血压测量、询问病史和药物应用史排除高血压。排除标准:(1)合并恶性肿瘤、肝肾功能不全、血液系统疾病;(2)长期血压控制不佳或终末期高血压并发症;(3)明确诊断为继发性高血压、肥厚型心肌病、扩张型心肌病、心瓣膜病、心脏发育畸形或非冠心病原因致心功能下降;(4)具有心绞痛、心肌梗死病史。
1.2 观察指标
1.2.1 基础资料 通过查阅门诊记录、住院病历和体检报告,对三组研究对象的年龄、性别构成、体质量指数(BMI)、合并糖尿病、吸烟史及SBP、DBP、血清肌酐(sCr)、血尿素氮(BUN)、血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平等基础资料进行比较。
1.2.2 血浆Hcy水平 以乙二胺四乙酸(EDTA)抗凝真空试管采集3组研究对象的空腹外周血样本,门诊患者的采血时间为就诊当日,住院患者的采血时间为住院次日,体检者的采血为体检当日,以3 000 rpm离心20 min后分离血浆样本,采用循环酶法对血浆Hcy水平进行检测,检测仪器为Solution3 AXSYM免疫分析仪(美国雅培公司),试剂盒购自北京康思润业生物技术有限公司。
1.2.3 血浆凝血因子水平 取上述血浆样本,采用酶联免疫吸附试验法对血浆凝血因子(blood coagulation factor,F)Ⅰ、FⅡ、FⅤ、FⅦ、FⅧ、FⅨ、FⅩ、FⅪ、FⅫ水平进行检测,检测仪器为InfiniteM1000Pro型多功能酶标仪(瑞士帝肯公司),试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
1.2.4 颈动脉硬化情况 在完成上述采血操作后对三组研究对象行颈动脉超声检查,检查仪器为F3型彩色超声多普勒诊断仪(日立阿洛卡公司),设置探头频率为6~12 MHz,分别对受检者的双侧颈总动脉、颈动脉分叉处、颈内动脉、颈外动脉的内膜中层厚度(IMT)进行检测,连续测量3个心动周期,取平均值作为最终测量值,当IMT不规则增厚超过1.3 mm时判定为动脉硬化斑块形成。
1.2.5 左心室肥厚情况 于完成颈动脉超声检查后立即对三组研究对象行超声心动图检查,检查仪器同颈动脉超声检查,检查时嘱患者取左侧卧位,设置探头频率为2~4 MHz,对受检者的左室舒张末期内径(LVDd)、室间隔厚度(IVST)、左室后壁厚度(LVPWT)进行测量,采用Deiereux公式计算左心室质量指数(LVMI),计算公式:LVMI=左心室质量/体表面积;左心室质量=0.8×1.04×[(IVST+LVPWT+LVDd)3-LVDd3]+0.6。心室肥厚的判定标准为:男性LVMI>115 g/m2或女性LVMI>95 g/m2。
1.3 统计学分析
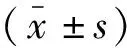
2 结果
2.1 3组研究对象基础资料的比较
体检组、对照组、研究组研究对象的血清TG、TC、LDL-C水平依次升高,研究组或对照组患者的SBP、DBP水平均高于体检组,各组间的差异均有统计学意义(P<0.05);研究组或对照组患者合并糖尿病、具有吸烟史的比例均高于体检组,各组间的差异均有统计学意义(P<0.05)。见表1。
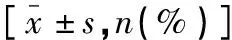
表1 3组研究对象基础资料的比较
2.2 3组研究对象血浆Hcy、凝血因子水平的比较
体检组、对照组、研究组研究对象的血浆Hcy、FⅤ、FⅦ、FⅧ、FⅩ水平依次升高,各组间的差异均有统计学意义(P<0.05)。见表2。
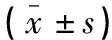
表2 3组研究对象血浆Hcy、凝血因子水平的比较
2.3 3组患者颈动脉硬化、左心室肥厚情况的对比
体检组、对照组、研究组研究对象的IMT、LVMI水平依次升高,各组间的差异均有统计学意义(P<0.05);体检组、对照组、研究组研究对象的颈动脉硬化、左心室肥厚患病率依次升高,各组间的差异均有统计学意义(P<0.05)。见表3。

表3 3组患者颈动脉硬化、左心室肥厚情况的对比n(%)]
2.4 H型高血压患者血浆Hcy水平与凝血因子水平及动脉硬化、心室肥厚程度的相关性分析
直线相关分析结果显示,研究组患者的血浆Hcy水平与血浆FⅤ、FⅦ、FⅧ、FⅩ水平及IMT、LVMI水平均呈正相关(P<0.05)。患者的血浆FⅤ、FⅦ、FⅧ、FⅩ水平与IMT、LVMI水平均呈正相关(P<0.05)。见表4及表5。
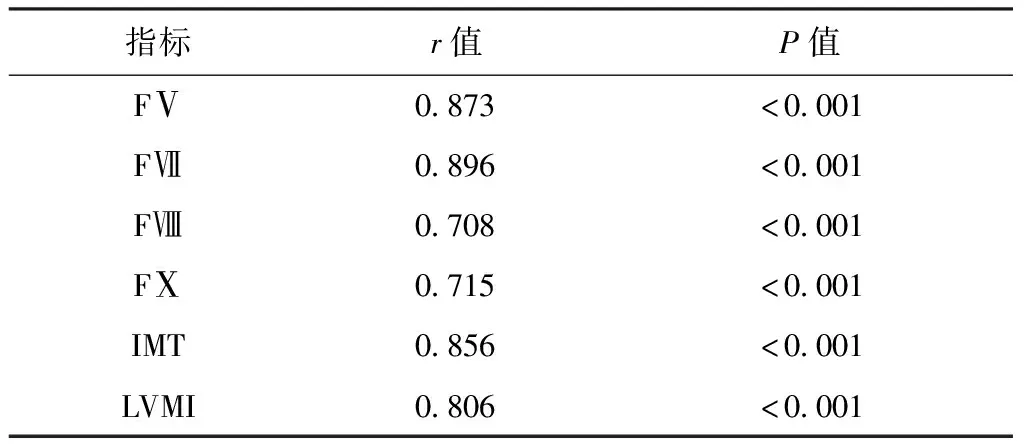
表4 H型高血压患者血浆Hcy水平与凝血因子水平、IMT、LVMI水平的相关性
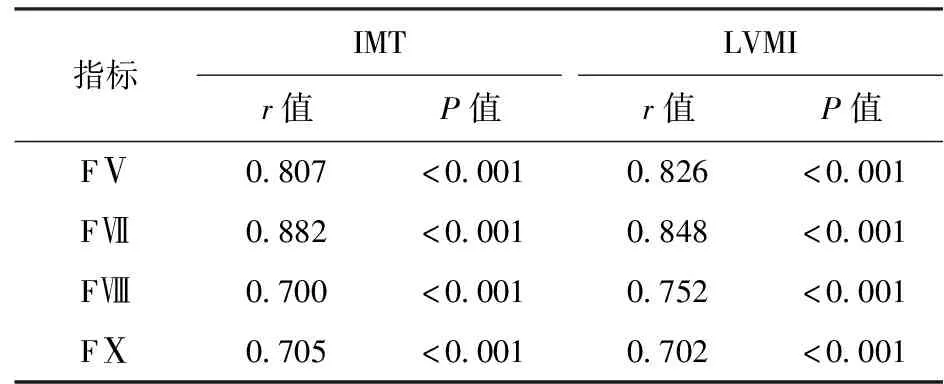
表5 H型高血压患者血浆凝血因子水平与IMT、LVMI水平的相关性
3 讨论
本研究中,H型高血压患者的颈动脉硬化、左心室肥厚患病率和程度均高于单纯高血压患者,脂质代谢紊乱更加严重,而患者的血浆Hcy水平与上述病变程度均具有相关性,这与相关研究[8]结果一致。高血压合并HHcy可发挥显著的协同作用,导致血管疾病的风险比可高达11.3[9];高血压患者的血浆Hcy水平每升高5 μmol/L,其卒中风险可增加59%,而血浆Hcy水平每降低3 μmol/L,其卒中风险可降低24%[10]。本研究未观察到H型高血压患者即时血压水平与单纯高血压患者存差异,HHcy提升高血压患者靶器官损害风险的直接原因可能是其对患者血压产生不良影响。既往研究[11-12]发现,高血压患者血浆Hcy水平与其血压水平呈线性正相关关系,而与降压药物的降压疗效呈线性负相关关系,与单纯高血压患者相比较,H型高血压患者的血压降幅和血压达标率均较低,在开展叶酸或饮食干预降低其血浆Hcy水平后,其血压控制效果也会得到相应的改善。H型高血压患者的24 h SBP及其变异性、24 h DBP变异性更高,而较高的血压变异性是导致高血压患者的颈动脉IMT提升和左心室肥厚的独立危险因素[13-15]。此外,H型高血压患者的动态脉压和血压晨峰均较高,非杓型血压节律患者比例较多,易出现室性心律失常和复杂性心律失常[16],而这些特征也会进一步促进患者颈动脉粥样硬化及左心室肥厚的发生。另一方面,血浆Hcy水平的升高还可导致患者出现氧化应激、内质网应激、血管内皮细胞损伤、血液粘稠度增高、钙信号紊乱等病理改变[17],并导致更严重的脂质代谢紊乱,这与高血压产生了协同作用。除了本研究中报道的脂质代谢指标外,既往研究[18-19]还发现C反应蛋白、血管紧张素Ⅱ受体、血管紧张素转换酶及Th1、Th2、Th17等效应T细胞亚群均可能参与了H型高血压合并左心室肥厚的病理过程。因此,虽然H型高血压患者的靶器官损害机制仍有待进一步的研究予以讨论,但患者血浆Hcy水平可作为评价其动脉硬化和心室肥厚风险及病变程度的实验室指标。
本研究显示,与单纯高血压患者比较,H型高血压患者存在部分血浆凝血因子表达水平升高,其血浆Hcy水平与这些凝血因子水平具有相关性,而且凝血因子水平也与颈动脉硬化、左心室肥厚程度具有相关性,这提示了血浆Hcy水平导致凝血因子表达异常可能是H型高血压患者靶器官的机制之一。Hcy水平升高与血栓类疾病的发生具有相关性,其主要机制可能与血管内皮功能损害、血小板异常激活、凝血因子异常活化、凝血-纤溶功能失衡有关[20]。有研究[21]观察到发生静脉血栓的肿瘤患者血浆Hcy水平明显升高,与之相伴随的是部分血浆凝血因子水平升高;而高血压患者血压变化节律、颈动脉斑块稳定性也与FⅠ、FⅡ、FⅤ、FⅦ、FⅧ、FⅩ等血浆凝血因子表达有关[22-23]。在四种存在差异的凝血因子中,FⅦ、FⅤ与血浆Hcy、IMT、LVMI的相关性较强,FⅦ是机体外源性凝血途径的首个催化酶,也参与了内源性凝血启动途径,是生理和病理凝血反应的主要启动因子。血浆FⅦ水平升高也被认为是冠心病和缺血性脑卒中的独立危险因素,特别是与心肌梗死、心源性猝死等主要心血管事件密切相关[24]。遗传因素和环境因素均可对人体的血浆FⅦ水平产生影响,一方面,中国汉族人群中存在着FⅦ基因突变,特定的FⅦ基因型可能是促进高血压患者发生心脑血管疾病的遗传危险因素[25];另一方面,HHcy、糖尿病、血脂代谢异常、肥胖等代谢性疾病可能也会促进血浆FⅦ水平的升高,血浆Hcy水平升高可能通过损害血管内皮功能导致血管氧负荷增加和过氧化物堆积,降低了一氧化氮活性,而这种炎症应激损害导致了血浆FⅦ水平和血液粘度的升高,最终诱发血小板聚集、血栓形成及动脉粥样硬化[26]。FⅤ是一种具有促凝与抗凝双重作用的凝血因子,不仅能够活化FX、诱导凝血酶原复合物形成、激活凝血酶原,而且能够对组织因子途径抑制物和活化蛋白C的抗凝作用进行调控。Hcy水平升高导致血浆FⅤ表达上调的机制是Hcy可能通过诱导低密度脂蛋白氧化、损伤血管内皮细胞、促进血管平滑肌细胞增殖、提升血栓素活性等[27],但目前的临床证据尚不支持FⅤ基因多态性与心脑卒中显著相关的结论,其确切作用机制还需要进一步的研究进行讨论。
综上,H型高血压患者存在部分血浆凝血因子表达上调,其水平与动脉硬化、心室肥厚程度具有相关性,血浆Hcy水平与上述病理变化程度均相关,凝血因子表达异常可能是H型高血压靶器官损害的机制之一。
