超高效液相色谱-三重四极杆质谱法评价白芍-甘草对抑郁大鼠大脑皮层中神经递质含量的影响
2022-09-13杜晖杨会鸽刘鹏鸣任静西安市食品药品检验所西安70054空军军医大学第二附属医院药剂科西安70038
杜晖,杨会鸽,刘鹏鸣,任静(.西安市食品药品检验所,西安 70054;2.空军军医大学第二附属医院药剂科,西安 70038)
抑郁症是以显著而持久的心境低落为主要临床特征的慢性综合性脑疾病。随着生活与工作节奏的加快,抑郁症的发病率逐年上升。全球抑郁症患者约为3.4亿,且患者数量还在以每年11.3%的速率增长[1-2]。5-羟色胺(5-hydroxytryptamine,5-HT)是中枢神经系统的神经递质,它与应答反应和大脑血流变化的调节密切相关[3]。5-HT、去甲肾上腺素(norepinephrine,NE)和多巴胺(dopamine,DA)等单胺类神经递质在正常生物体内存在动态平衡,参与抑郁发生的全过程[4]。分析这些单胺递质可为包括抑郁症在内的多种神经系统疾病机制的研究提供重要依据。通常这类神经递质的检测方法有液相色谱-电化学检测[5-6]、荧光检测[7-8]和质谱联用法[9-10]。质谱法以其灵敏度高而特别适用于神经递质类物质的定量分析。白芍、甘草是治疗抑郁症较常用的配伍组合,在四逆散、逍遥散和柴胡舒肝散等众多古方中均有记载。本研究采用超高效液相色谱-三重四极杆质谱(UPLC-MS/MS)法考察白芍-甘草药对对抑郁大鼠大脑中神经递质含量的影响,从而进一步探讨这种变化与抑郁发生的关系。
1 仪器与试药
1.1 仪器
Xevo TQ-S超高效液相色谱-三重四极杆质谱联用仪(美国Waters公司);Milli-Q Advantage超纯水机(美国Merck Millipore公司);MS105十万分之一天平(瑞士Mettler-Toledo公司);BSA124S-CW万分之一天平(德国Sartorius公司);HC-3018R低温冷冻高速离心机(合肥科大创新股份有限公司)。
1.2 试药
白芍和甘草饮片(市售药材,产地陕西,经空军军医大学第二附属医院孙涛副主任药师鉴定为符合《中国药典》2020年一部要求的合格饮片);重酒石酸去甲肾上腺素(批号:100169-201103,纯度:94.5%)、盐酸多巴胺(批号:100070-201006,纯度:100.0%)和5-HT(批号:111656-200101,纯度:100.0%)对照品(中国食品药品检定研究院);盐酸丁螺环酮片(规格:5 mg,批号:20210509,江苏恩华药业股份有限公司);4-乙基邻苯二酚(4-EC,美国Sigma公司);甲醇、乙腈、甲酸和乙酸(色谱纯,德国Merck公司);高氯酸和乙二胺四乙酸二钠(EDTA-2Na)(分析纯,上海国药集团化学试剂有限公司);健康SD大鼠(5~7周龄,约250 g,西安交通大学实验动物中心,动物合格证号:SCXK2007-001)。
2 方法
2.1 溶液的制备
2.1.1 样品溶液的制备 白芍饮片1000 g,10倍水合煎3次,减压浓缩至每毫升相当于饮片2 g;白芍、甘草饮片各500 g,10倍水合煎3次,减压浓缩至每毫升相当于饮片2 g。
2.1.2 蛋白沉淀溶液的制备 取高氯酸和EDTA-2Na适量,用水稀释制成含0.1 mol·L-1高氯酸和0.1 mmol·L-1EDTA的蛋白沉淀溶液。
2.1.3 内标工作溶液的制备 精密称取4-EC适量,用蛋白沉淀溶液配制成质量浓度为1 μg·mL-1的溶液。
2.1.4 混合对照品溶液的制备 精密称取重酒石酸去甲肾上腺素、盐酸多巴胺和5-HT对照品各10 mg,置同一100 mL量瓶中,加甲醇适量,振摇使溶解,用甲醇稀释至刻度,作为储备液;精密量取储备液1 mL,置100 mL量瓶中,用蛋白沉淀溶液稀释至刻度;再精密量取上述溶液0.2、0.5、1、2、5和10 mL,置100 mL量瓶中,分别加入内标工作溶液1 mL,用蛋白沉淀溶液稀释制成约2、5、10、20、50和100 ng·mL-1的混合对照品溶液。
2.2 色谱-质谱条件
2.2.1 色谱条件 安捷伦 C18色谱柱(150 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液-乙腈(90∶10);流速0.3 mL·min-1;柱温30℃;进样量1 μL。
2.2.2 质谱条件 电喷雾电离源(ESI+);接口温度:300℃;脱溶剂温度:250℃;加热块温度:400℃;雾化器流量:3.0 L·min-1;干燥器流量:10.0 L·min-1;加热器流量:10.0 L·min-1。质谱条件见表1。

表1 4种化合物的质谱分析参数Fig 1 MS parameters of the 4 compounds
2.3 慢性应激大鼠抑郁模型的建立
雄性SD大鼠50只,分笼饲养,随机分成A~E 4组,每组10只。A为空白组,B为模型组,给予蒸馏水;C为阳性对照组,按照1.0 mg·kg-1剂量灌胃给予丁螺环酮;D和E分别为白芍组和白芍-甘草组,按照5 g·kg-1剂量灌胃给药。采用长期不可预见性温和应激建立慢性应激大鼠抑郁模型,除A组外,每组接受多种不同应激,包括禁食和禁水(24 h)、夹尾(2 min)、冰水游泳(5 min)、摇晃(2次·s-1,10 min)、拥挤(10只一笼)和昼夜颠倒,每日刺激1次,顺序随机,持续20 d。造模第21日,C~E组开始每日1次给药,连续给药14 d。在造模开始后,分别在每日下午4点称量每只大鼠的体质量,比较每组大鼠在体质量增长方面的差异。
2.4 蔗糖偏嗜度实验
蔗糖偏嗜度实验在禁食和禁水12 h后进行,训练开始前予大鼠适应饮用蔗糖水。训练开始后,第1日在笼内放置两瓶均装有1%蔗糖水的水瓶;第2日放置一瓶1%蔗糖水,一瓶纯水,并相隔2 h交换水瓶位置;第3日禁水禁食;第4日放置一瓶1%蔗糖水和一瓶纯水,进行2 h饮水量测定。通过称饮水瓶质量测定纯净水和蔗糖水饮用量,以快感缺乏的客观指标蔗糖偏嗜度[蔗糖偏嗜度(%)=蔗糖水饮用量/(蔗糖水饮用量+纯净水饮用量)×100%]作为衡量标准,比较造模前后各组动物蔗糖偏嗜度的变化。
2.5 样品溶液的制备
实验结束24 h后将大鼠断头处死,分取大鼠大脑皮层组织,置于预冷的生理盐水中洗尽其他残留组织,轻轻擦干,记录组织的质量。精密称取约0.2 g,在冰浴内的玻璃匀浆管中匀至糜状,加入约5 mL的蛋白沉淀液,12 000 g离心20 min,取上清液再次12 000 g离心20 min,取上清液按一定比例加入内标工作溶液,并定容至10 mL,即得。
3 结果
3.1 方法学验证
3.1.1 线性范围、检测限和定量限 精密量取“2.1.4”项下的系列混合对照品溶液,分别注入UPLC-MS/MS,以主成分峰面积与内标峰面积的比值y对质量浓度x(ng·mL-1)进行线性回归,分别以信噪比为3和10时,测定3种神经递质的检测限(LOD)和定量限(LOQ),具体见表2。
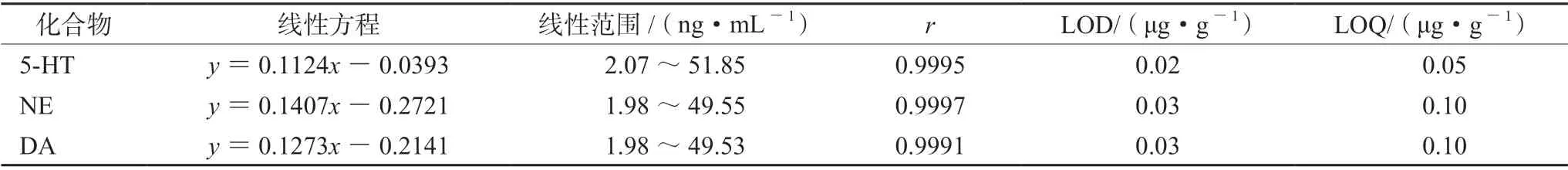
表2 3种化合物的线性方程、线性范围、相关系数、检出限和定量限Tab 2 Linear equations,ranges,correlation coefficients (r),LODs and LOQs of the three compounds
3.1.2 回收率和精密度考察 精密称取大脑皮层样品约0.20 g,置15 mL具塞离心管中,分别精密加入低、中、高3个浓度水平(0.2、0.5、2 μg·g-1)的混合对照品溶液,按“2.5”项下方法配制样品溶液,计算平均回收率,结果见表3,3种神经递质的平均回收率在83.7%~94.1%,RSD均小于9.0%。

表3 3种化合物的加样回收率(%)Tab 3 Spiked recovery of the 3 compounds (%)
3.1.3 稳定性考察 将高浓度水平的回收率测试液保存在4℃环境中,并在6、12、24和48 h后进样分析,3种化合物的含量变化小于7.2%,说明样品溶液在48 h内保持稳定。
3.1.4 流动相的考察 考察0.1%乙酸-乙腈(A)、0.1%乙酸-甲醇(B)、0.1%甲酸-乙腈(C)和0.1%甲酸-甲醇(D)等4种流动相体系对待测化合物离子化强度的影响。由于实验采用0.1 mol·L-1高氯酸作为蛋白沉淀溶液,故在水相中添加酸保持溶剂与流动相酸度大体一致,从而增强了色谱体系的稳定性。当水中添加乙酸时,5-HT的灵敏度较甲酸明显降低;同时发现3种神经递质在甲醇体系中塔板数略低,所以最终选择0.1%甲酸-乙腈作为流动相体系。
3.1.5 样品稀释溶剂的选择 实验中分别考察了蛋白沉淀溶液、流动相和水溶液作为样品稀释溶剂,结果发现流动相和水溶液的质谱信号噪音较大,且重现性较差。最终确定0.1 mol·L-1高氯酸作为样品稀释溶剂。由于金属离子会加速单胺递质的氧化,故稀释溶剂中加入0.1 mmol·L-1EDTA与金属离子络合。
3.1.6 专属性考察 分取“2.1.2”项下蛋白沉淀溶液和“2.5”项下样品溶液,按“2.2”项下色谱和质谱条件分析测定,结果如图1所示,表明蛋白稀释溶液在4种化合物峰位处均无干扰,该法具有良好的专属性。
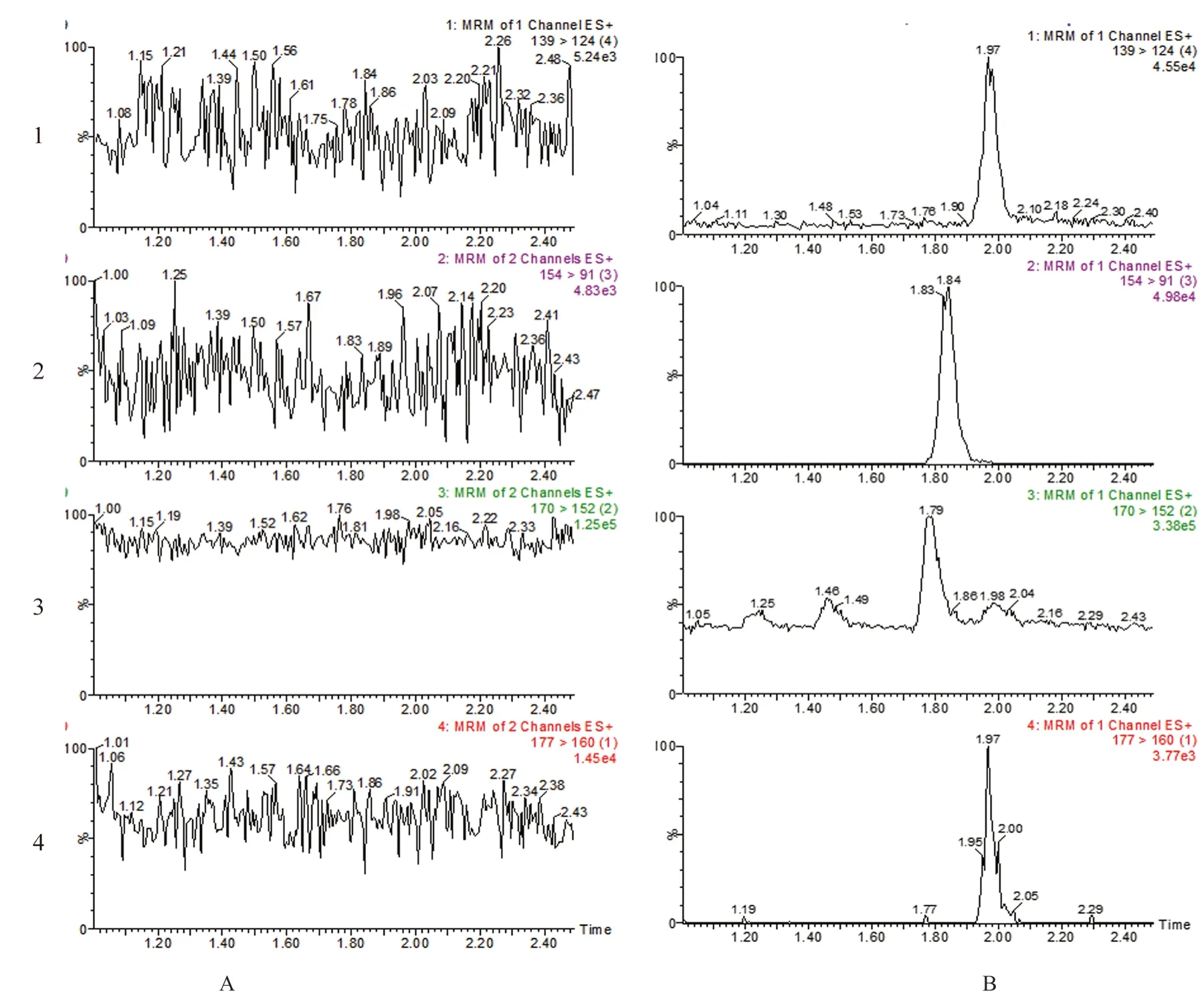
图1 4种化合物的MRM图Fig 1 MRM chromatograms of the 4 compounds
3.2 行为学测试
在应激之前,对照组大鼠蔗糖偏嗜度[(78.9±6.9)%]与模型组大鼠[(81.3±6.1)%]无明显差异(P>0.05)。造模34 d后,模型组大鼠反应迟钝,活动减少,而阳性对照组、白芍组和白芍-甘草组大鼠上述情况均有改善。与空白组比较,模型组大鼠体质量增长明显变慢(P<0.01),蔗糖偏嗜度[(48.3±2.9)%]显著降低(P<0.01),提示大鼠造模成功;与模型组比较,阳性对照组体质量增长速率和蔗糖偏嗜度[(83.1±5.8)%]百分比均明显提高(P<0.01),显著高于白芍组和白芍-甘草组(P<0.05)。
3.3 样品测定结果
如图2所示,与空白组比较,模型组大鼠大脑皮层中5-HT、NE和DA含量均明显降低(P<0.01),结合行为学指标,说明造模成功。与模型组比较,阳性对照组和药物组均能升高大鼠大脑皮层中5-HT、NE和DA的含量,其中阳性对照组变化最大,且白芍-甘草组相较于白芍组更接近空白组。
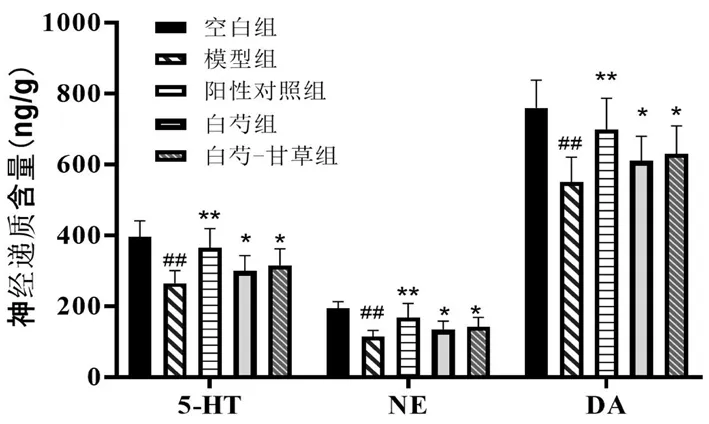
图2 药物对大鼠大脑皮层中5-HT、NE和DA含量的影响Fig 2 Effect of the drugs on the contents of 5-HT、NE and DA in the rat cerebral cortex
4 讨论
本研究采用慢性不可预见性应激法建立抑郁大鼠模型,该法操作简便、可靠性高。实验结果表明抑郁症的发病与5-HT、NE和DA等含量降低有密切关系。5-HT是抑郁病症中最重要的神经递质之一,它的降低可能引起抑郁发作。本研究选取的模型药物5-HT再摄取抑制剂丁螺环酮是新型的一线抗抑郁药物,它通过选择性地抑制5-HT重摄取,增加突触间隙内5-HT的浓度,发挥抗抑郁作用[11-12]。有研究表明,抑郁症可能会抑制NE的合成和释放,导致突触间隙中NE浓度降低[13]。脑内NE代谢产物为3-甲氧基-4-羟基苯乙二醇,其可作为评价抑郁症发生及发展的指标,提示抑郁症发生及发展与NE密切相关[14]。有报道称,与正常人比较,抑郁症患者前额叶、纹状体和海马等功能区的DA含量降低,相关突触功能下调[15]。上述研究表明3种单胺类神经递质的含量水平与抑郁症的发病有着密切关系。
尽管治疗抑郁症的化学药物不断更新,但是均有不同程度的毒副作用,如起效慢、嗜睡、体质量增加等;远期疗效不确切且存在用药依赖,复发率非常高,严重影响了在我国的临床推广和使用[16]。因此,寻求安全有效的治疗抑郁症的药物是当前亟待解决的问题。中医“抑郁”应归为郁症、虚劳等疾病。白芍具柔肝养血、敛阴止痛的功效,广泛用于郁症的防治[17-18];甘草有健脾宁心、和中缓急、调和诸药之功效[19-20],两者配伍肝脾同治,共奏缓肝和脾、益血养阴之功,为治疗郁症的常见组方。本研究结果表明,白芍-甘草配伍能显著提高大鼠大脑皮层中的单胺类神经递质的含量水平;白芍-甘草组方效果相较于白芍单药更接近空白组,但在治疗郁症中白芍-甘草不同提取部位对结果的影响及协同作用机制尚不明确。
本研究通过优化流动相和前处理步骤,建立了UPLC-MS/MS同时测定5-HT、NE和DA等3种单胺类神经递质的方法。研究表明,白芍-甘草药对较模型组能显著提升抑郁大鼠体质量增长速率和蔗糖偏嗜度百分比,并能提高抑郁大鼠大脑皮层中神经递质的含量水平。
