五步蛇蛇毒对脂多糖诱导的RAW264.7巨噬细胞炎症反应的影响研究
2022-09-13曾晓艳林雅丽刘应蛟黄玉婷龚力民刘塔斯湖南中医药大学药学院长沙40000江西中医药大学药学院南昌330004
曾晓艳,林雅丽,刘应蛟*,黄玉婷,龚力民,刘塔斯(.湖南中医药大学药学院,长沙 40000;.江西中医药大学药学院,南昌 330004)
五步蛇又名蕲蛇,学名尖吻蝮蛇,属于蝰科动物,主要分布在我国湖南、湖北、福建等黄河以南的地区,国外仅见于越南北部[1]。蛇毒是从毒蛇的毒腺中分泌出来的一种毒液,属于生物毒素,是所有毒素中结构最为复杂的一类物质,其主要化学成分为毒蛋白、多肽和酶类等二十种以上的生物活性物质[2]。在神经系统、心血管系统方面应用广泛。随着研究的不断深入,分子生物学和蛋白质组学的发展,蛇毒的一些有效成分被相继提取并应用于临床,在抗肿瘤、抗风湿、抗炎、抗凝血以及神经系统疾病治疗方面均有较好的疗效。
炎症反应是一种重要的机体防御过程,实质上是机体与致炎因子进行抗争的反应,最终使机体的内环境以及内环境和外环境之间达到新的平衡。免疫细胞激活是炎症反应的启动环节。RAW264.7巨噬细胞是炎症反应的重要效应细胞,在脂多糖(LPS)等外界因素刺激后能产生大量炎症细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)和一氧化氮(NO)等[3]。近年来神经毒素在抗炎方面的研究也成为一个热点,认为神经毒素能通过抑制多型核细胞的迁移产生一个长时程抗炎作用[4]。陶方方等[5]采用蕲蛇蛇毒对胶原诱导型关节炎大鼠血清TNF-α、基质金属蛋白酶-9(MMP-9)及金属蛋白酶组织抑制物1(TIMP-1)的影响;蕲蛇毒素对大鼠佐剂性关节炎具有抑制作用[6];蕲蛇提取物醇溶性和水溶性部位有一定的抗风湿关节炎作用[7]。目前蕲蛇蛇毒对炎症的发生发展还不明确。LPS作为触发炎症的因子,LPS与巨噬细胞膜上的Tolllike受体接触,刺激巨噬细胞,使巨噬细胞产生多种细胞因子和炎性介质,动物机体在致炎因子的作用下发生炎症反应[8]。此类致炎因子包括TNF-α、IL-6和NO等,对巨噬细胞发挥吞噬、抗原提呈及炎症调节等功能具有重要作用[9-10]。因而本实验采用LPS刺激RAW264.7细胞形成体外炎症模型,考察不同浓度蛇毒对炎性细胞因子TNF-α、IL-6、NO分泌的影响,并初步探索其作用机制,为五步蛇蛇毒的深层次开发和利用提供科学依据。
1 材料
1.1 细胞系
小鼠单核巨噬细胞系RAW264.7(普诺赛生命科技有限公司)。
1.2 试药
五步蛇蛇毒(简称蛇毒)取自湖南永州异蛇酒有限公司基地养殖的五步蛇,经低温保存,过滤处理,冷冻结成冰块后进行干燥,再真空干燥,自制得到冻干粉[11]。
PBS 缓冲液(Procell,批号:PB180327)、胎牛血清(FBS,Procell,批号:SA190501)、青霉素-链霉素溶液(双抗)(Procell,批号:PB180120)、DMEM高糖基础培养基(Procell,批号:PM150210)、LPS(Solarbio,批号:426Y039)、噻唑蓝(MTT,Solarbio,批号:309E0511)、二甲亚砜(DMSO,批号:20180105)(国药集团化学试剂有限公司);TNF-α、IL-6和NO检测试剂盒(上海江莱生物科技有限公司);核转录因子p65抗体(NF-κB p65,批号:8242T)、核转录因子κB 抑制剂激活酶抗体(Iκ,批号:3416T)和核转录因子κB 抑制蛋白抗体(IκB,批号:76041T)(美国CST);Affinity Purified Antibody peroxidase Labeled Goat anti-Rat lgG(H+L)(美 国KPL, 批 号:10232580);ECL发光液(北京普利莱基因技术有限公司,批号:P1050)。
1.3 仪器
LBI-150-L洁净工作台(苏静安泰空气技术有限公司);SW-CJ-1FD生化培养箱(上海龙跃仪器设备有限公司);NIB-100倒置显微镜(南京江南永新光学有限公司);3111 CO2培养箱、1510酶标仪(赛默飞世尔科技有限公司);LE204E102电子天平(梅特勒托利多仪器有限公司);DYCZ-40A电泳仪/转膜仪(北京六一仪器厂)。
2 方法
2.1 MTT法检测蛇毒对RAW264.7 细胞的毒性
2.1.1 细胞处理 将RAW264.7细胞复苏后,混悬于含10% FBS,1%双抗的DMEM培养基中,37℃、5%CO2培养箱培养,2~3 d换液和传代1次。
2.1.2 MTT法检测细胞存活率 取生长状态良好、密度达到80%~90%的RAW264.7细胞,密度为2×105个·mL-1、100 μL/孔接种于96孔板中,37℃、5%CO2培养箱中培养12 h。实验分为空白对照(Kb)组和不同蛇毒浓度组(1、5、10、25、50、100、200、300 μg·mL-1),每组平行6孔。蛇毒用DMEM培养基配制,并用0.22 μm滤膜过滤。对照组换含10% FBS、1%双抗的DMEM培养基,蛇毒组分别加入不同浓度的蛇毒,放入37℃、5%CO2培养箱中继续培养24 h。然后避光加入5 mg·mL-1MTT 100 μL于各孔中,继续培养4 h。弃去培养液,每孔加入100 μL DMSO,恒温振荡器上振荡10 min,用酶标仪于490 nm处测定其吸光度,计算细胞存活率(%)=(实验组平均OD值/对照组平均OD值)×100%。
2.2 细胞分组处理
参考“2.1.2”的实验结果,取无细胞毒性的蛇毒浓度25、50和100 mg·L-1。取处于生长对数生长期的RAW264.7细胞(2×108个·L-1)移于6孔板,37℃、5%CO2培养箱培养12 h。细胞分为空白对照(Kb)组、模型(LPS)组、蛇毒25、50和100 mg·L-1组,各组设3个复孔。除空白对照组外,其余组细胞蛇毒预处理2 h,然后加入LPS 1 mg·L-1,培养 24 h。吸取各组上清液,3000 r·min-1离心10 min,-20℃保存备用。
2.3 ELISA方法检测蛇毒对TNF-α、IL-6 和NO炎症因子分泌或生成的影响
取“2.2”项下上清液,采用小鼠 TNF-α、IL-6和NO检测试剂盒测定上清液中 TNF-α、IL-1β和IL-6 的含量。
2.4 Western blot法检测 NF-κB p65、IκK、IκB的蛋白表达
取“2.2”项下上清液,用预冷的PBS 洗涤细胞后加入磷酸酶抑制剂(100∶1∶1)混合液,刮取贴壁细胞,冰上裂解 30 min,然后4℃、12 000 r·min-1,离心30 min,取2 mL上清液用于蛋白浓度测定,其余样品加入4×Loading Buffer,95℃金属浴5 min,-80℃冻存。选用10%Gel和5%SDS-PAGE浓缩胶进行电泳,完成后将蛋白转至PVDF膜上,用5% TBST稀释的BSA溶液室温孵育2 h,加入一抗(1∶1000)过夜,TBST漂洗3次,每次10 min;加入二抗曝光。灰度扫描用Image J软件定量分析蛋白条带,以β-Actin作为内参,检测目的蛋白的表达变化。
2.5 数据处理与统计
数据采用 Graphpad 软件进行分析,组间比较采用双尾t检验,以P<0.05 为差异有统计学意义。灰度扫描用Image J软件定量分析蛋白条带,以β-Actin作为内参,检测目的蛋白的表达变化。
3 结果
3.1 蛇毒对RAW264.7 细胞存活率的影响
结果见图1,与空白对照组比较,蛇毒300 μg·mL-1组细胞存活率明显降低(P<0.05),当蛇毒质量浓度在 0~200 μg·mL-1时,细胞存活率差异均无统计学意义(P>0.05),即蛇毒对RAW264.7 细胞没有毒性作用(见图1)。综合考虑选择25、50、100 μg·mL-1作为蛇毒低、中、高剂量组进行后续实验。

图1 蛇毒对 RAW264.7 细胞活性的影响Fig 1 Effect of agkistrodon acutus venom on the cell viability of RAW264.7 cells
3.2 蛇毒对LPS刺激RAW264.7细胞分泌炎性细胞因子影响
与空白对照组相比,LPS组中的TNF-α、IL-6和NO分泌水平显著增加(P<0.001)。与LPS组比较,蛇毒25、50、100 μg·mL-1剂量组的TNF-α、IL-6 和NO分泌水平均显著降低(P<0.05,P<0.01,P<0.001),并且呈剂量依赖性,见图2。
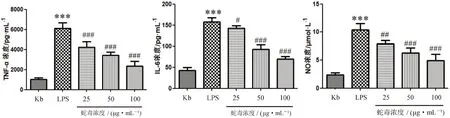
图2 蛇毒对 TNF-α、IL-6 和NO分泌的影响Fig 2 Effect of agkistrodon acutus venom on the secretion of TNF-α,IL-6, and NO
3.3 蛇毒对LPS诱导RAW264.7细胞的中NFκB p65、IκK、IκB蛋白表达影响
与空白对照组比较,LPS组NF-κB p65及IκK蛋白表达显著上调(P<0.001),而IκB蛋白表达显著下调(P<0.001)。予以蛇毒干预后25μg·mL-1组的NF-κB p65及IκK蛋白表达显著降低(P<0.01),IκB蛋白表达没有明显变化(P>0.05);蛇毒50 μg·mL-1和100μg·mL-1组 的NF-κB p65及IκK蛋白表达显著降低(P<0.001),IκB蛋白表达显著升高(P<0.01,P<0.001),结果见图3。
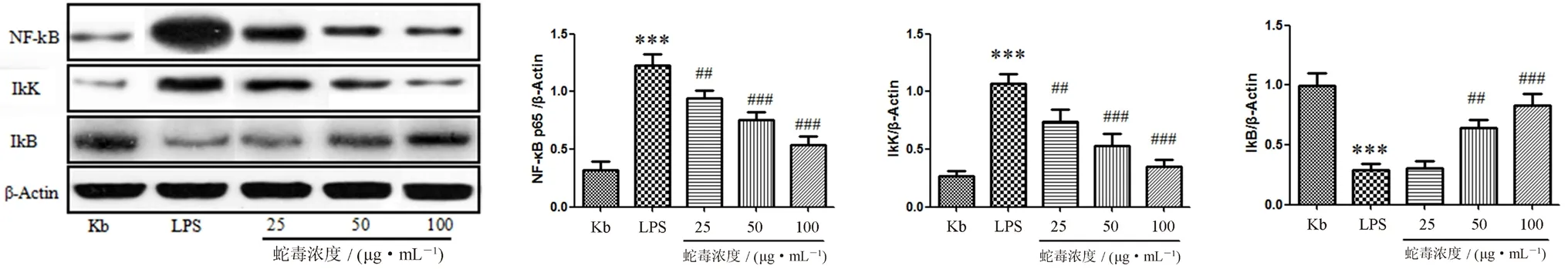
图3 蛇毒对LPS诱导RAW264.7细胞的中NF-κB p65、IκK、IκB蛋白表达影响Fig 3 Effect of agkistrodon acutus venom on the protein expression of NF-κB p65,IκK,and IκB in RAW264.7 cells stimulated by LPS
4 讨论
TNF-α是由单核细胞-巨噬细胞受到促炎因子的刺激后合成和释放的一种关键性促炎性蛋白[11],具有广泛生物学活性的炎性介质。TNF-α的生物活性受其浓度高低的影响,在正常情况下,机体内TNF-α的浓度较低,有抗肿瘤、抗感染、促进B细胞增殖分化等多种生理功能,可调节免疫应答,是机体免疫防护的重要介质;而当TNF-α浓度过高时,反而会作为重要的炎症递质介导炎症反应的病理生理过程,能增加微血管壁的通透性,并刺激中性粒细胞及内皮细胞表面黏附受体,趋化中性粒细胞等炎症细胞,启动炎症反应,介导感染引起的炎症损害[12]。IL-6是机体T细胞经过活化后分泌的一种重要免疫调节因子,与TNF-α相似,并且与TNF-α共同参与调节炎症反应,作为一种促炎因子,为反映机体炎症程度的重要指标[13]。NO是具有生物活性的气体分子,其大量生成与炎症密切相关,在急性炎症部位会通过细胞毒性效应引起细胞损伤,进而引起炎症相关疾病的发生和发展[3]。本研究采用ELISA法测定相关促炎因子的含量水平,结果表明,与模型组比较,蛇毒低、中、高剂量(25、50、100 μg·mL-1)组均可以通过抑制TNF-α和IL-6分泌以及NO释放,从而达到抗炎的效果。提示蛇毒低、中、高剂量组的抗炎作用与其能够抑制促炎因子TNF-α、IL-6和NO的释放有密切关系。
核转录因子κB(NF-κB)广泛存在于细胞质中,参与机体的炎性反应、免疫应答及细胞的生长调控等过程。在静息状态下,NF-κB与抑制蛋白IκB结合形成复合体,被稳定在细胞质中而不能发挥其基因转录调控的功能[14]。当细胞受到外源性刺激,如TNF-α、IL-1β、IL-6、NO、T细胞激活剂、生长因子及病毒感染等,NF-κB 诱导激酶(NIK)为IκK的上游激酶,NIK可引起IκKα与IκKβ相应位点的磷酸化,通过级联反应,使IκBs 磷酸化而与NF-κB解离,致使NF-κB 被激活[15]。可见NF-κB信号通路对炎症反应的发生发展过程发挥着重要作用。王君燕等[16]证明獐牙菜苦苷对LPS诱导的炎症模型中TNF-α、IL-6的生成具有抑制作用,其机制可能与抑制NF-κB通路相关因子p65、IKK-α的表达有关。陈谱等[17]认为芍药苷可以阻止NF-κB通路激活,抑制软骨细胞炎症及延缓软骨退变。赵康博等[18]认为30~240 mg·L-1辣椒碱可以显著降低由LPS诱导的My D88和NF-κB mRNA的表达,提示辣椒碱的抗炎活性可能与NF-κB信号通路有关。本研究采用Western blot法检测各组细胞中NF-κB p65、IκK及IκB表达水平。结果显示,蛇毒50 μg·mL-1和100 μg·mL-1组NF-κB p65及IκK蛋白表达水平显著降低(P<0.001),而IκB表达显著升高(P<0.01,P<0.001)。
现代药理研究认为蛇毒具有镇痛(类似吗啡样镇痛作用包括缓解恶性肿瘤疼痛、神经痛和关节痛等),抗风湿,抗肿瘤以及神经系统疾病治疗方面的作用[19]。目前,研究者们对于蛇毒粗毒应用于抗炎作用以及机制的研究报道甚少,本实验采用LPS刺激RAW264.7细胞形成体外炎症模型,观察了蛇毒干预后LPS诱导的RAW264.7细胞 中NF-κB信号通路NF-κB p65、IκK、IκB表达含量变化,发现蛇毒可以显著抑制LPS诱导的NF-κB信号通路激活。
综上,本研究结果表明,五步蛇蛇毒可能抑制TNF-α和IL-6分泌以及NO生成,从而达到抗炎的作用,其作用机制可能是上调NF-κB p65及IκK表达水平,下调IκB表达水平,激活NF-κB信号通路来抑制炎症反应的发生。
