生物制剂联合免疫抑制剂对炎症性肠病患者营养状况及炎症反应的影响
2022-09-08郝艳萍韩靓滕圣智王琳
郝艳萍 韩靓 滕圣智 王琳
炎症性肠病是一种常见的肠道疾病,其临床症状主要是腹泻、腹痛等,若患者未能采取及时有效的治疗,病情将进一步发展,出现营养不良、肠穿孔等并发症,严重影响其生活质量[1]。现阶段,临床治疗炎症性肠病主要是采用免疫抑制剂(如硫唑嘌呤)药物,其可改善患者病情,但其在临床应用中的治疗效果仍有待提高[2]。生物制剂是一种多肽免疫制剂,其具有高活性的特点,而英夫利西单抗(杂交嵌合IgG1单克隆抗体)便属于一种生物制剂,其在临床中常用于治疗急性腹泻等疾病[3]。本研究旨在探讨炎症性肠病患者应用生物制剂、免疫抑制剂联合治疗的效果,以便寻找出更有效的治疗方案,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年10月-2020年10月南京大学医学院附属盐城第一医院收治的60例炎症性肠病患者作为研究对象。纳入标准:符合文献[4]《炎症性肠病诊断与治疗的共识意见(2018年·北京)》中的诊断标准;经影像学及临床症状检查确诊;伴有腹泻、腹痛等临床症状等。排除标准:合并恶性肿瘤;对本研究采用的生物制剂、免疫抑制剂过敏;有精神疾病;严重肝、肾等功能严重受损等。根据随机数字表法将其分为对照组(30例)与研究组(30例)。对照组病程4个月~11年,平均(3.59±0.88)年;活动性:缓解阶段13例,活动阶段17例;男16例,女14例;年龄19~64岁,平均(43.54±4.78)岁;溃疡性结肠炎:20例,克罗恩病:10例。研究组病程4个月~12年,平均(3.62±0.86)年;活动性:缓解阶段14例,活动阶段16例;男17例,女13例;年龄20~64岁,平均(43.23±4.58)岁;溃疡性结肠炎:21例,克罗恩病:9例。两组基础资料比较差异无统计学意义(P>0.05),有可比性。此研究已经本院医学伦理委员会审核并批准,患者及家属知情同意。
1.2 方法
对照组予以免疫抑制剂治疗:口服硫唑嘌呤片(上海信谊药厂有限公司,国药准字H31021422,规格:50 mg),1.5~4 mg/(kg·次),1 次 /d。研究组在对照组的基础上予以生物制剂治疗:静脉输注注射用英夫利西单抗(海正生物制药有限公司,国药准字 S20210039,规格:100 mg),5 mg/(kg·次),在首次给药后的第2、6周及以后每隔8周各给予一次相同剂量。两组均连续治疗8个月。
1.3 观察指标及评价标准
(1)临床疗效:治疗后使用文献[5]《成人炎症性肠病处理指南》中的相关诊疗标准进行评估两组临床疗效,其中显效:治疗后患者临床症状基本消失,且经实验室检查黏膜基本恢复正常;有效:治疗后患者临床症状明显改善,且经实验室检查黏膜伴有轻度的炎症;无效:治疗后患者临床症状及经实验室检查黏膜无明显变化甚至恶化。总有效率=显效率+有效率。(2)营养状况:治疗前后,取两组静脉血(5 ml),并将其置于离心装置中(3 000 r/min,10 min)进行离心,而后取血清,血清转铁蛋白(TF)、血红蛋白(Hb)、前白蛋白(PA)、白蛋白(ALB)水平检测使用全自动生化分析仪。(3)炎症因子:检测血清白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、白细胞介素-4(IL-4)、白细胞介素-17(IL-17)水平。治疗前后,两组采血、血清制备的方法与(2)中的方法相同,血清IL-10、IL-4、TNF-α、IL-17水平检测使用酶联免疫法。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗后,研究组、对照组临床总有效率分别为93.33%、73.33%,其中研究组总有效率明显比对照组更高(P<0.05),见表1。
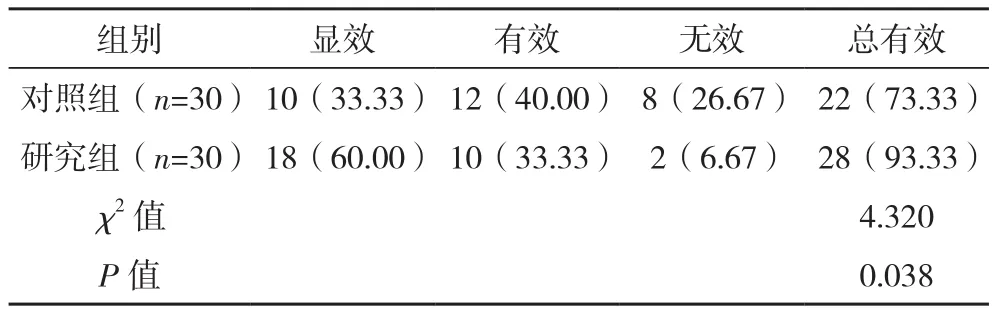
表1 两组临床疗效比较[例(%)]
2.2 两组营养状况比较
两组治疗后血清ALB、TF、PA、Hb水平较治疗前均升高,且研究组血清ALB、TF、PA、Hb水平均比对照组更高(P<0.05),见表2。
表2 两组营养状况比较(±s)
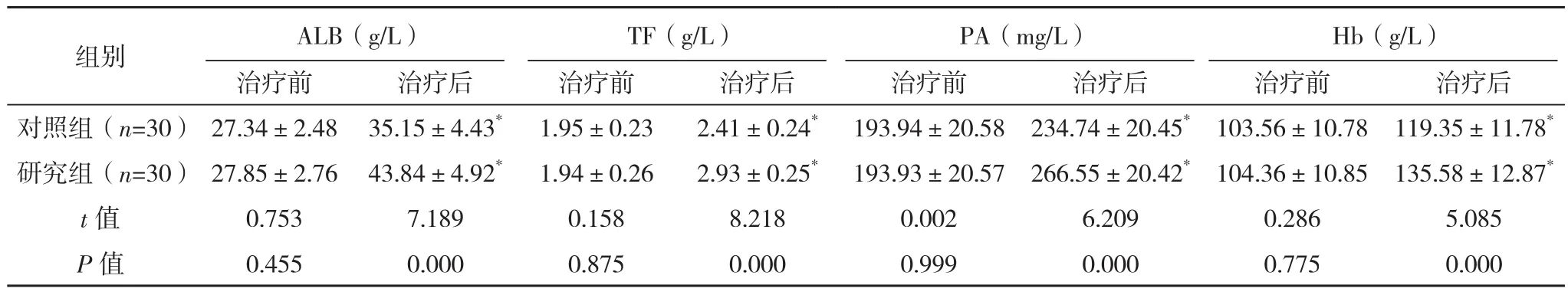
表2 两组营养状况比较(±s)
*与本组治疗前比较,P<0.05。
组别 ALB(g/L)TF(g/L)PA(mg/L)Hb(g/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=30) 27.34±2.48 35.15±4.43* 1.95±0.23 2.41±0.24* 193.94±20.58 234.74±20.45* 103.56±10.78 119.35±11.78*研究组(n=30) 27.85±2.76 43.84±4.92* 1.94±0.26 2.93±0.25* 193.93±20.57 266.55±20.42* 104.36±10.85 135.58±12.87*t值 0.753 7.189 0.158 8.218 0.002 6.209 0.286 5.085 P值 0.455 0.000 0.875 0.000 0.999 0.000 0.775 0.000
2.3 两组炎症因子比较
两组治疗后血清IL-10、IL-4、TNF-α、IL-17水平较治疗前均降低,且研究组血清IL-10、IL-4、TNF-α、IL-17水平均比对照组更低(P<0.05),见表3。
表3 两组炎症因子比较[pg/L,(±s)]
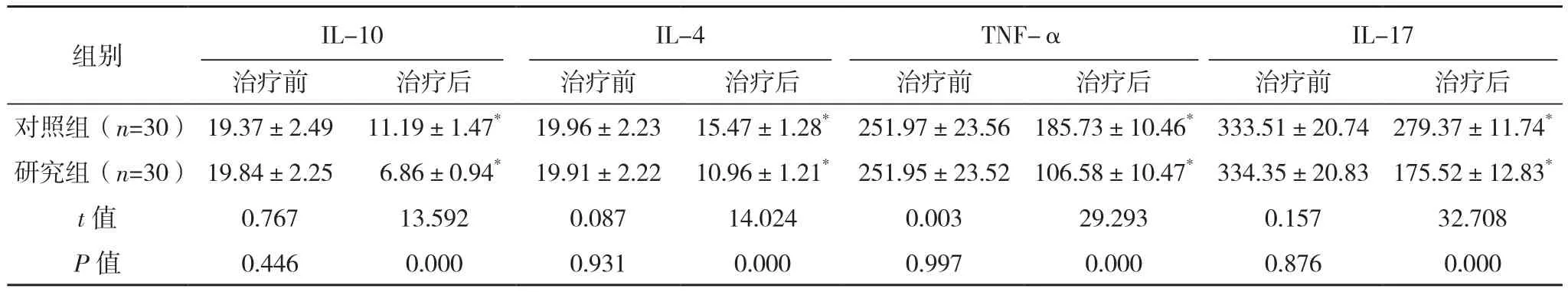
表3 两组炎症因子比较[pg/L,(±s)]
*与本组治疗前比较,P<0.05。
组别 IL-10IL-4TNF-αIL-17治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=30) 19.37±2.49 11.19±1.47* 19.96±2.23 15.47±1.28* 251.97±23.56 185.73±10.46*333.51±20.74 279.37±11.74*研究组(n=30) 19.84±2.25 6.86±0.94* 19.91±2.22 10.96±1.21* 251.95±23.52 106.58±10.47*334.35±20.83 175.52±12.83*t值 0.767 13.592 0.087 14.024 0.003 29.293 0.157 32.708 P值 0.446 0.000 0.931 0.000 0.997 0.000 0.876 0.000
3 讨论
由遗传、环境等因素可导致肠道发生慢性非特异性的炎症损伤,即为炎症性肠病[6-7]。硫唑嘌呤作为一种免疫抑制剂,其主要是通过抑制T淋巴细胞,改善免疫功能,促进肠道屏障结构恢复,进而减轻病情,但其在应用中部分患者易出现迟发性超敏反应、血液系统紊乱等并发症[8]。
炎症性肠病可破坏肠道上皮屏障功能,进而使得营养状况不佳。而英夫利西单抗(生物制剂)主要是通过调节肠道菌群,同时促进黏膜的快速愈合,进而改善肠道黏膜屏障功能,减轻机体的营养不良及相关临床症状和体征,增强身体功能,促进患者恢复[9]。以上述的结果可以看出,研究组治疗后的血清ALB、TF、PA、Hb水平及临床总有效率均高于对照组(P<0.05),表明炎症性肠病患者应用生物制剂、免疫抑制剂联合治疗,可有效缓解患者的临床症状,改善营养状况,提高临床疗效,与吕翠翠等[10]研究结果基本一致。血清IL-10可用于反映机体的炎症状态,其水平升高表明患者的炎症进程加剧,病情加重;IL-4水平降低减轻患者炎症损伤,病情好转;TNF-α是一种促炎因子,可参与机体的炎症反应,故其水平升高可加重患者炎症损伤,使其病情恶化;血清IL-17可直接或间接地促进、诱导多种细胞因子、炎症因子等合成、释放,进而引发感染,造成炎症损伤,故其水平越低表明患者的炎症反应进程越缓慢,肠道损伤越小,有利于恢复。炎症性肠病可激活淋巴细胞、巨噬细胞,导致免疫系统紊乱,继而促使细胞因子与炎性介质水平升高,加剧炎症反应,诱发炎症性肠病发生。生物制剂英夫利西单抗对TNF-α产生较强的特异性与亲和性,同时还可影响免疫级联反应中多个环节,进而直接或间接地发挥抗炎作用,促进患者恢复[11-14]。以上述的结果可以看出,研究组治疗后血清IL-10、IL-4、TNF-α、IL-17水平均较对照组更低(P<0.05),表明炎症性肠病患者应用生物制剂、免疫抑制剂联合治疗,可有效抑制其炎症反应,且效果显著,与尧小青等[15]研究结果基本一致。
综上,炎症性肠病患者应用生物制剂、免疫抑制剂联合治疗,可有效缓解其临床症状,抑制炎症反应,改善营养状况,且效果显著,值得临床推广应用。
