注射用兰索拉唑与常用输液的配伍稳定性及禁忌*
2022-09-08王士贞刘英丽李阳郝志君蔡欣欣刘春宇
王士贞,刘英丽,李阳,郝志君,蔡欣欣,刘春宇**
(1.佳木斯精神病人福利院护理部,黑龙江佳木斯154007;2.佳木斯大学附属第一医院普通外科一病区,黑龙江佳木斯154002)
注射用兰索拉唑是一种可抑制胃酸分泌的质子泵抑制剂,主要成分为兰索拉唑,为白色至类白色疏松块状物,对于基础胃酸分泌和由组胺、胆碱及食物引起的胃酸的形成与分泌具有强力持久的抑制作用,在酸相关性疾病、幽门螺旋杆菌根除的治疗中价值较高[1]。该药存在一定的配伍禁忌[2],使用不当会引起严重不良反应[3],影响患者治疗效果。基于此,本研究选择注射用兰索拉唑与4 种临床常用输液药物进行配伍,分析配伍结果,现报道如下。
1 材料与方法
1.1 材料
注射用兰索拉唑(生产厂家:山西威奇达光明制药有限公司,批准文号:国药准字H202223016,规格:30mg)、注射用兰索拉唑(生产厂家:日本武田药品工业株式会社,批号:H181,规格:30mg)、葡萄糖(生产厂家:山东仁和堂药业有限公司,批号:110703)、0.9%氯化钠注射液(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H32025239,规格:100ml:0.9g)。由我院药理试验小组(由资历较深、经验丰富的医师、技师、护士组成)进行配伍实验,确保研究的客观性。
1.2 所用仪器
高效液相色谱仪(生产厂家:德国赛默飞世尔科技(中国)有限公司,型号:UHPLC);pH计(生产厂家:武汉吉尔德科技有限公司,型号:MT-5000)。
1.3 方法
1.3.1 色谱条件
①色 谱 柱:Inertsil ODS-VP(150 mm×4.6 mm,5 μm);②流动相:甲醇-水-三乙胺-磷酸为640∶360∶5∶1.5,采用磷酸将pH 调节为7.3;③流速:每分钟10 ml;④检测波长:284 nm;⑤柱温:40 ℃;⑥进样量:10 μl。
1.3.2 实验方法
①颜色、pH 变化情况的实验方法[4]:采用葡萄糖、0.9%氯化钠(0.9%NS),依次配制10%葡萄糖(10%GS)、5%葡萄糖(5%GS)、5%葡萄糖氯化钠(5%GNS)。依据临床注射用兰索拉唑的使用方法,于100ml 的0.9%NS、10%GS、5%GS、5%GNS 中,分别加入10ml 灭菌注射用水,可得4 份空白溶液。分别取注射用兰索拉唑-A(山西威奇达光明制药)、注射用兰索拉唑-B(日本武田药品工业株式会社),采用10ml 的灭菌注射用水进行溶解,之后将其分别加入至100ml 的0.9%NS、10%GS、5%GS、5%GNS 中,得四种配伍溶液。于温度为25 ℃的室温条件下,于配伍的第0、2、4、6、8、12 h,对其颜色、pH 变化情况进行详细观察。②含量、相关物质变化情况的实验方法[5]:依次精密地量取5ml 的4 种配伍溶液,将其置于10ml 的容量瓶中,采用蒸馏水进行定容,对各溶液的含量进行测定,以0h 注射用兰索拉唑含量为100%,对样品在各输液中的相对百分含量、相关物质进行计算。
2 结果
2.1 兰索拉唑在4 种溶液中溶液颜色变化情况
两个厂家的注射用兰索拉唑与0.9%NS 配伍最稳定,于配伍的第0、2、4、6、8、12h 均呈无色;与10%GS、5%GS 配伍,于配伍的第0、2、4h 均呈无色,于配伍的第6、8、12h 均呈微黄色;与5%GNS 配伍的第0、2、4、6h 均呈无色,于配伍的第8、12 h 均呈微黄色,见表1。

表1 兰索拉唑在4 种溶液中溶液颜色变化情况
2.2 注射用兰索拉唑在4 种溶液中pH 变化情况
与10%GS、5%GS、5%GNS 相比,两种厂家生产的注射用兰索拉唑与0.9%NS 配伍的各时间点pH 均更大,且随着配伍时间的增加,pH 均呈下降趋势,见表2。
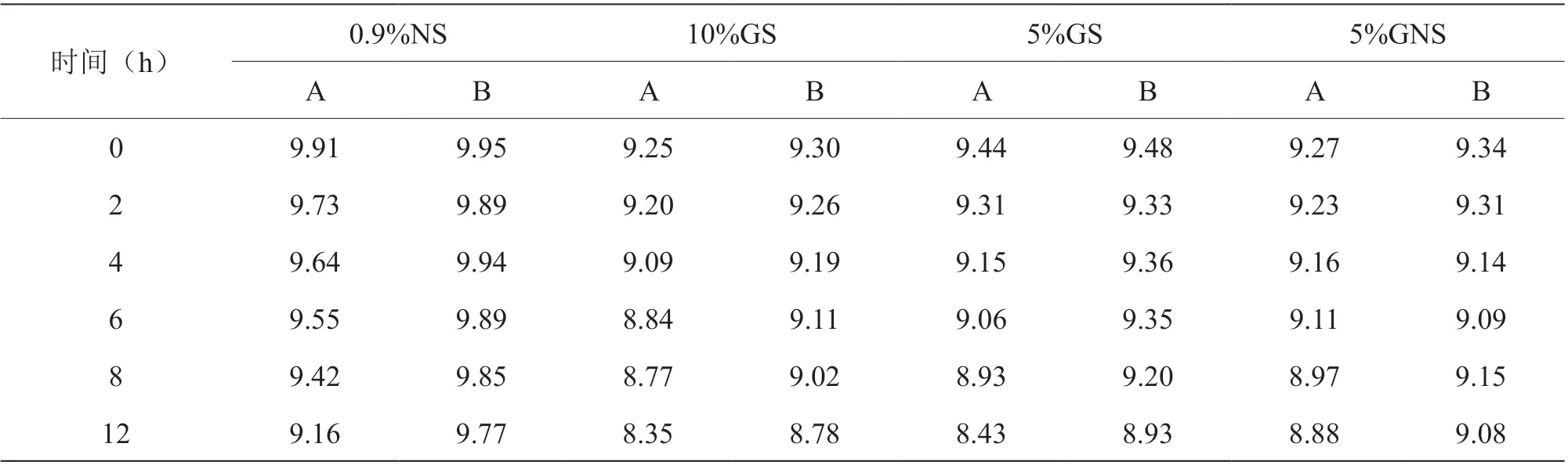
表2 注射用兰索拉唑在4 种溶液中pH 变化情况
2.3 注射用兰索拉唑在4 种溶液中含量变化情况
注射用兰索拉唑在4 种溶液中含量变化随配伍时间的增加呈递减趋势,而于配伍的第6h,注射用兰索拉唑-A 与0.9%NS 配伍的含量仍高于99.30%,高于同时间点与10%GS、5%GS、5%GNS配伍的含量,见表3。

表3 注射用兰索拉唑在4 种溶液中含量变化情况(%)
2.4 注射用兰索拉唑在4 种溶液中相关物质变化情况
两种厂家生产的注射用兰索拉唑与4 种溶液在配伍的不同时间点,溶液中相关物质变化均呈递减趋势,但与10%GS、5%GS、5%GNS 相比,与0.9%NS 配伍的有关物质递减幅度最小,且于配伍12h 时仍低于1%,稳定性较好,而与其他三种溶液配伍4h 后均超过1%,稳定性较差,见表4。

表4 注射用兰索拉唑在4 种溶液中相关物质变化情况(%)
3 讨论
3.1 配伍稳定性分析
兰索拉唑为一种难溶性药物,在酸性条件下不稳定,易分解,其稳定性会随pH 的增加而增加[6]。本研究结果表明,两个厂家的注射用兰索拉唑与0.9%NS 配伍的不同时间均呈无色;与10%GS、5%GS 配伍的第0、2、4h 均呈无色,第6、8、12h 均呈微黄色;与5%GNS 配伍的第0、2、4、6h 均呈无色,于配伍的第8、12h 均呈微黄色。且与10%GS、5%GS、5%GNS 相比,两种厂家生产的注射用兰索拉唑与0.9%NS 配伍的各时间点pH 均更大,提示注射用兰索拉唑与0.9%NS 配伍的各时间均不会导致溶液颜色发生变化,药物降解率较低,稳定性最好。
3.2 联合用药配伍禁忌分析
依据《中国药典》,注射用兰索拉唑配伍溶液于室温、4~8℃条件下放置,6h 内微粒数基本符合药典要求。若这些不溶性微粒随药液进入人体,会导致人体出现血管栓塞、输液反应等不良后果,应引起高度重视。本研究结果表明,配伍6h 后,注射用兰索拉唑-A 与0.9%NS 配伍的含量仍高于99.30%,高于同时间点与10%GS、5%GS、5%GNS 配伍的含量。两种厂家生产的注射用兰索拉唑与4 种溶液在配伍的不同时间点溶液中相关物质变化均呈递减趋势,但与10%GS、5%GS、5%GNS 相比,与0.9%NS 配伍的有关物质递减幅度最小,且于配伍12h 时仍低于1%,稳定性较好,而与其他三种溶液配伍4h 后均超过1%,稳定性较差,提示在配伍的同一时间点,注射用兰索拉唑与10%GS、5%GS、5%GNS 配伍会导致相关物质、含量出现明显变化,稳定性比较差,还会影响用药的安全性,而注射用兰索拉唑与0.9%NS配伍的含量、有关物质最稳定,安全性最高[7]。但值得注意的是,注射用兰索拉唑说明书提示“溶解后应尽快使用,勿保存”,使用时应严格按照说明书要求,并建议在阴凉处放置、避免强光照射,且最好在4h 内使用[8]。
3.3 总结
综上所述,与其他溶液相比,注射用兰索拉唑与0.9%NS 配伍后,溶液颜色不会发生变化,pH最大,药物含量、有关物质变化更小,稳定性更强。建议注射用兰索拉唑与0.9%NS 配伍,且于配伍后的6h 内使用完,以保证临床用药的安全性。
