肝细胞癌微波消融术后迟发性膈疝1例报告
2022-09-08王晓栋张玉蓉朱晓宁
王晓栋, 张玉蓉, 朱晓宁, 郑 丁, 汪 静
西南医科大学附属中医医院 肝胆病科, 四川 泸州 646000
微波消融(MWA)已成为目前早期或不适合手术切除的肝癌患者的重要治疗手段之一,膈疝是其较为罕见的并发症。现将1例高龄肝细胞癌(HCC)患者经MWA术后并发迟发性膈疝,腹腔镜下行右侧膈疝回纳及膈肌修补术治疗后恢复良好的病例报道如下。
1 病例资料
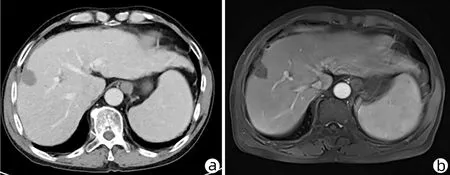
患者男性,70岁,2018年5月14日因“发现乙型肝炎肝硬化4年余,肝区占位3个月”入本院,3个月前门诊MRI检查发现肝右后叶S5与S8交界处占位(图1a),诊断为HCC。入院后完善术前检查,AFP 163.1 ng/mL,PLT 59×109/L;肝功能:ALT 91 U/L、AST 53 U/L、GGT 102 U/L;心电图:窦性心动过缓、心前区R波增高、提示V4~V6导联早期复极;胸部CT示:双肺多发结节及纤维灶;双肺多发肺大疱;纵隔淋巴结少许肿大,主动脉弓少许钙化,左心室增大;胸椎退变、侧弯。扫描层面示:肝硬化,脾大。考虑患者年龄大,肝硬化失代偿,血小板水平低,病灶较小,且患者不愿行手术切除,故在局麻下经超声引导行肝肿瘤MWA术(图2)。在超声引导下,先行确定病灶位置及进针路线,进针时先经正常肝组织部分后再进入肿瘤病灶,进针深度7 cm(肝内4 cm),超声确认针尖到达对侧病灶后,开始消融,功率为50 w,时间6 min。手术顺利,未发现相关并发症及其他不适。术后1、3、6个月行常规影像学随访均未发现肿瘤复发。2019年1月随访MRI发现肝S7段小结节影(图1b),考虑系肿瘤复发,故再次在CT引导下行肝肿瘤MWA术,功率为40 w,时间12 min,手术顺利,2个月后影像学随访未见异常(图3)。
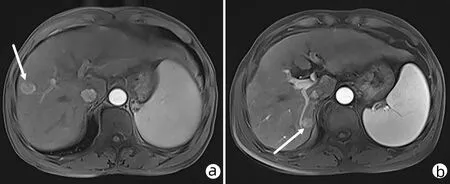
注:a,2018年5月门诊,S5与S8交界处占位(白色箭头);b,2019年 1月随访,S7占位(白色箭头)。图1 MRI检查结果Figure 1 MRI images
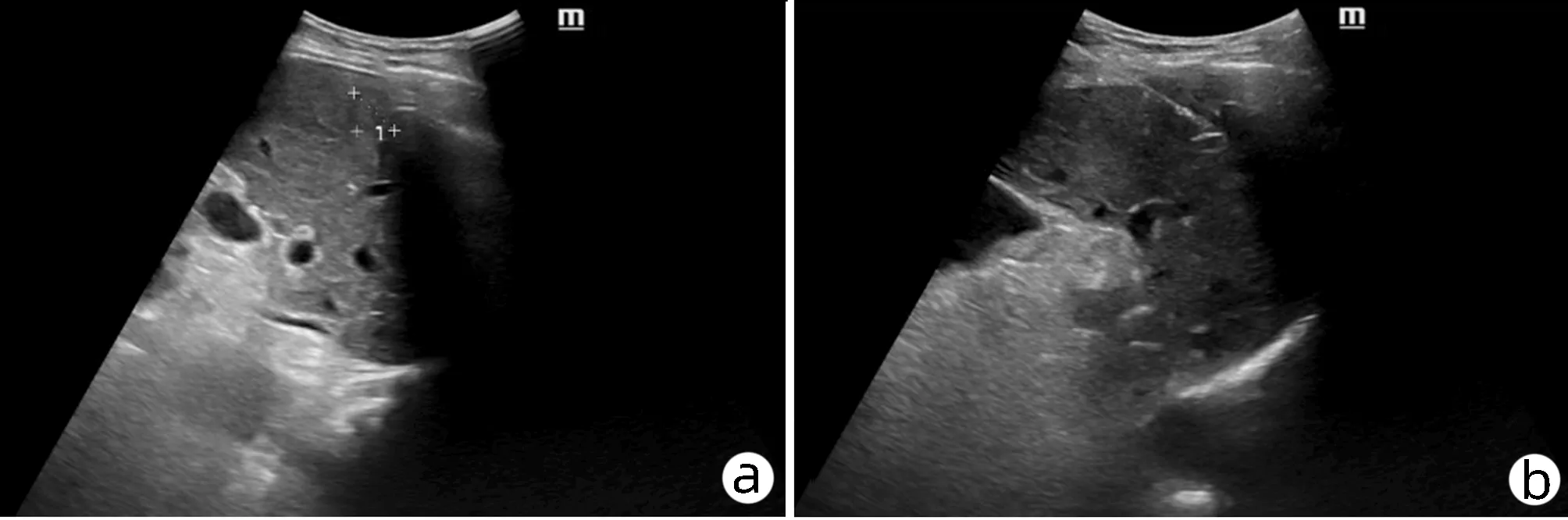
注:a,术前; b,术中; c,术后。图2 超声检查结果Figure 2 Ultrasonic images

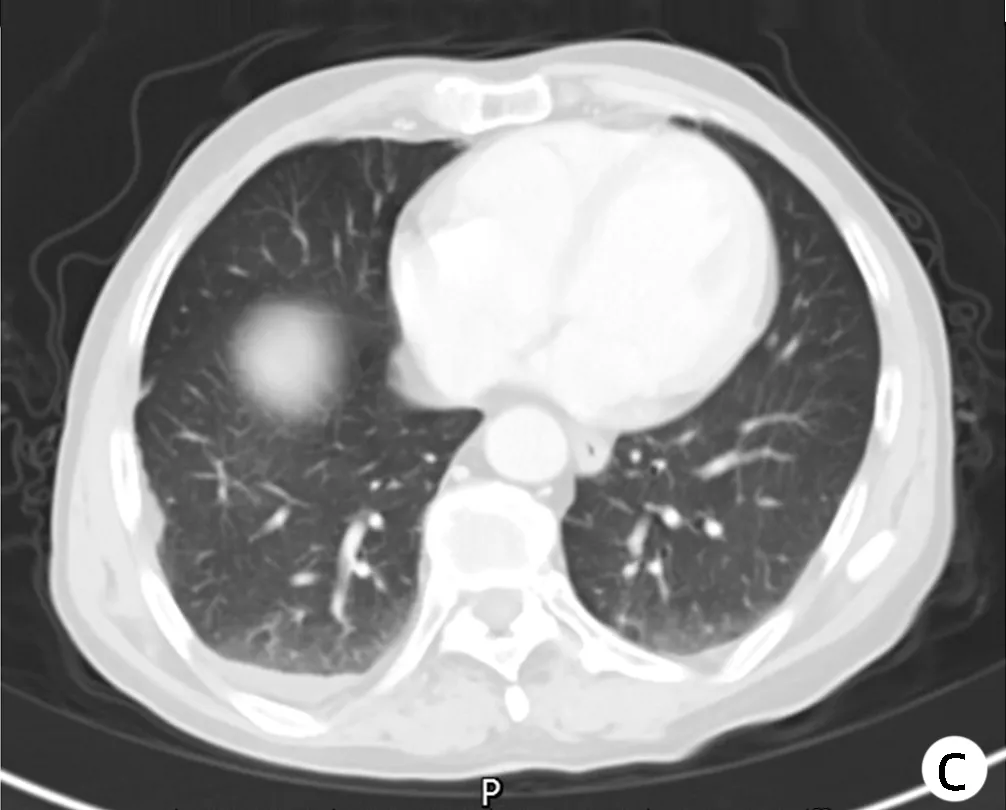
注:未见膈疝影像学表现。图3 2019年3月随访CT检查结果Figure 3 CT images in March 2019
2019年4月14日,患者因“突发右上腹部剧烈疼痛”再次入本院,疼痛呈胀痛样,进食后加重,无恶心、呕吐、心慌、胸闷,无畏寒、发热、肛门停止排气、排便等不适,腹部CT(图4)示:右侧膈肌欠连续,结肠肝曲突入右侧胸腔内,考虑膈疝可能性大;右肺炎症,右侧胸腔少量积液;心包少量积液。排除相关手术禁忌后,行腹腔镜探查术发现右侧膈肌有一直径约4 cm缺损,横结肠肝曲及部分大网膜疝入,疝入的横结肠水肿明显(图5),未见坏死,立即行腹腔镜探查+右侧膈疝回纳+膈肌修补+小切口辅助横结肠修补+右侧胸腔闭式引流术,将疝入胸腔的网膜及结肠回纳入腹腔。术后患者恢复良好出院,2019年11月、2020年5月及2021年8月影像学随访均未见明显异常(图6)。
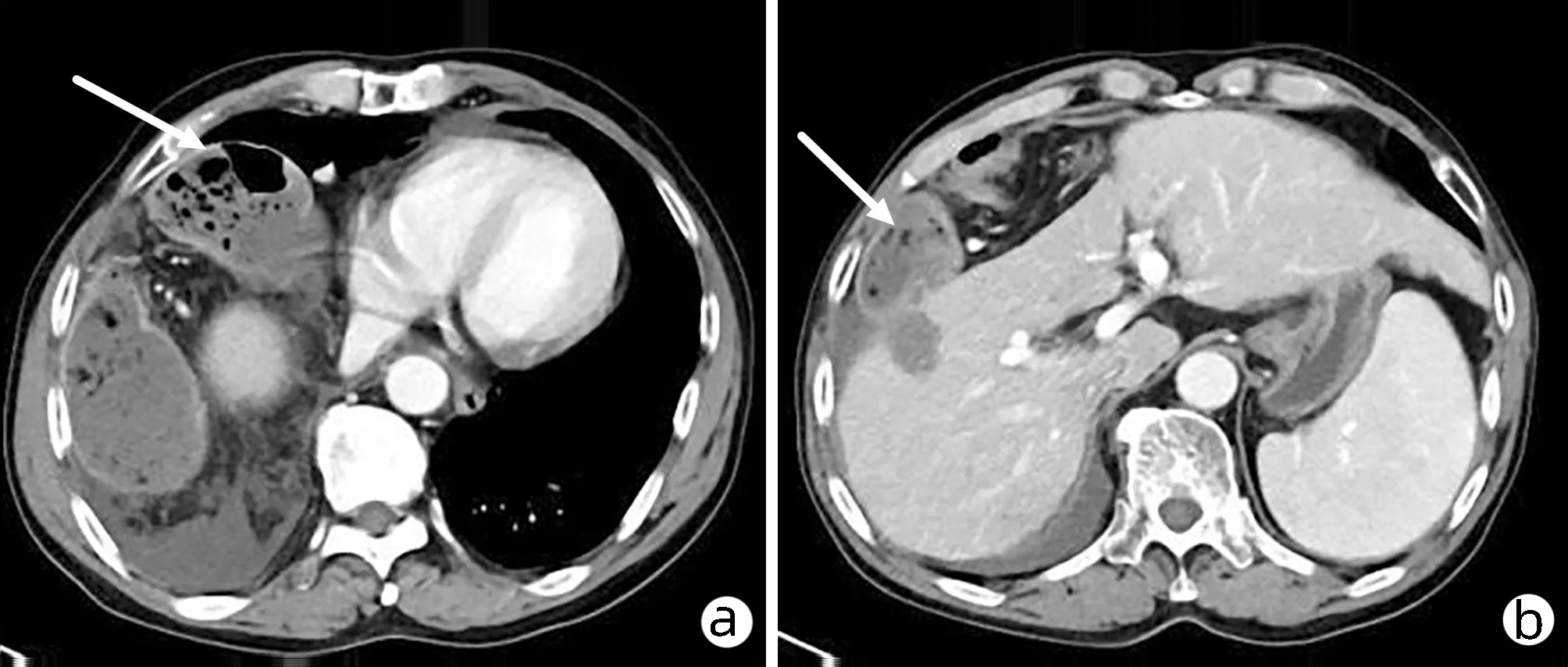
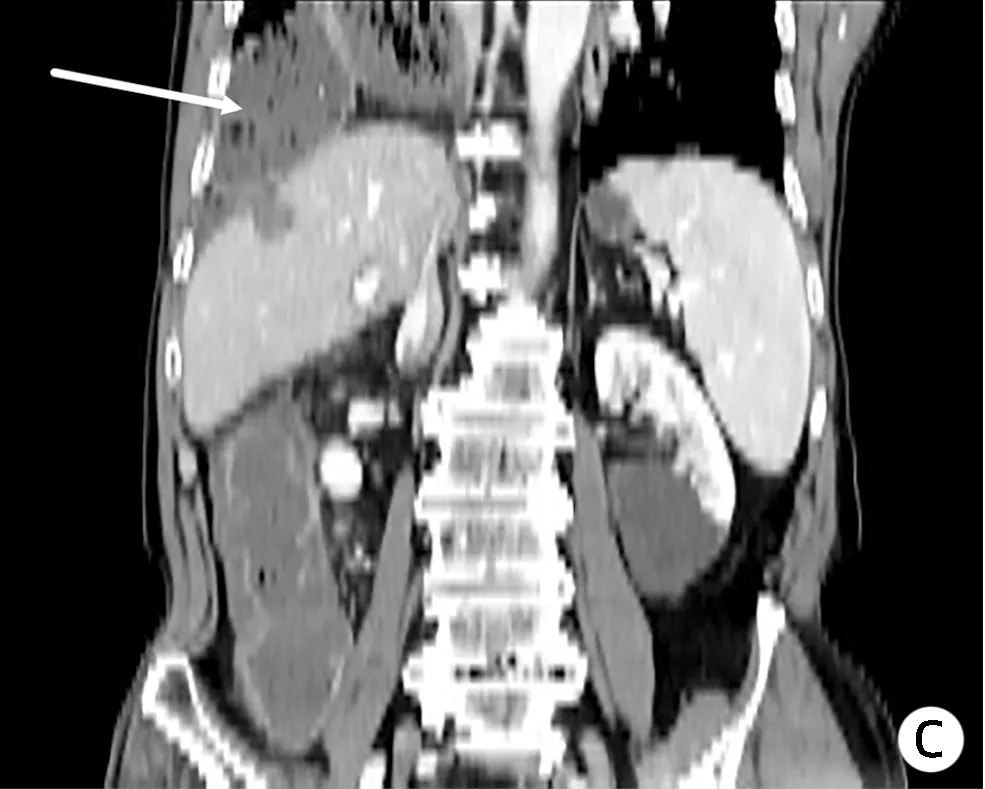
注:a,疝入胸腔的横结肠(白色箭头);b,疝入的横结肠组织经过腹腔并压迫肝脏(白色箭头);c,横结肠疝入右侧胸腔(白色箭头)。
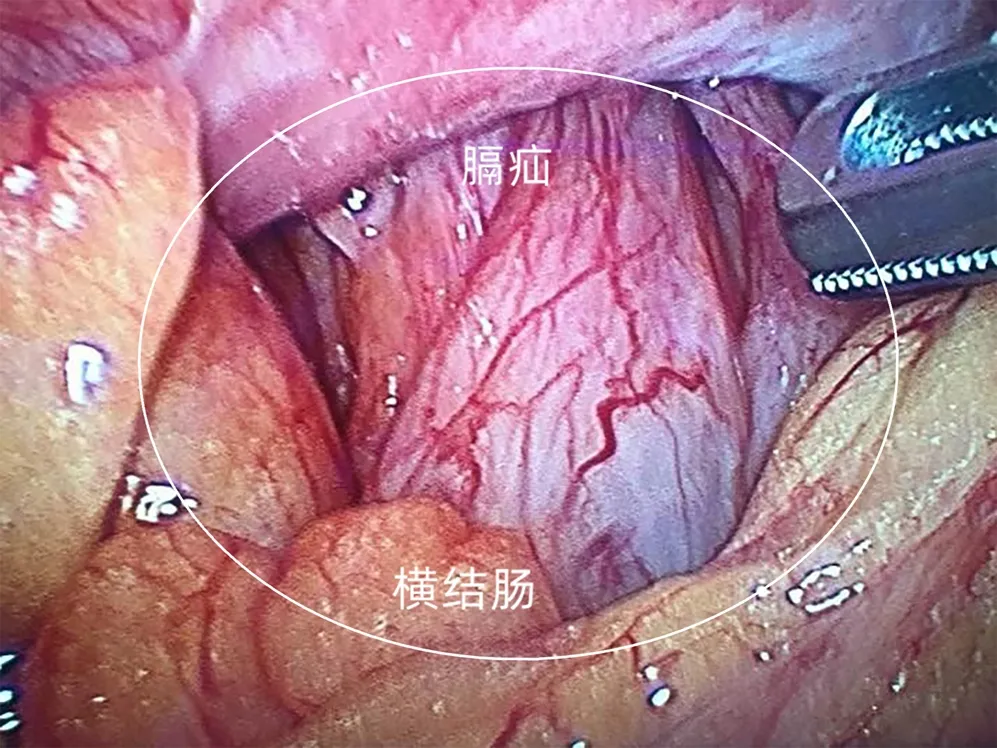
注:横结肠经膈疝直接侵入右胸腔(白色圆圈)。图5 腹腔镜术中所见Figure 5 Laparoscopic surgery image
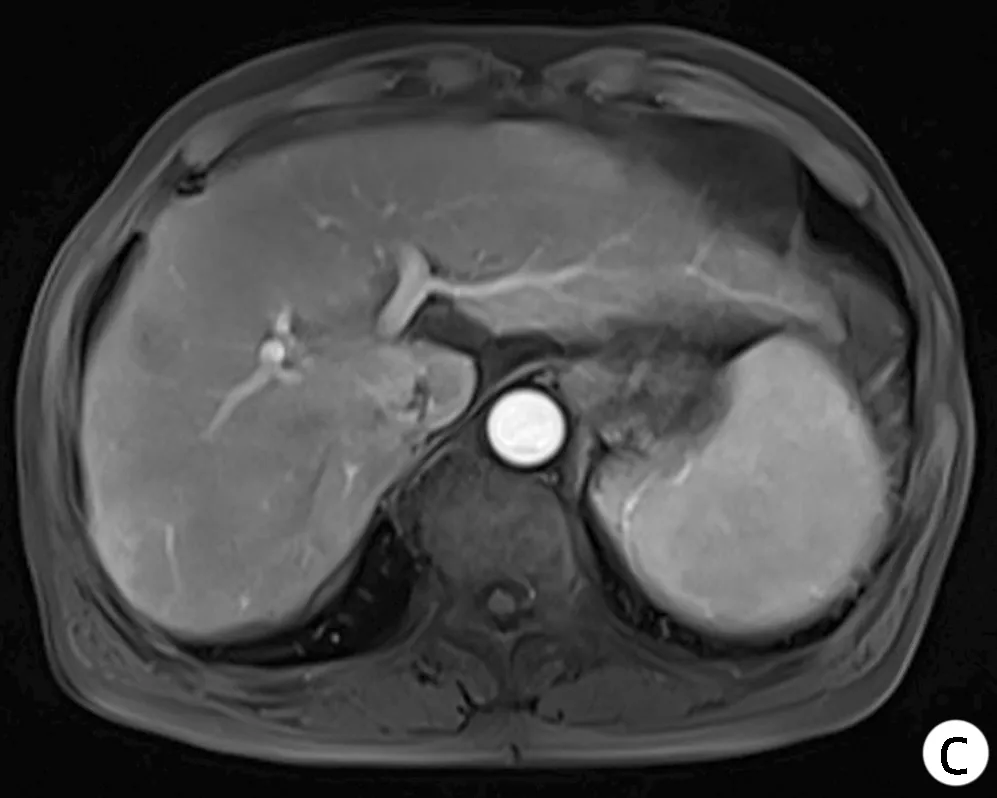
注:a,2019年11月复查CT;b,2020年5月复查MRI; c,2021年8月复查MRI。
2 讨论
肝癌是一种临床常见的恶性肿瘤,其中80%以上为HCC,是世界诸多地区癌症相关死亡的主要原因[1]。目前治疗方案主要以外科治疗为主,结合局部消融、经导管动脉化疗栓塞、放射治疗及全身治疗等多种手段综合治疗[2-3]。近年来,以射频消融(RFA)、MWA为代表的局部消融方案在肝癌治疗中得到广泛应用,被认为是小肝癌、不适合手术切除或化疗失败患者的替代疗法[4]。
MWA是一种通过微波对生物组织的加热效应引起肿瘤组织发生变形和凝固性坏死的技术,其安全性和有效性与RFA相比无显著差异[5],且相对于RFA具有速度更快、消融范围更广、同时消融多个病灶以及术中患者痛感更轻等优势[6]。目前报道的MWA主要并发症包括出血、气胸、肠穿孔和胆道损伤等[4],MWA术后膈疝是较为罕见的并发症,其发病率为0~0.31%[7],目前仅见英国1例报道[8]。
HCC患者MWA术后膈疝的发生机理目前尚不清楚。既往文献[9-11]报道的RFA术后膈疝病例的病变大多位于肝右叶第7、8或5段,本病患者病灶位置位于S5与S8交界处,临近膈肌,提示病灶临近膈肌是HCC患者MWA术后膈疝发生的重要条件。笔者团队前期研究[12]发现,消融术后膈肌穿孔可能与消融治疗期间间接热损伤、晚期肝硬化等因素有关。分析本例患者MWA术后膈疝的发生原因:(1)由于反复行消融治疗,局部热损伤易引起膈肌炎症反应并逐渐发展为纤维化,最终削弱膈肌纤维,导致膈肌迟发性穿孔[10]。本例患者前后行2次MWA治疗,不排除术中由于间接热损伤造成膈肌损伤的可能。(2)肝硬化晚期,肝脏进行性缩小,膈肌和肝脏之间的空间相对增大,膈肌穿孔的概率亦升高。本例患者处于肝硬化失代偿期,肝体积未见明显缩小,追溯病史,该患者在发现膈疝之前有肾结石病史,伴下腹部剧烈疼痛,不排除横结肠疝入胸腔和剧烈腹痛时腹内压增高有关,从而诱发膈疝的产生。
膈肌损伤或膈肌穿孔无脏器疝入时缺乏特异性临床表现和影像学特征,初期通常难以发现,故其延误诊断率较高。当发展为膈疝时,可表现为腹痛、胸闷气促、呼吸困难、恶心呕吐等,同时影像学检查提示一侧膈肌抬高,膈面模糊,膈肌欠连续,胸内有大小不等的圆形透光区或液平,胸腔内可见胃泡或肠襻影,患侧膈面上方出现气泡或致密影,心脏和纵膈向健侧移位等[13]。总结既往报道[12]可见,肝癌消融术后并发膈疝多为迟发型,时间间隔跨度大,更增加预测和诊断术后膈疝发生的难度。本例患者发现膈疝时分别与其2次MWA手术间隔11个月和3个月,但考虑膈肌穿孔的部位,笔者认为与第1次手术相关性更大。患者CT检查表现为右侧膈肌欠连续,结肠肝曲突入右侧胸腔内,与既往报道[12]膈疝的影像学表现一致,故认为其为MWA术后迟发性膈疝。
对于消融治疗后继发膈疝患者的治疗,由于其多伴有不同程度肠梗阻、肠坏死或严重呼吸困难,常因呼吸困难、急性上腹痛等症状于急诊求医,起病急,病情重,严重者可危及生命,建议能够耐受手术者均应及时行外科修复手术治疗,其安全性和有效性均得到证实,且对提高患者生存率至关重要[14]。对于无症状者,可长期临床随访观察,一旦出现症状,尽快手术干预。本例患者症状明显,诊断明确,及时进行腹腔镜下手术治疗,术后恢复良好。
综上所述,HCC患者MWA术后继发膈疝是一种罕见并发症。随着消融技术在临床不断开展,膈疝的发生率可能将越来越高,但由于其缺乏特异性临床表现,如果临床医师对此认识、警惕不足,极易导致失治误治。因此,在对邻近膈肌的肝肿瘤行消融治疗时,应注意避免损伤穿刺路径局部膈肌导致膈肌穿孔。同时,应设计出避免膈肌热损伤的方法,例如控制消融范围、采用人工腹水或经腹腔镜消融等方式[15]。术后随访监测应关注患者有无腹痛、呼吸困难、肠梗阻、胸痛和胸腔积液等症状,同时注意观察膈肌的完整性,以早期识别、及时干预,减少死亡风险。
伦理学声明:本例报告已获得患者知情同意。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:王晓栋、张玉蓉负责课题设计,资料分析,撰写论文;朱晓宁、郑丁参与收集数据,修改论文;汪静负责拟定写作思路,指导撰写文章并最后定稿。
