基于LASSO回归的慢性乙型肝炎肝纤维化无创诊断模型的构建及验证
2022-09-08朱韦文
壮 健, 朱韦文, 张 超
南京医科大学附属常州第二人民医院 超声科, 江苏 常州 213000
肝硬化被认为是肝炎进展至肝癌的中间阶段,而肝纤维化是肝硬化的早期病变,因此,准确诊断肝纤维化对预防肝硬化进展、降低肝癌发病率和死亡率具有重要的临床意义[1-2]。肝脏活组织检查是肝纤维化诊断的“金标准”,但缺点也很明显,创伤大、并发症风险高、采样变异性和成本贵,不适合定期监测[3]。开发新的无创、准确的肝纤维化诊断方法至关重要。前期研究[4]探索了多种血清生物标志物和影像学测量肝脏硬度(liver stiffness measurement,LSM)对肝纤维化诊断的价值。同时,基于临床信息和生化标志物的血清学模型也被开发应用于肝纤维化诊断,如AST-PLT比率指数(APRI)、FIB-4指数等[5-6]。近期研究[7-8]还发现,二维剪切波弹性成像也可用于无创评估慢性肝病患者的肝纤维化。基于此,本研究进一步建立基于LASSO回归的慢性乙型肝炎(CHB)相关肝纤维化的无创诊断模型,并进行验证。
1 对象与方法
1.1 研究对象 纳入2019年9月—2021年9月于本院诊断的CHB患者为研究对象,纳入标准:(1)年龄>18岁;(2)血清学检测HBsAg阳性,持续6个月以上;(3)成功获得肝穿刺活检和病理结果;(4)临床资料完整。排除标准:(1)已经确诊肝硬化和肝癌、合并严重肝功能障碍、自身免疫性肝炎、肝移植;(2)重症感染、严重心肺肾功能障碍、血液系统疾病、胃肠肿瘤;(3)近期大手术、创伤史、长期服用影响肝功能的药物;(4)妊娠、哺乳期女性。
1.2 研究方法 根据Metavir分期方法[9]将肝纤维化分为5个阶段:F0,无纤维化;F1,汇管区有纤维化但无分隔,为轻度纤维化;F2,汇管区有纤维化伴少量分隔,为中度纤维化;F3,有大量分隔但无肝硬化,为重度纤维化;F4,肝硬化。本研究将F0~1归为无显著纤维化组,F2~4为显著纤维化组。
使用SiemensAcusonS2000型彩色超声诊断仪测量LSM,配套凸面传感器SC6-1。患者取仰卧位,充分暴露肝脏右叶区域,设置弹性取样框(约4 cm×3 cm)置于探头下方1~2 cm处,但不超过肝包膜下5 cm,尽量避开大血管和胆囊。嘱患者屏息3~5 s,快速发动一次高强度低频的脉冲波并接收肝实质随即产生的横向剪切波速度,同一位置获得5次重复、有效测量值,计算平均值作为最终结果。血生化指标包括ALT、AST、ALP、GGT、Alb、Glo、TBil、DBil、PLT、总胆固醇、低密度脂蛋白、Ⅲ型前胶原、Ⅳ型胶原和透明质酸,采用日立3700型全自动生化分析仪及配套试剂完成。
无创血清学评分系统计算方式: APRI=AST(U/L)/正常值上限(40 U/L)×100/PLT(×109/L),Forns指数=7.811-3.131×ln[PLT(×109/L)]+0.781×ln[GGT(U/L)]+3.467×ln(年龄)-0.014×ln[胆固醇(mmol/L)],King评分=年龄×AST(U/L)×国际标准化比值(INR)/PLT(×109/L),FIB-4=年龄×AST(U/L)/[ALT(U/L)1/2×PLT(×109/L)]。

2 结果
2.1 一般资料 共纳入CHB患者240例,肝穿刺活检和病理结果显示,F0~1期65例,F2期70例,F3期65例,F4期40例,分为显著纤维化组175例和无显著纤维化组65例。F3、F4期与F2、F0~1期患者年龄、血清ALT、AST、ALP、GGT、TBil、PLT、Ⅲ型前胶原、Ⅳ型胶原、透明质酸和LSM比较,差异均有统计学意义(P值均<0.05)(表1)。
2.2 CHB肝纤维化的LASSO回归分析 根据单因素分析差异有统计学意义的指标,基于LASSO回归共筛选出5个最可能的非零系数特征变量,即透明质酸、Ⅳ型胶原、Ⅲ型前胶原、LSM和PLT(图1)。
2.3 CHB肝纤维化的多因素logistic回归分析 多因素logistic回归分析显示,透明质酸(OR=1.432)、Ⅳ型胶原(OR=1.243)、Ⅲ型前胶原(OR=1.146)和LSM(OR=1.656)是CHB肝纤维化的独立危险因素,PLT(OR=0.567)是保护因素(P值均<0.05)(表2)。
2.4 CHB肝纤维化的列线图模型 根据回归分析筛选的主要危险因素及对应权重系数,采用R软件建立列线图模型(图2)。
2.5 肝纤维化不同分期患者列线图模型评分、LSM、APRI、King评分、Forns指数和FIB-4指数的比较 F3和F4期患者列线图模型评分、LSM、APRI、King评分、Forns指数和FIB-4指数显著高于F2和F0~1期患者,差异均有统计学意义(P值均<0.05)(表3)。
2.6 列线图模型的ROC曲线 列线图模型预测CHB患者肝纤维化的AUC为0.876,显著高于LSM、APRI、King评分、Forns指数和FIB-4的AUC值,差异均有统计学意义(P值均<0.05)(表4,图3)。
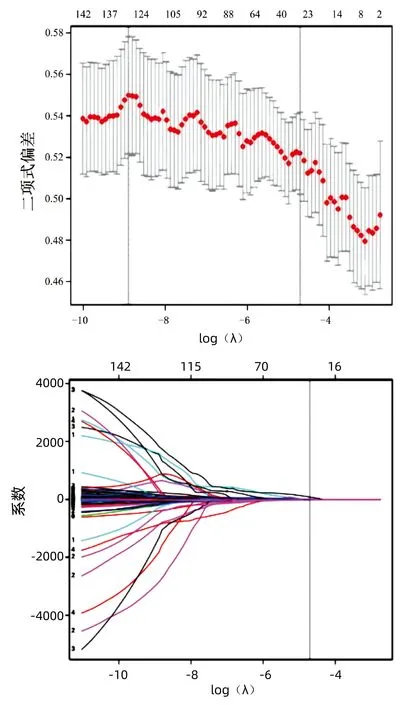
图1 CHB肝纤维化的LASSO回归分析
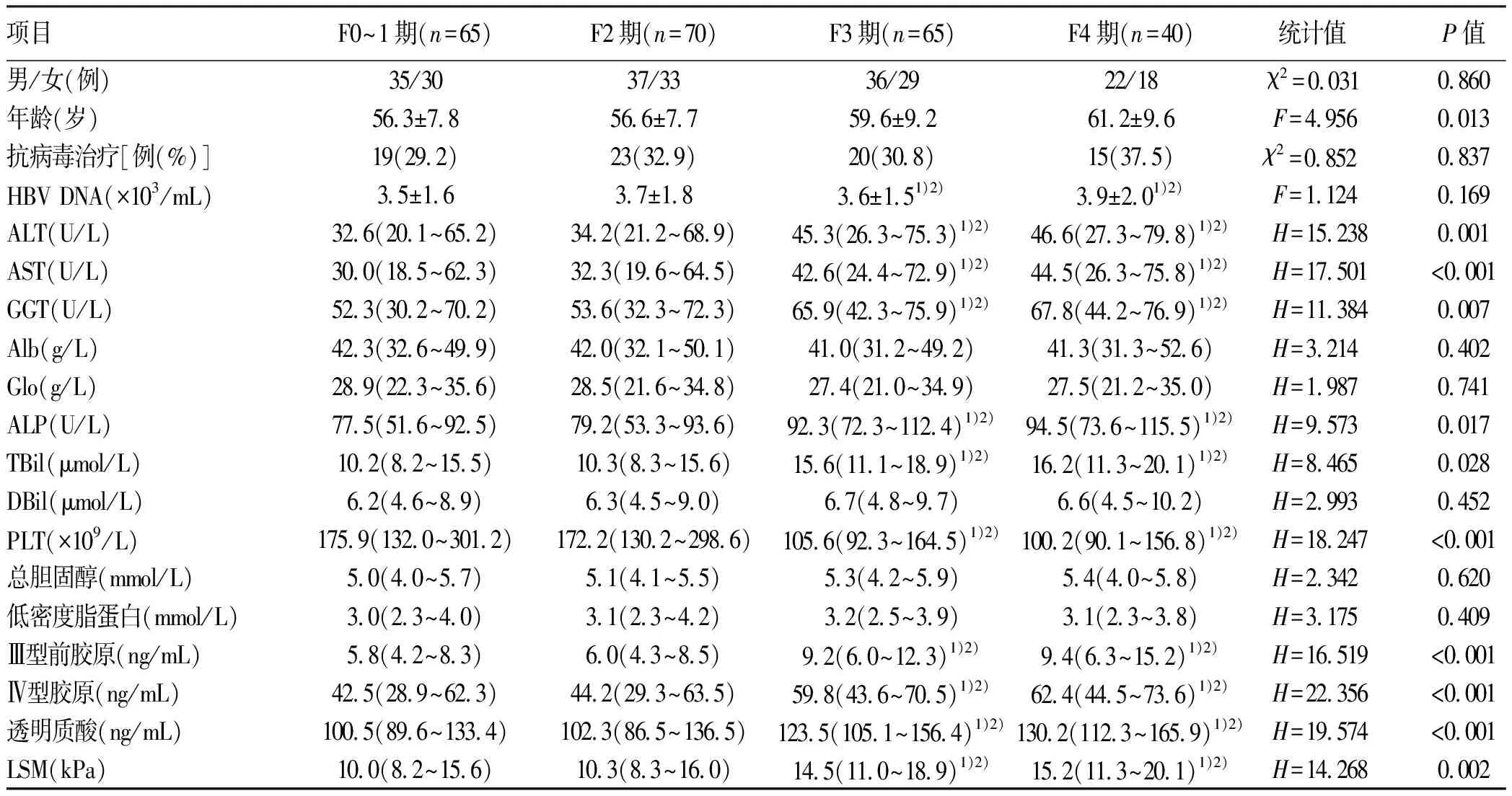
表1 CHB肝纤维化不同分期患者的一般资料比较Table 1 Comparison of baseline data in patients with chronic hepatitis B-related liver fibrosis at different stages
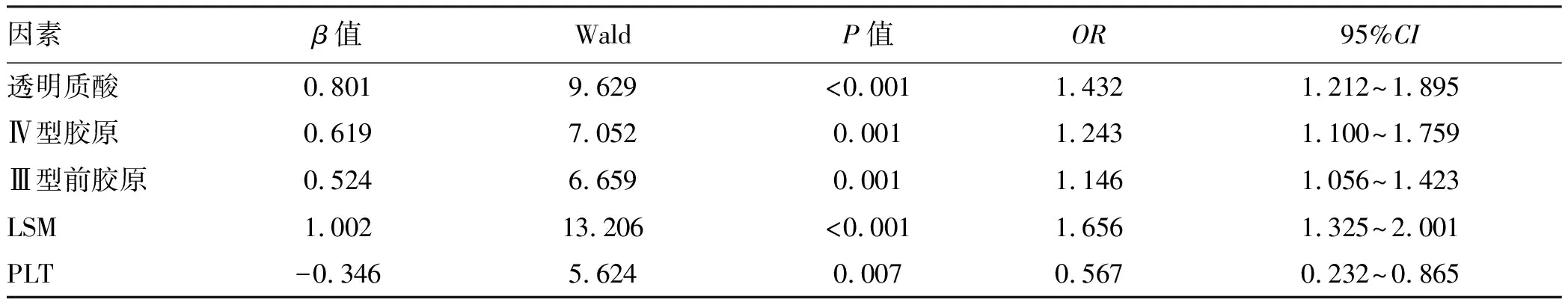
表2 CHB肝纤维化的多因素logistic回归分析Table 2 Multivariate logistic regression analysis of HBV liver fibrosis

图2 CHB肝纤维化的列线图模型Figure 2 Nomogram model of HBV liver fibrosis
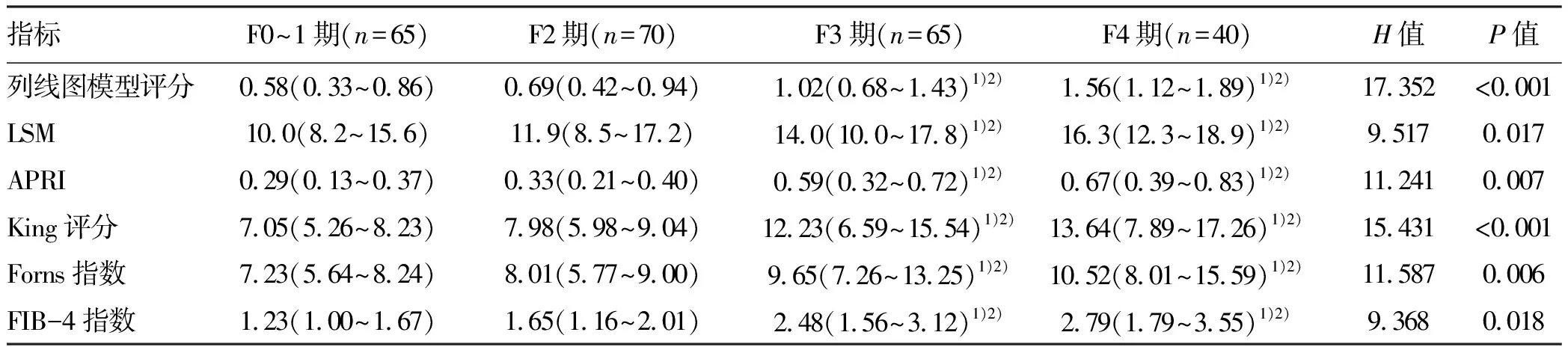
表3 肝纤维化不同分期患者评分系统的比较Table 3 Comparisons of different grading systems in patients with different stages of liver fibrosis
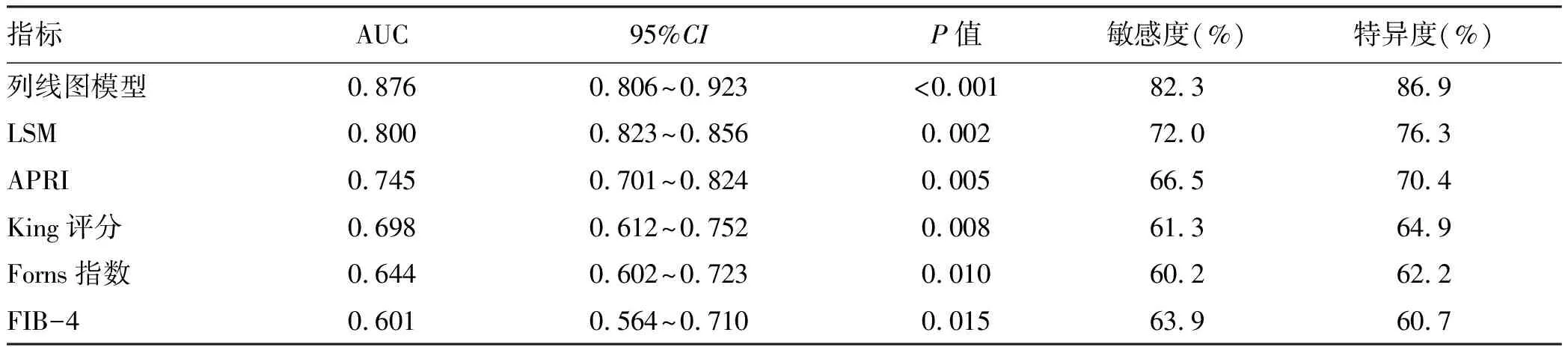
表4 列线图模型与各评分系统预测CHB肝纤维化的ROC曲线分析Table 4 ROC curve of predicting liver fibrosis in HBV patients by nomogram model and different grading systems
2.7 列线图模型的Calibration 曲线和Decision曲线 Calibration 曲线显示列线图模型的一致性尚可(图4)。Decision曲线显示列线图模型的获益性尚可,高风险概率值在0.03~0.60(图5)。
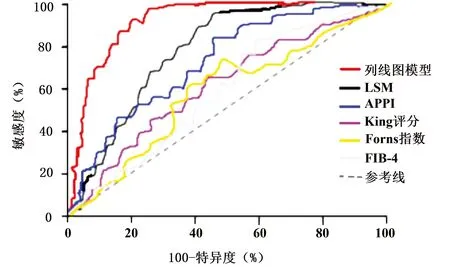
图3 列线图模型与各评分系统预测CHB肝纤维化的ROC曲线Figure 3 ROC curve of predicting liver fibrosis in HBV patients by nomogram model and different grading systems
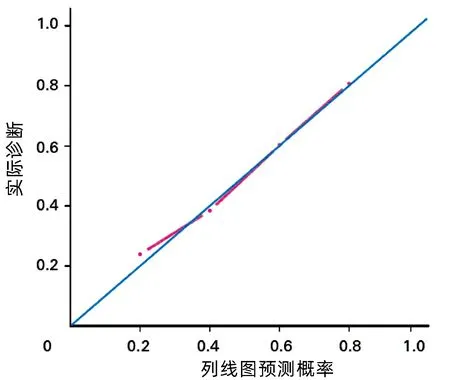
图4 列线图模型的Calibration 曲线Figure 4 Calibration curve of nomograph model
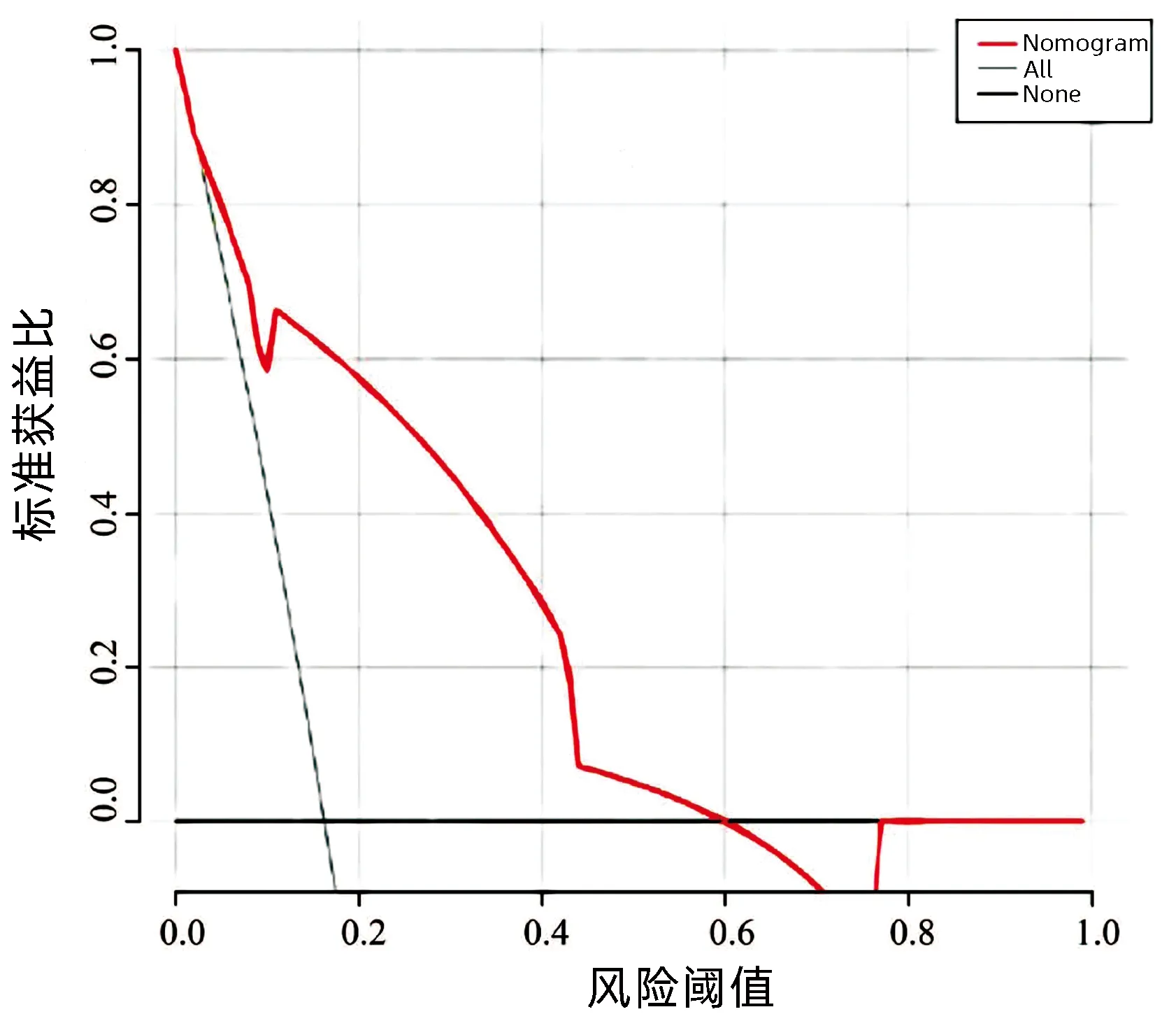
图5 列线图模型的Decision曲线Figure 5 Decision curve of nomogram model
3 讨论
肝硬化的特征是肝纤维化持续进展破坏肝组织结构和功能,肝硬化早期通常是无症状的,直到出现肝脏疾病并发症时才被诊断。肝硬化存在严重的并发症风险,包括腹水、腹膜炎、食管静脉曲张、肝衰竭和恶性肝肿瘤。血清标志物能够提供纤维化进展的动态信息,但是没有任何一种单一标志物能够准确评估肝纤维化,APRI和FIB-4指数等模型的预测精度还需要进一步提高[10-11]。
肝纤维化被认为是肝硬化的前期阶段,准确诊断纤维化对积极预防肝硬化进程至关重要[12-13]。本研究显示,CHB患者显著肝纤维化的发生率高达72.9%(175/240)。肝纤维化发生和进展导致肝损伤[14-15],血清学指标是反映肝功能的重要依据,ALT、AST、ALP、GGT和TBil均是直接反映肝脏功能的客观指标。肝纤维化和肝硬化导致凝血功能障碍,表现为PLT数量减少和凝血酶原激活[16-18]。Ⅲ型前胶原、Ⅳ型胶原和透明质酸被认为是肝纤维化的敏感性标志物,与肝纤维化的发生和进展密切相关[19-21]。与血清学生物标志物相比,二维剪切波弹性成像在检测肝纤维化方面具有更好的性能。LSM可直接反映肝组织的硬度,硬度越大提示肝脏弹性越差,纤维化程度越重,与纤维化程度具有较好的一致性[22]。但易受到肥胖、占位性组织、腹水以及检查者经验等因素的影响。
本研究建立了一个操作简单、可视化强的列线图预测模型。该模型中透明质酸160 ng/mL对应分值为60分,Ⅳ型胶原72 ng/mL对应分值为68分,Ⅲ型前胶原18 ng/mL对应分值为70分,LSM 24 kPa对应分值为90分,PLT 100×109/L对应分值为52分,各项相加得到总分为340分,对应风险大于0.996,提示显著性肝纤维化发生的概率极高。经ROC、Calibration 和Decision曲线证实列线图模型有较高的预测效能、较好的一致性和获益性。推测本研究开发的列线图模型预测显著性肝纤维化的临床应用潜力较大。
综上所述,利用血清学指标透明质酸、Ⅳ型胶原、Ⅲ型前胶原、PLT和LSM,基于LASSO回归建立无创列线图模型作为临床诊断CHB肝纤维化的量化工具,具有较高的诊断效能、一致性和获益性,值得推广应用。当然,本研究也有一定局限性:单中心数据分析,样本量有限,需要通过多中心、更大样本量数据对本研究结果进行外部验证。
伦理学声明:本研究于2019年8月17日经由南京医科大学附属常州第二人民医院伦理委员会审批通过,批号:2019-C013,并取得患者知情同意。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:壮健负责课题设计,资料分析,撰写论文;张超参与收集数据,修改论文;朱韦文负责拟定写作思路,指导撰写文章并最后定稿。
