两种表达系统来源新冠病毒RBD蛋白免疫小鼠后的IgG抗体水平对比研究
2022-09-08胡立强陶怡然
胡立强, 苏 涛, 张 勇, 杨 浩, 陶怡然, 陶 泽*
(1)四川大学华西医院卫健委移植工程与移植免疫重点实验室, 成都 610041;2)四川大学华西医院华西-加州预测干预医学研究中心, 成都 610041)
当前,新冠病毒由于其不同突变株的持续出现,导致疫情强势反弹,截止2022年3月,全球感染新冠病毒的人数已达4.42亿例,累计死亡人数已达598万例。在抗击新冠肺炎疫情的斗争中,新冠病毒疫苗的研发在预防新型冠状病毒感染、降低发病率和重症率方面意义重大[1]。得益于新冠病毒的分离、全基因组序列、蛋白质结构和致病机制的快速解析,新冠病毒疫苗的研发紧随其后迅速开展并不断取得进展[2, 3]。当前,科研人员主要采用病毒灭活疫苗、重组蛋白疫苗、病毒载体疫苗和核酸疫苗等研发相关疫苗。截至2022年3月,中国已经附条件上市的新冠疫苗已有5个(见Table 1)[4]。新冠病毒显示出较好的免疫原性,尤其是其结合人靶细胞上的的血管紧张素转化酶2(angiotension converting enzyme 2,ACE2)受体的刺突蛋白(spike protein)及其受体结合结构域(receptor binding domain, RBD),是免疫接种后的评估特异性抗体滴度的关键靶标,也是制备生产各种检查及治疗性中和抗体的重要抗原[5-7]。由于突变株的周期性出现,快速评价刺突蛋白尤其是RBD的免疫原性并制备相关抗体,对于病毒的检测、科学研究及疫苗和药物开发都极为重要[8]。

Table 1 List of COVID-19 Vaccines Approved by The China Food and Drug Administration (CFDA)
得益于基因工程技术的快速发展,从全基因合成和重组蛋白质的表达已较为成熟,能在较短时间内表达制备相关抗原用于动物免疫[9]。不同的表达系统由于蛋白质折叠的微环境和翻译后修饰的差异,对维持抗原天然结构、活性和免疫原性方面有重要影响。因此,根据蛋白质抗原的序列组成和翻译后修饰特点,选择合适的表达系统对于抗原的制备十分重要。目前,用于重组蛋白质生产的表达系统主要包括大肠杆菌、酵母、昆虫细胞和哺乳动物细胞表达系统。根据RBD的结构特点,其具有较多的半胱氨酸,能形成多对二硫键,且具有2个潜在的N糖基化修饰位点和多个O糖基化位点[6]。而昆虫细胞和哺乳动物细胞表达系统能够促进蛋白质二硫键的形成和正确折叠,且糖基化系统较RBD天然修饰结构更为接近,因此,较其他系统更适合用于RBD抗原的制备[10]。
本研究旨在比较昆虫细胞表达系统和哺乳细胞表达系统来源的重组RBD蛋白的特征,及其免疫小鼠后在小鼠体内产生IgG抗体水平的变化情况。通过检测2种表达系统来源的抗原和接种剂量对于诱导机体产生体液免疫反应的能力,为针对新冠病毒RBD蛋白开发重组亚单位疫苗提供参考依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c小鼠,雌性,8周龄,体重20 g左右。购自北京华阜康生物科技公司,饲养于华西医院啮齿类SPF 级动物实验中心,实验动物及实验操作符合动物伦理委员会的要求。
1.1.2 细胞株 HEK293-ACE2-OE稳定细胞株购自北京博奥龙免疫技术有限公司,细胞培养基为DMEM+10%胎牛血清,含嘌呤霉素浓度为5 μg/mL,于37℃,5%CO2的细胞培养箱中。
1.1.3 主要试剂及耗材 昆虫细胞High Five表达系统生产的RBD蛋白(bRBD)和人胚胎肾细胞293(HEK293)表达系统生产的RBD蛋白(hRBD),SARS-COV-2 Spike假病毒以及anti-Spike蛋白的抗体购自北京义翘神州公司,去糖基化试剂PNGase F酶购自Sigma-Aldrich公司,免疫佐剂 Quick Antibody-Mouse 3W购于北京博奥龙公司,小鼠抗His抗体购自成都正能生物公司,辣根过氧化物酶标记山羊抗小鼠IgG(H+L)购自北京中杉金桥生物公司,羊抗鼠IgG H&L (DyLight® 488)购自Abcam公司,TMB底物显色剂购自购自Sigma-Aldrich公司,酶标板购于康宁公司。
1.2 方法
1.2.1 SDS-PAGE凝胶电泳 SDS-PAGE配制分离胶浓度为12.75%,凝缩胶浓度为4%聚丙烯酰胺凝胶,将一定浓度的RBD蛋白样品通过Bio-Rad系统电泳完毕后,取出凝胶进行考马斯亮蓝染色,显示目的条带并判断分子量是否正确。
1.2.2 质谱 4 μg蛋白质样本通过 MAbPac RP 柱(2.1 mm i.d. × 50 mm)(Thermo Fisher Scientific,Waltham,MA,USA))在UltiMate 3000 色谱仪(Thermo Fisher Scientific,Waltham,MA,USA)上脱盐和分离。缓冲液 A (水配制 0.1% 甲酸)作为流动相A,缓冲液 B (乙腈配制0.1% 甲酸)作为流动相B,流速为400 μL/min。液相分离梯度是:15% B 在0 ~1.5 min,15% ~ 50% B 在1.5 ~ 4 min,50% B 在4 ~ 5.3 min,50% ~ 20% B在5.3 ~ 5.4 min,20% B在5.4 ~ 5.5 min。
经色谱分离,样本通过 Q Exactive Plus mass spectrometer质谱仪 (Thermo Fisher Scientific,Waltham,MA,USA) 检测。在17 500 分辨率下采MS,其他的关键仪器参数如下:喷雾电压:3.8 kV;鞘气流速:40 arb;S-lens为50%;自动增益目标值:3×106;最大离子注入时间:200 ms;谱图叠加次数:1。MS 质谱从总离子流图(TICs)提取并通过 BioPharma Finder 4.0软件 (Thermo Fisher Scientific,Waltham,MA,USA)解卷积。
1.2.3 RBD蛋白去糖基化 使用PNGase F蛋白酶去除蛋白质的N-糖链,取100 μg冻干的蛋白质,加入45 μL的超纯水和5 μL的10×蛋白质变性缓冲液,100℃加热10 min。再加入10 μL的10×G7缓冲液(0.5 mol/L磷酸盐,pH7.5),10 μL的超纯水以及10 μL的PNGase F。在37℃培养箱中反应过夜,在100℃加热2 min终止反应。
1.2.4 RBD蛋白糖基化位点鉴定 重组RBD蛋白(100 μg)经胰酶和胞内蛋白酶Glu-C组合酶切后成肽段,然后通过两性离子亲水色谱(Zic-HILIC)对肽段进行富集,提高糖肽丰度。利用阶梯能量HCD碎裂质谱(SCE-HCD-MS/MS)(Orbitrap Fusion Lumos mass spectrometer,Thermo Fisher Scientific,Waltham,MA,USA)对所获肽段进行检测分析,并借助质谱分析软件Byonic对检测的数据进行综合分析。每个样本3个技术重复。
1.2.5 小鼠分组与免疫 选择8周龄的雌性Balb/c小鼠,适应性饲养1周,随机分为8个实验组和1个对照组,每组3只,准备免疫。取昆虫细胞表达来源(bRBD)和人源细胞表达来源(hRBD)的蛋白质作为抗原,以10 μg和20 μg 2个剂量,与等体积免疫佐剂Quick Antibody-Mouse 3W充分混合,采用后腿肌肉注射方法。初次免疫14 d,用同样的剂量和方法进行第2次免疫。初次免疫后,第2、4、6、8、12、24周,各组3只小鼠断尾取血,血液样品静置后4℃,3 500 r/min离心20 min分离血清,并分装-80 ℃保存待检测使用。
1.2.6 酶联免疫吸附实验ELISA 血清样本以比例用含1%BSA的1×PBS缓冲液稀释,稀释好的样品按100 μL/孔加入已包被RBD蛋白酶标板,37℃孵育2 h,同时设置阴性对照组,其只加含1%BSA的1×PBS,阳性对照抗Spike蛋白抗体,PBST(1 L PBS+1.25 mL 40% Tween20)缓冲液洗板3次,加入HRP标记的山羊抗小鼠二抗(1∶5 000稀释),100 μL/孔,37℃孵育40 min;洗板3次;避光加入TMB显色液,显色5 min,加入终止液,50 μL/孔;酶标仪检测450 nm波长下的吸光度值(A450)。
1.2.7 流式细胞术 HEK293-ACE2-OE细胞用胰酶消化,并用培养基重悬细胞。调整细胞数目至4×105/管,分组,加入带his标签的重组RBD蛋白(2.5 μg/mL),室温作用1 h,800 g离心4 min,PBS洗2次,加入小鼠抗His抗体(1∶200稀释),室温孵育1 h,PBS洗2次后加入荧光二抗驴抗小鼠IgG H&L (Alexa Fluor® 488),37℃孵育0.5 h,PBS洗2次后重悬细胞,上流式细胞仪检测。以PBS组处理的细胞为对照。
1.2.8 中和试验 HEK293-ACE2-OE细胞按照1×104个/100 μL/孔接种到96孔板,培养过夜,SARS-COV-2 SPIKE假病毒按10 μL/孔与免疫后小鼠的血清样品(4W,10 μg组的血清样品,预先1∶10稀释)37℃孵育1 h,健康小鼠血清作为对照组。随后,加入96孔板中感染HEK293-ACE2-OE细胞,6 ~ 8 h后更换新鲜培养基继续培养。HEK293-ACE2-OE细胞含有荧光素酶基团,在感染假病毒 48 h后,可通过检测荧光素酶的活性判定感染效率。
1.3 统计学方法
实验数据用Graphpad Prism 8.3软件进行统计学分析处理,每组3个血清样品重复,采用单因素方差分析(one-way ANOVA)对不同稀释比例下的三组血清样品的中和作用进行比较,P< 0.05标记为:“*”,P< 0.001标记为:“***”。
2 结果
2.1 昆虫源和人源受体结合区蛋白的鉴定
新冠病毒Spike蛋白的S1亚基包含受体结合域,负责病毒对受体的识别与结合[10]。本文选择了RBD蛋白作为免疫原,测试其是否能够诱导机体产生特异性抗体。目前,RBD蛋白主要是由昆虫细胞或者人胚胎肾细胞293表达。为了比较2种不同表达体系生产得到的Spike蛋白激发免疫系统产生抗体的效果,首先对昆虫细胞表达来源(bRBD)和人源细胞表达来源(hRBD)的Spike蛋白理化性质进行分析鉴定。SDS-PAGE结果正如Fig.1A所示。2种不同表达体系生产的Spike蛋白分子量不同,hRBD分子量为35 kD左右,bRBD分子量为30 kD左右。在PNGase F蛋白酶去除了2种RBD蛋白的N-糖链后,其条带趋于一致。而进一步通过质谱分析,鉴定出bRBD和hRBD准确分子量分别为29 kD和32 kD(Fig. 1B)。这些结果提示,2种来源的Spike蛋白可能发生了一定程度的蛋白质翻译后修饰。有研究表明,Spike蛋白高度糖基化,在诱导机体产生特异性抗体及免疫应答等过程中发挥关键作用。对2种来源的RBD蛋白的糖基化情况进行鉴定。重组RBD蛋白经酶切成肽段后,经Zic-HILIC进行富集;随后,利用SCE-HCD-MS/MS对所获肽段进行比较分析。结果显示,bRBD和hRBD上鉴定出的N-糖基化位点不尽相同,但与ACE2受体结合的区域均含有2个糖基化位点(N331和N343)(Fig. 1C,D)。以上结果表明,2种表达系统下的RBD蛋白均能够发生糖基化修饰,与天然RBD更为接近,可能更适合作为RBD抗原用于机体免疫。
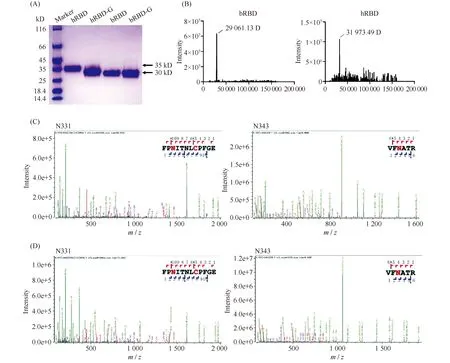
Fig.1 The physicochemical properties of bRBD and hRBD proteins (A) The molecular weight of hRBD, hRBD-G, bRBD and bRBD-G were detected by SDS-PAGE. (B) The accurate molecular weight of bRBD and hRBD were determined by mass spectrometry. (C) and (D) Glycosylation site analysis of bRBD and hRBD, respectively. The recombinant Spike protein (100 μg) was digested by trypsin and Glu-C, and then enriched by ZIC-HILIC, and were further detected and analyzed by SCE-HCD-MS/MS, subsequently the data were analyzed by Byonic software. Three replicates were assayed for each sample
2.2 昆虫源和人源受体结合区蛋白与血管紧张素转化酶2过表达细胞的结合
新冠病毒主要通过RBD蛋白与宿主肺泡上皮细胞上的ACE2受体高亲和力结合而侵入细胞[12]。通过流式细胞术可以比较昆虫细胞来源和HEK293细胞来源的RBD蛋白对ACE2受体的结合情况。已知HEK293-ACE2-OE细胞过表达ACE2受体,2.5 μg/mL的bRBD和hRBD蛋白质与该细胞结合1 h,因重组bRBD和hRBD蛋白质带有His标签,所以通过孵育anti-his抗体和对应的荧光二抗,可以检测bRBD和hRBD蛋白质与细胞ACE2受体的结合情况。流式结果(Fig.2)显示,bRBD和hRBD与HEK293-ACE2-OE细胞的结合率分别为88.5%和92.7%,提示这2种来源的RBD均可与细胞表面表达的ACE2受体结合,表明昆虫细胞来源和HEK293细胞来源的RBD蛋白具备感染ACE2过表达细胞的能力。
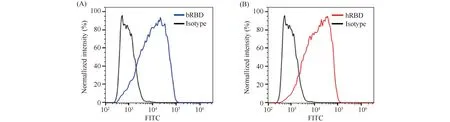
Fig.2 The binding of bRBD and hRBD to ACE2-overexpressing cells HEK293-ACE2-overexpressing cells were digested with trypsin, and prepared as cell suspensions. bRBD and hRBD (2.5 μg/mL) were incubated with 4×105 cells for 1 hour at room temperature. After incubated with the primary antibody against 6-his for 1 hour and the secondary antibody (goat anti-mouse IgG, DyLight 550) for 0.5 hour, the cell bindings were analyzed by flow cytometry. (A) The binding of bRBD to HEK293-ACE2-overexpressing cells. (B)The binding of hRBD to HEK293-ACE2-overexpressing cells
2.3 不同剂量昆虫源和人源受体结合区蛋白免疫产生IgG抗体水平的比较
为了评估昆虫源和人源RBD蛋白作为抗原刺激机体产生特异性抗体效果,bRBD和hRBD蛋白质分别作为抗原免疫小鼠,设置10 μg和20 μg 2个剂量,与等体积免疫佐剂Quick Antibody-Mouse 3W充分混合,后腿肌肉注射。初次免疫14 d,相同方法进行二次免疫。将初次免疫后采集的第2、4、6、8、12和24周小鼠的血清,使用ELISA法检测血清抗体滴度。结果正如Fig. 3所示,bRBD和hRBD蛋白质均引起小鼠免疫反应。在第1针重组蛋白免疫后2周,小鼠血清IgG抗体即全部转阳。第2针加强免疫后,小鼠血清IgG抗体水平升高, 且直到24周依然维持在较高浓度。同一表达系统的抗原,相同时间点下,10 μg和20 μg的2个抗原免疫剂量,产生的血清抗体滴度均无明显差异,未呈现剂量依赖型。上述结果提示,本文采用的免疫剂量10 μg可能已是较大的免疫剂量,足以引起强烈的免疫应答。而在相同时间点和剂量下,bRBD和hRBD蛋白质诱导产生的抗体滴度也无明显差异。结果表明,通过bRBD和hRBD蛋白质作为抗原免疫小鼠,均能产生高滴度抗Spike蛋白RBD特异性抗体。

Fig.3 Anti-RBD antibody titers of mice immunized with different doses of antigens Balb/c mice are immunized intramuscularly with 10 μg and 20 μg per mouse of RBD proteins, which were mixed with Quick Antibody adjuvant previously, and blood samples were collected from the tail at 2, 4, 6, 8, 12 and 24 weeks after the primary immunization. (A)-(F) The anti-RBD antibody titers in the serum were measured by ELISA
2.4 昆虫源和人源受体结合区蛋白免疫产生的抗体水平随时间变化趋势比较
通过ELISA检测不同时间点的血清抗体,观察到用本实验的免疫方式,bRBD和hRBD抗原均能使小鼠产生抗Spike蛋白的IgG抗体,且小鼠血清抗体在初次免疫后第2周就全部转阳,抗体浓度在随后2周内迅速上升,于第4周达到高峰,随后开始下降,从第12到24周抗体浓度下降趋于平缓,在第24周仍然可以检测到抗体,且抗体浓度高于第2周。以血清同在1∶64 000稀释比例,展示各组小鼠体内抗体水平随时间的变化,结果正如Fig.4所示。由结果可见,bRBD和hRBD均能够有效诱导机体产生特异性抗体,且二者诱导产生的血清抗体变化趋势相似,抗体效价随时间变化的趋势均在第4周就达到最高,之后开始下降。但从第4周起,bRBD抗原免疫的小鼠血清中的抗体浓度略高于hRBD抗原免疫的小鼠。这些结果表明,利用昆虫细胞来源和HEK293细胞来源的RBD蛋白均能够有效诱导机体产生特异性抗体,且能够持续较长时间。
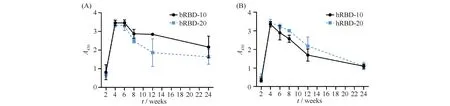
Fig.4 Changes of anti-RBD IgG titers in the serum of mice immunized with different antigens and different doses over time Balb/c mice are immunized intramuscularly with 10 and 20 μg per mouse of RBD proteins (A, bRBD and B, hRBD), which were mixed with Quick Antibody adjuvant previously. After the primary immunization, serum samples were collected from the tail vein every 2 weeks for 24 weeks, and then diluted at 1:64 000. The anti-RBD antibody titers in the serum were measured by ELISA
2.5 昆虫源和人源受体结合区蛋白免疫产生的抗体中和作用比较
为了探究昆虫源和人源的RBD蛋白诱导机体产生的特异性抗体是否具有保护作用,本文将免疫后的小鼠血清用于抗体中和试验。SARS-COV-2 Spike假病毒在感染ACE2过表达的HEK293细胞之前,与一定稀释比例的血清进行预孵育1 h,在感染细胞48 h时,通过荧光素酶活性检测来表征病毒的感染效率,从而评估免疫后小鼠血清的病毒中和效果。结果症如Fig.5所示,当稀释比例为1∶500时,Control、bRBD和hRBD组的荧光素酶的活性比率分别为92.4%,15.3%和24.8%;当1∶1000时,这一比率分别为105.1%,36.6%和26.6%;当1∶2000时,分别为93.6%,56.7%和47.3%;而当1∶4000时,分别为91.1%,87.8%和64.1%。其中,当稀释比例在1∶2000以下时,bRBD和hRBD组与Control组有显著统计学差异(P< 0.05),而bRBD和hRBD组之间无明显差异。这些结果初步表明,昆虫源和人源的RBD蛋白免疫小鼠后产生的特异性抗体,均具有保护ACE2阳性细胞免受SARS-COV-2 Spike假病毒感染的作用。
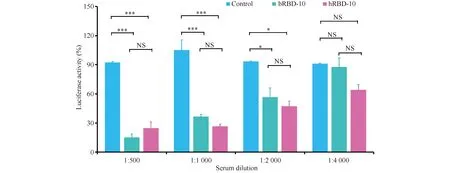
Fig.5 The protection of the sera from the immunized mice to HEK293-ACE2-overexpressing cells from SARS-CoV-2 infection The SARS-CoV-2 Spike pseudovirus was preincubated with serum from the immunized mice at a certain dilution ratio for 1 h, then incubated with HEK293-ACE2-overexpressing cells. After infection for 48 h at 37 ℃, The viral infectivity was detected by the luciferase assay system. The data were analyzed by one-way ANOVA test for multiple comparisons using Graphpad Prism 8.3 software. ***, P< 0.001; *, P< 0.05; NS, P> 0.05
3 讨论
新冠病毒自2019年底爆发以来,全世界范围内的疫情大流行已持续2年多[13]。由于病毒快速传播和周期性的突变,已发现在新冠病毒入侵人体过程中发挥关键作用的RBD蛋白上也产生了系列突变,最新出现的奥密克戎变异株在RBD蛋白上是突变数目高达15个,但仍然保留了与人类细胞ACE2受体的结合能力[14]。在当前疫情反复外加新突变株不断出现的背景下,疫苗和中和抗体等治疗药物,仍然是抗击疫情的重要策略[15]。因此,评估抗原的免疫原性、快速制备相关抗体用于病毒检测、科学研究及疫苗和药物的开发在今后的防疫工作中非常重要。
相较于灭活疫苗、减毒活疫苗和病毒载体疫苗,重组亚单位疫苗具有安全性高、不良反应小且整个生产过程无活病毒参与,便于规模化生产和运输的优点[16]。目前,中国已有1款批准上市的重组RBD蛋白疫苗及2款进入临床研究的重组RBD蛋白疫苗[17]。重组亚单位疫苗的开发中选择何种表达系统是一个难点,目前,仍未有统一的标准用于比较疫苗生产的不同表达系统。常用的重组蛋白质生产表达系统主要有细菌、酵母、哺乳动物细胞和昆虫细胞,它们各具优缺点[18]。例如,原核表达系统表达的蛋白质缺乏足够的翻译后修饰,可能减弱疫苗抗原蛋白的免疫原性;而酵母、昆虫及哺乳动物细胞表达系统在进行大量蛋白质生产的成本较高。在中国,已上市的重组RBD蛋白疫苗ZF2001使用的是哺乳动物细胞表达系统,进入1期临床试验的AdimrSC-2f(NCT04522089)使用的是杆状病毒-昆虫细胞表达系统,进入III期临床试验的由四川大学研制的重组疫苗(未命名,NCT04640402),使用的是昆虫细胞表达系统[6]。
大量证据表明,新冠病毒Spike蛋白作为糖蛋白,其糖基化情况可能与病毒的感染以及引起宿主的免疫应答相关[19-22]。前期研究发现,Spike蛋白具有22个N-糖基化修饰位点和17个O-糖基化修饰位点[23, 24]。哺乳动物细胞表达的RBD蛋白(hRBD)为复合型糖链,含157种N-糖苷,而昆虫细胞表达的RBD蛋白(bRBD)的糖链修饰为高甘露糖型,含38种N-糖苷[23, 25]。说明哺乳动物细胞和昆虫细胞生产的RBD蛋白存在糖基化修饰的差异,而这种差异是否会影响到该类重组RBD疫苗的免疫应答效果仍有待进一步研究。有意思的是,最近研究发现,RNA疫苗编码的抗原蛋白在宿主的糖基化机制中可能会被糖基化修饰,进而影响关键的抗原表位,导致机体无法产生有效的免疫反应[26]。
因此,本文对哺乳动物细胞和昆虫细胞表达系统来源的RBD蛋白免疫小鼠后的IgG抗体水平进行对比研究。首先,对2种RBD蛋白的理化性质及糖基化位点进行了验证,发现hRBD和bRBD的N-糖基化位点尽管不同,但是与ACE2受体结合区域的2个糖基化位点(N331和N343)一致,而N331和N343糖基化位点已经被报道与新冠病毒的感染密切相关[19, 27]。随后,将2种RBD蛋白免疫小鼠,持续6个月监测小鼠血清中RBD特异性抗体浓度,发现2种RBD蛋白均能够快速引起小鼠的免疫反应,且具有良好的免疫持久性,在初次免疫后半年内仍可以在血清中检测到特异性抗体。值得注意的是,从第4周起,bRBD抗原免疫的小鼠血清中的特异性抗体浓度略高于hRBD抗原免疫的小鼠,这或许与二者不同的糖基化程度有关,需要后续实验进一步证实。最后,本文利用中和试验初步探究了2种RBD蛋白免疫小鼠后产生的特异性抗体是否具有保护作用。结果显示,哺乳动物细胞和昆虫源RBD免疫产生的特异性抗体均能够有效抑制SARS-COV-2 Spike假病毒的感染,但2种RBD蛋白组未见明显差异。
综上所述,利用哺乳动物细胞和昆虫源RBD免疫小鼠能够产生较高水平的特异性IgG抗体以及较好的免疫保护作用,为后续针对RBD蛋白的重组亚单位疫苗的开发选择选择何种表达系统生产抗原提供参考依据。
猜你喜欢
杂志排行
中国生物化学与分子生物学报的其它文章
- DeepCKI:一个基于变分图自编码器预测细胞-细胞因子相互作用的生物信息学模型
- 半翻转生物化学教学模式对学生学业成绩和自我认知的影响
- 人多能干细胞来源的肾定向分化平台的构建
- 泛素样蛋白UBQLN2通过抑制结肠癌Wnt信号通路发挥抑癌作用
- Potent Anti-bacteria Activity of Tamsulosin Hydrochloride and Ningmitai Capsule in Combination by Regulating the Gene Expression Related to β-Lactamase, Hemolysis, and Virulence
- 利拉鲁肽抑制高糖诱导的小鼠胰岛细胞损伤
