利拉鲁肽抑制高糖诱导的小鼠胰岛细胞损伤
2022-09-08白明健王琪琦张春晶
朱 谋, 白明健, 王琪琦, 程 昊, 李 林, 徐 晶*, 张春晶*
(齐齐哈尔医学院 1)医学检验研究生,2)医学检验本科生,3)卫生所,4)生物化学教研室,黑龙江 齐齐哈尔 161006)
糖尿病(diabetes mellitus,DM)发病率的急剧上升已成为重大的公共卫生问题,其中2型糖尿病(type 2 diabetes mellitus,T2DM)的发病率最高。T2DM是一种以慢性血糖升高为特征的疾病,其主要特点在于功能性胰岛β细胞进行性衰退[1-2],使胰岛素的分泌量下降,导致糖尿病的发展以及糖尿病患者病情加重。因此,研究胰岛β细胞损伤的机制来减少和抑制胰岛细胞的衰退,是治疗糖尿病的关键途径。
利拉鲁肽(liraglutide,Lira)是一种长效胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)类似物。多项研究表明,利拉鲁肽可增加胰岛素分泌和降低胰高血糖素水平,在改善空腹和餐后血糖的异常变化、延缓胃排空、降低能量摄入、保护胰岛细胞功能等方面存在显著的优势[3-5]。但其具体机制尚未完全阐明。胰岛细胞的功能受多方面因素影响。例如,胰岛β细胞长期暴露于高糖高脂环境下,可影响其miRNA表达谱,导致其功能受损,存活受限,从而促进T2DM的发展[6]。本研究利用利拉鲁肽在保护胰岛细胞功能上的显著优势,探讨利拉鲁肽对高糖培养条件下小鼠胰岛MIN6细胞的细胞活力、胰岛素分泌以及细胞损伤相关指标的影响,为利拉鲁肽治疗T2DM提供理论依据。
1 材料与方法
1.1 细胞及主要试剂
小鼠胰岛MIN6细胞(中国医学科学院基础医学研究所基础医学细胞中心);RPMI 1640培养基(Hyclone);胎牛血清(Clark);0.25%胰酶(Gibco);利拉鲁肽(Cayman);葡萄糖(Sigma);CCK-8检测试剂盒(上海生工);小鼠胰岛素(insulin)酶联免疫检测试剂盒和ATP含量检测试剂盒(北京索来宝科技有限公司);活体细胞线粒体膜通道孔(mitochondrial permeability transition pore,MPTP)试剂盒(上海杰美基因科技有限公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和乳酸脱氢酶(lactate dehydrogenase,LDH)(南京建成生物工程研究所);解偶联蛋白2(uncoupling protein 2,UCP2)抗体(Santa);辣根酶标记山羊抗鼠IgG(北京中杉金桥生物技术有限公司);ECL(碧云天生物技术有限公司)。
1.2 细胞培养
MIN6细胞培养于含10%胎牛血清、1%青霉素-链霉素的1640(Hyclone)完全培养基中。培养条件为37 ℃,5% CO2。实验分组:正常细胞对照组(Normal control, NC),不含葡萄糖1640培养基培养;高糖组(high glucose, HG),葡萄糖终浓度为33 mmol/L培养;利拉鲁肽组(Lira),利拉鲁肽终浓度为100 nmol/L;高糖和利拉鲁肽组(HG+Lira)。本研究均在上述分组及对应环境中将细胞培养48 h后进行相关指标的检测。
1.3 CCK-8法检测MIN6细胞活力
将细胞按5×103个/孔接种于96孔板,37 ℃ 5% CO2的细胞培养箱中培养24 h,弃去上层废液,对照组(NC)加入完全培养基100 μL,利拉鲁肽组(Lira)加入100 μL利拉鲁肽终浓度为100 nmol/L的培养液,高糖组(HG)加入100 μL葡萄糖终浓度为33 mmol/L的培养液,高糖和利拉鲁肽组(HG+Lira)加入100 μL葡萄糖终浓度为33 mmol/L和利拉鲁肽终浓度100 nmol/L的培养液,空白对照组不含细胞,只加培养基。每组设置3个复孔,37 ℃ 5%CO2培养48 h,每孔加入10 μL的CCK-8检测试剂。2 h后在酶标仪450 nm处检测吸光度值,根据细胞活力计算公式计算存活率。
1.4 ELISA检测MIN6细胞的胰岛素分泌量
将细胞按照8×105个/孔,接种于60 mm×15 mm培养皿中,24 h后待细胞贴壁,按5 mL/孔计算HG剂量和加药量以及β-巯基乙醇(50 μmol/L),37 ℃ 5%CO2培养48 h,收集培养液上清,按照小鼠胰岛素测定试剂盒说明书检测450 nm处光密度值,依据标准曲线公式计算各实验组胰岛素分泌量。
1.5 细胞内ATP生成量的检测
将细胞按4.5×105个/孔接种于6孔板,待细胞贴壁,按3.5 mL/孔计算加药量,培养细胞48 h,正常消化收集细胞,每孔加入800 μL ATP提取液,严格按试剂说明书进行操作,在340 nm处读取吸光度值A1和A2,根据试剂说明书提供的计算公式对ATP含量进行分析处理。
1.6 应用激光共聚焦显微镜检测线粒体膜通道孔
将MIN6细胞接种于35 mm激光共聚焦专用玻底培养皿常规培养,按3.5 mL/孔计算加药量,培养48 h,弃上清,严格按照 线粒体膜通道孔试剂盒说明书进行操作,最后加入200 μL清理液,应用激光共聚焦显微镜获取图像和细胞荧光强度。
1.7 活性氧含量检测
将MIN6细胞按4.5×105个/孔接种于6孔板中,按实验分组和条件培养48 h后收集细胞沉淀,以检测Lira对高糖刺激48 h小鼠MIN6细胞中ROS含量的影响。将收集的细胞用1 mL PBS重悬,1 000 r/min离心3 min,弃掉PBS,1 mL DCFH-DA(10 μmol/L)工作液重悬细胞,37 ℃,5% CO2培养箱孵育3 min,PBS清洗2次,最后用500 μL PBS重悬,流式细胞仪进行检测分析。
1.8 酶法检测细胞内丙二醛含量,超氧化物歧化酶和过氧化氢酶以及细胞上清液中乳酸脱氢酶活性
按实验分组收集2×106个细胞和细胞培养液上清,PBS或者试剂盒自带提取液重悬细胞沉淀,超声破碎(冰浴,300 W,超声5 s,间隔30 s,重复4次)。严格按照说明书操作,酶标仪测定细胞光密度(A)值和考马斯亮蓝法测定蛋白质浓度,根据说明书换算公式计算出细胞内MDA含量、SOD、CAT和细胞培养液上清中LDH活性。
1.9 Western 印迹检测解偶联蛋白2的表达
提取各组细胞总蛋白质,考马斯亮蓝法检测蛋白质浓度,按照20 μg上样量,确定每孔上样体积,使用SDS-PAGE凝胶电泳,湿转法转入PVDF膜,脱脂奶粉封闭2 h,TBST洗膜,4 ℃孵育一抗过夜,次日TBST洗膜3次,10 min/次,加HRP标记的山羊抗鼠二抗,37 ℃孵育1 h,TBST洗膜3次,ECL化学发光法曝光,使用Image J或Image Lad软件分析图像。
1.10 统计学方法
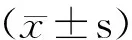
2 结果
2.1 利拉鲁肽抑制高糖刺激细胞活力的下降
为探究利拉鲁肽对MIN6细胞活力的影响,采用CCK-8法对细胞的活力进行检测,结果正如Fig.1所示。与正常对照组(98.80 ± 0.68)%相比,利拉鲁肽组(92.14 ± 7.85)%差异无变化(P>0.05),而HG组(82.70 ± 1.86)%细胞活力下降(P<0.05),利拉鲁肽(100 nmol/L)作用高糖组细胞活力(96.58 ± 2.82)%较HG组升高(P<0.05)。提示在长期的高糖环境会使胰岛细胞的活力降低,而利拉鲁肽可保护胰岛细胞不受高糖诱导的细胞损伤,减少凋亡率或逆转高糖环境下胰岛细胞的损伤情况。
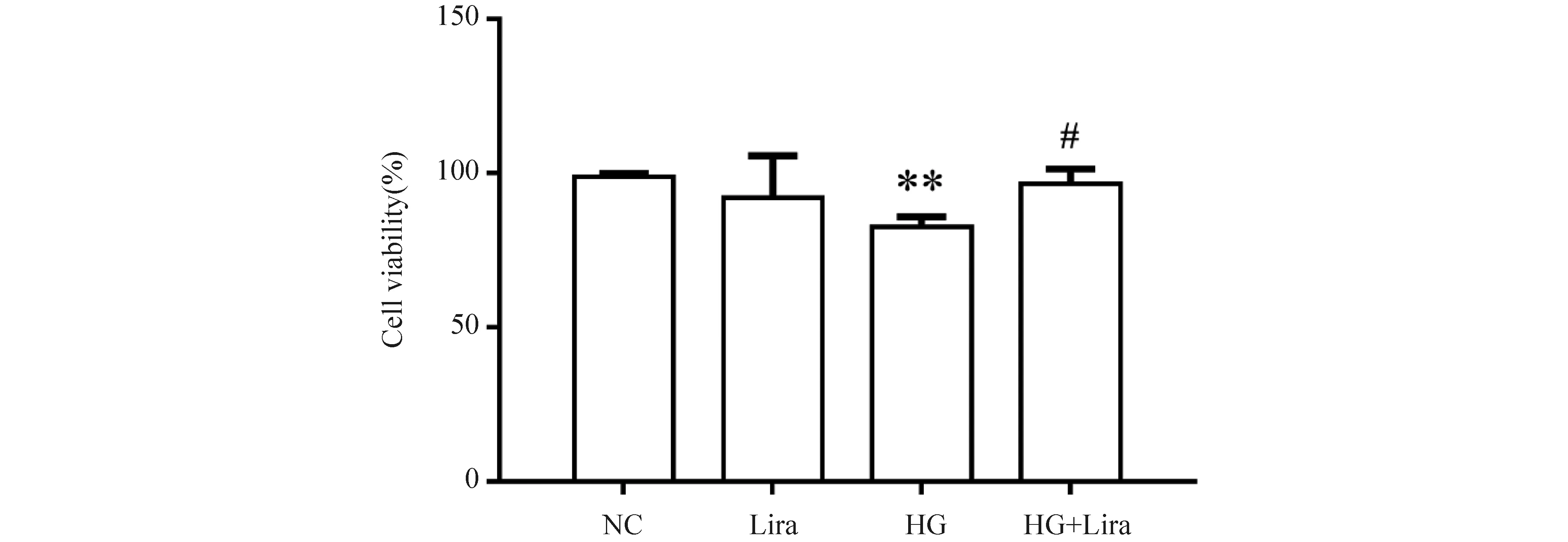
Fig.1 CCK-8 assays The control group (NC) was cultured under normal conditions. The liraglutide group was treated with 100 nmol/L liraglutide. The high glucose group (HG) was treated with 33 mmol/L glucose. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. Data are presented as the mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, **P<0.01 compared with the NC group; #P <0.05 compared with the HG group
2.2 利拉鲁肽促进高糖刺激下MIN6细胞的胰岛素分泌
为探究利拉鲁肽对MIN6细胞功能的影响,采用ELISA试剂盒检测细胞的胰岛素(insulin,IN)分泌情况。Fig.2结果显示,与正常对照组(0.35 ± 0.03)胰岛素释放量相比,利拉鲁肽组(0.34 ± 0.01)差异不具统计学意义(P>0.05),HG组(0.21 ± 0.01)细胞上清胰岛素分泌量降低(P<0.05),利拉鲁肽作用高糖组(0.26 ± 0.01)较HG组升高(P<0.05)。提示长期高糖刺激会导致胰岛细胞分泌和释放胰岛素的功能受损,而利拉鲁肽干预后可改善这一现象。
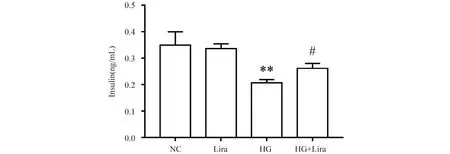
Fig.2 Insulin release assays The control group (NC) was cultured under normal conditions. The liraglutide group was treated with 100 nmol/L liraglutide. The high glucose group (HG) was treated with 33mmol/L glucose. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. Data are presented as the mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, **P <0.01 compared with the NC group; #P<0.05 compared with the HG group
2.3 利拉鲁肽调节MIN6细胞ATP含量
通过对MIN6细胞的ATP含量检测结果发现,与正常对照组(0.30 ± 0.01)比较,利拉鲁肽(0.29 ± 0.01)组细胞ATP含量无明显变化,差异不具统计学意义(P>0.05)。HG组(0.18 ± 0.02)ATP生成量降低(P<0.001),利拉鲁肽作用高糖组(0.26 ± 0.01)ATP含量较高糖组升高(P<0.001),结果见Fig.3。提示利拉鲁肽可促进高糖诱导MIN6细胞ATP的生成,维持细胞正常能量供应。
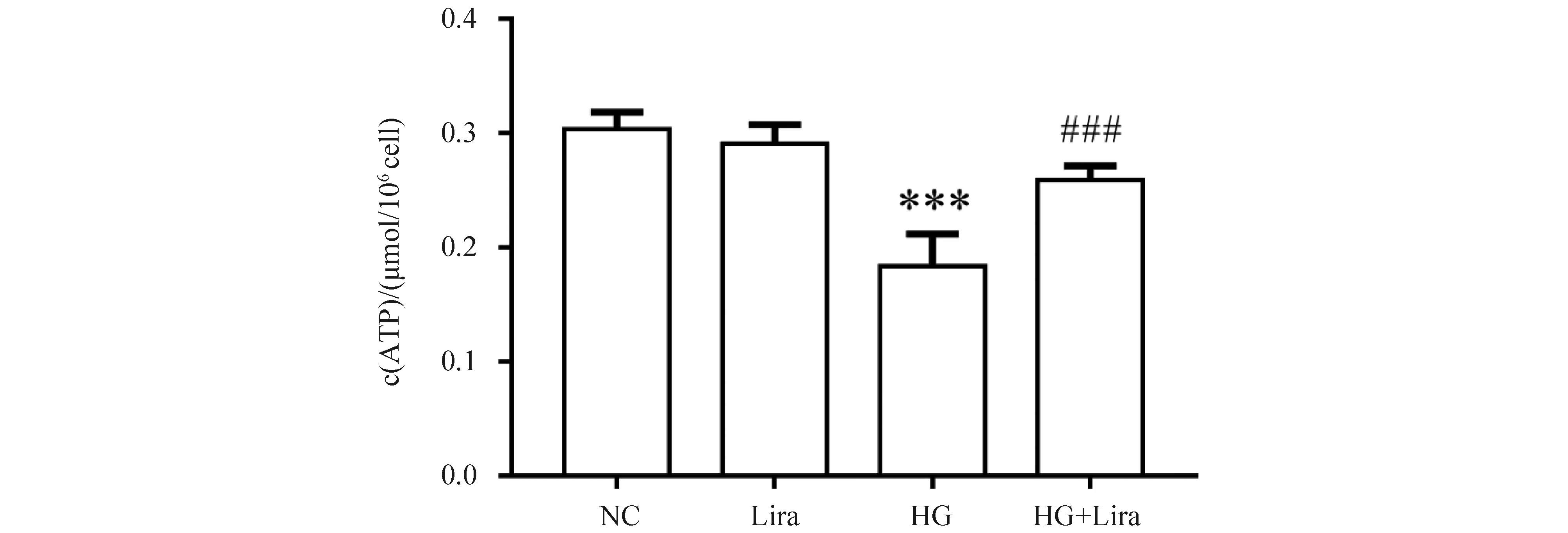
Fig.3 Effects of liraglutide on MIN6 ATP levels The control group (NC) was cultured under normal conditions. The liraglutide group was treated with 100 nmol/L liraglutide. The high glucose group (HG) was treated with 33 mmol/L glucose. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. Data are presented as the mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, ***P <0.001 compared with the NC group; ###P <0.001 compared with the HG group
2.4 利拉鲁肽调节线粒体膜通道孔开放
为探究利拉鲁肽对高糖环境下MIN6细胞线粒体膜通道孔的影响,采用激光共聚焦显微镜观察各组细胞的绿色荧光强度,进行统计分析。结果表明,与正常对照组(3.29 ± 0.08)比较,利拉鲁肽组(4.07 ± 0.35)荧光强度无变化,差异不具统计学意义(P>0.05),HG组绿色荧光强度(1.17 ± 0.23)减弱(P<0.001);与HG组比,利拉鲁肽作用高糖组荧光强度(5.36 ± 0.38)升高(P<0.001),结果见Fig.4。表明利拉鲁肽可抑制高糖诱导的MIN6细胞线粒体膜通道孔开放。
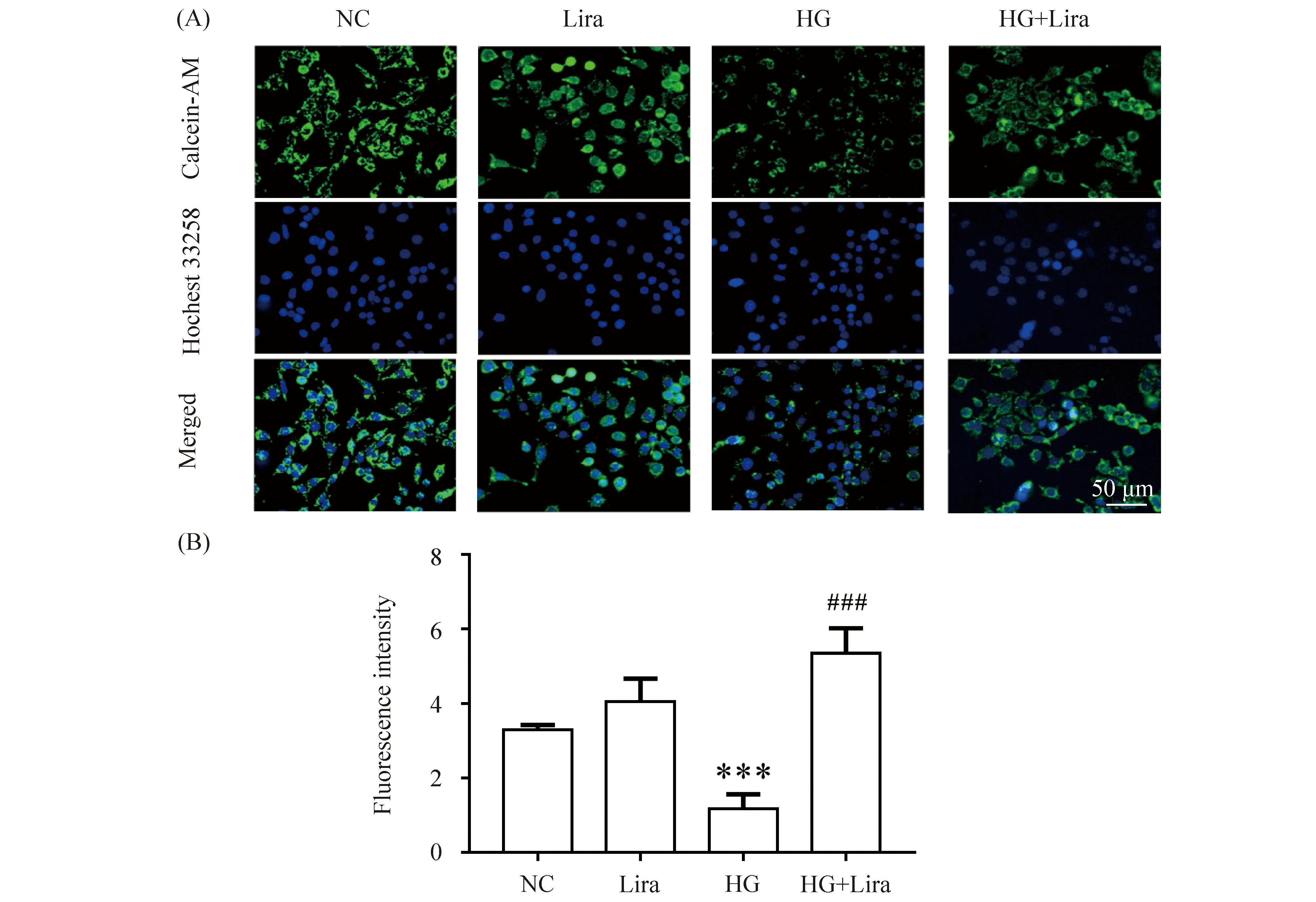
Fig.4 The fluorescence intensity of MIN6 mitochondrial permeability transition pore (A) The control group (NC) was cultured under normal conditions. Liraglutide group was treated with 100 nmol/L liraglutide. The high glucose group (HG) was treated with 33 mmol/L glucose. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. (B) Data are presented as the mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, ***P <0.001 compared with the NC group; ###P <0.001 compared with the HG group
2.5 利拉鲁肽调节高糖刺激下MIN6细胞活性氧水平
为探究高糖环境下利拉鲁肽对胰岛细胞ROS水平的调节作用,采用DCFH-DA探针联合流式细胞仪检测细胞ROS的含量。检测结果发现,与正常对照组(95.58 ± 2.61)相比,利拉鲁肽组(114.70 ± 7.32)含量无变化,差异不具统计学意义(P>0.05),高糖组(173.00 ± 3.85)ROS的含量升高(P<0.001),提示高糖可刺激胰岛细胞产生氧化应激损伤,而利拉鲁肽作用的高糖组(124.60 ± 4.36)ROS含量较高糖组降低(P<0.01),结果见Fig.5。提示利拉鲁肽可在一定程度上抑制高糖诱导的氧化应激损伤。
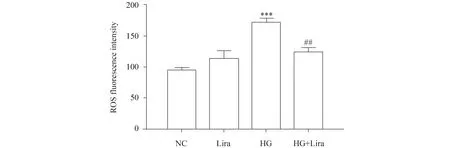
Fig.5 Effects of liraglutide on intracellular ROS levels The control group (NC) was cultured under normal conditions. The high glucose group (HG) was treated with 33 mmol/L glucose. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. Data are presented as the mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, ***P <0.001 compared with the NC group; ##P <0.01 compared with the HG group
2.6 利拉鲁肽调节高糖刺激下丙二醛含量,超氧化物歧化酶、过氧化氢酶和乳酸脱氢酶活性
与正常对照组比较,利拉鲁肽组细胞内MDA含量、SOD、CAT和LDH活性差异无统计学意义(P>0.05),高糖组MDA(2.29 ± 0.45)和LDH(290.90± 8.63)水平升高(P<0.05),SOD(3.81 ± 0.21)和CAT(32.52 ± 2.05)水平降低(P<0.01);与高糖组比较,利拉鲁肽作用高糖组MDA(0.89 ± 0.19)和LDH(215.40 ± 7.43)水平降低(P<0.01),SOD(7.98 ± 0.32)和CAT(64.20 ± 4.17)水平升高(P<0.01),结果见Table 1。
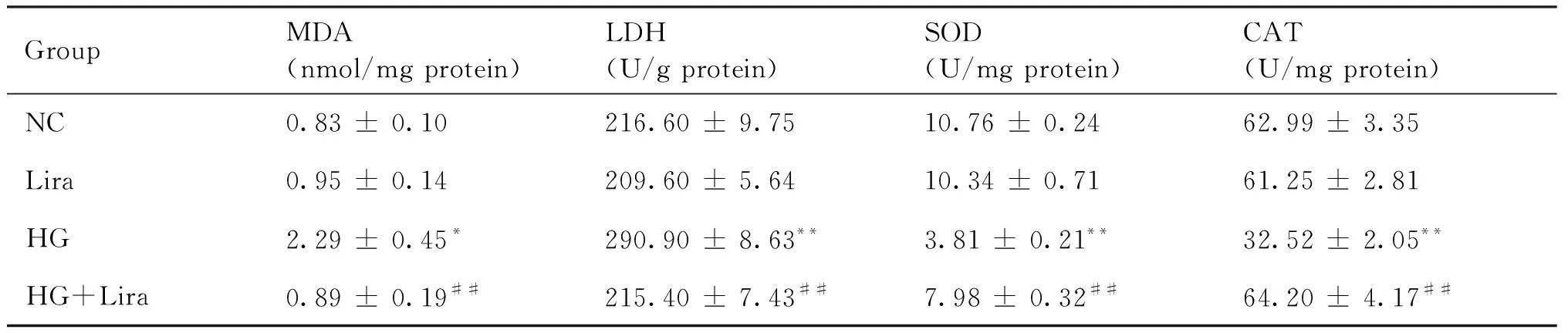
Table 1 The change of the MDA, SOD, CAT and LDH levels (Mean±SD, n=3)
2.7 利拉鲁肽抑制高糖刺激下MIN6细胞解偶联蛋白2的表达
与正常对照组(0.31 ± 0.01)相比,利拉鲁肽UCP2表达量(0.32 ± 0.02)无显著变化,无统计学意义(P>0.05),HG组蛋白质表达量(1.08 ± 0.11)升高(P<0.01)。与高糖组比较,利拉鲁肽作用高糖组UCP2表达量(0.61 ± 0.04)降低(P<0.05),结果见Fig.6。
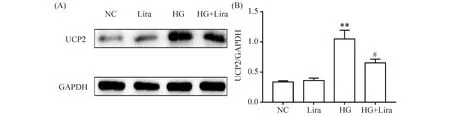
Fig.6 Western blot analysis of UCP2 expression levels (A)The control group (NC) was cultured under normal conditions. The high glucose group (HG) was treated with 33 mmol/L glucose. The liraglutide group was treated with 100 nmol/L liraglutide. The high glucose and liraglutide group (HG + Lira) was treated with 33 mmol/L glucose and 100 nmol/L liraglutide. (B)Data are presented as the Mean ± SD, n=3. Statistical significances were calculated using Student’s t-test, **P <0.01 compared with the NC group; # P<0.05 compared with the HG group
3 讨论
T2DM患者体内存在一定程度的胰岛β细胞损伤以及功能紊乱,其分泌的胰岛素作为人体内的主要降糖物质,影响着T2DM发生和发展的全过程[7]。常规代谢途径中,胰岛素将人体血糖值维持在正常水平,当存在长期高糖高脂等损伤因素时,胰岛β细胞会处于能量代谢异常、分泌功能紊乱等影响胰岛素释放状态[8]。受神经激素的调节,胰岛细胞通过感知血液中葡萄糖、脂肪和蛋白质等营养物质的代谢水平,促使胰岛素合成和分泌的偶联信号产生。2008年,Nolan等人[9]研究表明,胰岛β细胞对营养物质的高感知能力,同时也增加了其营养毒性的概率,这也解释了长期高糖环境会导致β细胞衰竭和2型糖尿病。本研究采用高糖(33 mmol/L)诱导胰岛MIN6细胞48 h建立高糖损伤模型,观察利拉鲁肽(100 nmol/L)作用于高糖损伤胰岛细胞后相关指标的变化情况。通过CCK-8检测发现,高糖组细胞活力下降,而利拉鲁肽可改善高糖诱导的胰岛细胞的存活率,提示利拉鲁肽具有保护高糖损伤胰岛细胞的潜力。
线粒体作为细胞的主要产能工厂,在维持细胞的结构、功能和能量代谢等方面具有重要的作用[10-11]。本研究采用小鼠胰岛素酶联免疫检测试剂盒和ATP含量检测试剂盒检测发现,利拉鲁肽可有效增加胰岛素的分泌量和细胞内ATP含量。同时,本文通过活体细胞荧光检测试剂盒检测线粒体膜通道孔的开放情况,在激光共聚焦显微镜下发现,利拉鲁肽可增加高糖环境下胰岛细胞的绿色荧光强度,表明其对线粒体具有一定保护作用。因此,利拉鲁肽可能与调节线粒体功能,保护细胞正常呼吸链运行有关,维持细胞正常的物质代谢和能量供应。
解偶联蛋白2(uncoupling protein 2,UCP2)是线粒体内膜的一类载体蛋白质,具有调节机体能量代谢的作用[12]。当UCP2过量表达时,其可通过质子漏机制,使线粒体呼吸链氧化磷酸化过程脱偶联,产生的能量以对细胞功能运行无效的热能形式散失,导致ATP合成减少[13]。课题组前期研究发现,UCP2的抑制剂京尼平可通过下调UCP2表达,提高ATP含量及胰岛素的释放量,改善线粒体功能,对高糖损伤的小鼠胰岛细胞发挥保护作用[14]。研究还表明,胰岛细胞的UCP2在长期高糖环境可表达上调,导致胰岛功能紊乱[15-20]。2011年,Zhang等人[21]研究发现,UCP2缺陷的小鼠在摄取葡萄糖15~60 min的各时间段均显著增加了GLP-1的分泌水平,提高了GLP-1对葡萄糖的响应,提示UCP2可抑制葡萄糖刺激的GLP-1分泌水平。利拉鲁肽作为GLP-1类似物,目前广泛用于治疗DM,但其是否通过调节UCP2表达来调节能量代谢,发挥保护胰岛细胞功能的作用,国内外未见相关报道。为探究利拉鲁肽对线粒体的保护作用机制以及影响胰岛素分泌相关抗氧化蛋白质的表达情况,本研究通过Western印迹对高糖刺激48 h后的小鼠胰岛MIN6细胞中UCP2的表达情况进行分析。结果显示,高糖组UCP2表达较正常细胞对照组明显上调,而利拉鲁肽作用高糖组后有效降低了UCP2的表达,提示利拉鲁肽通过降低高糖环境下,UCP2的表达来抑制UCP2在氧化磷酸化过程中的过度解偶联作用,恢复呼吸链中ADP与无机磷酸合成ATP的偶联反应。
氧化应激是T2DM发生和发展的一个重要危险因素,氧自由基引发脂类过氧化反应,其产物具有细胞毒性[22]。有研究表明,利拉鲁肽可通过促进线粒体自噬,恢复线粒体功能,并保护胰岛β细胞免受氧化应激损伤[23]。在本文的研究中发现,高糖组ROS水平较对照组升高,利拉鲁肽作用高糖组ROS水平降低;高糖组细胞MDA和LDH水平升高,SOD和CAT水平降低,而利拉鲁肽能降低高糖环境小鼠MIN6胰岛细胞MDA和LDH水平,同时升高SOD和CAT水平,提示利拉鲁肽可通过抑制脂质过氧化过程,提高内源性SOD活性,加强氧自由基的清除从而减轻氧自由基对MIN6的损伤,发挥抗氧化作用。
综上所述,利拉鲁肽在改善高糖环境下胰岛细胞的功能方面具有一定的潜力,保护胰岛细胞不受线粒体损伤所带来的功能衰退,纠正胰岛细胞在损伤条件下的能量代谢异常,增强抗氧化作用,其机制可能与下调UCP2的表达和调控线粒体的能量代谢有关。
猜你喜欢
杂志排行
中国生物化学与分子生物学报的其它文章
- DeepCKI:一个基于变分图自编码器预测细胞-细胞因子相互作用的生物信息学模型
- 半翻转生物化学教学模式对学生学业成绩和自我认知的影响
- 人多能干细胞来源的肾定向分化平台的构建
- 泛素样蛋白UBQLN2通过抑制结肠癌Wnt信号通路发挥抑癌作用
- 两种表达系统来源新冠病毒RBD蛋白免疫小鼠后的IgG抗体水平对比研究
- Potent Anti-bacteria Activity of Tamsulosin Hydrochloride and Ningmitai Capsule in Combination by Regulating the Gene Expression Related to β-Lactamase, Hemolysis, and Virulence
