泛素样蛋白UBQLN2通过抑制结肠癌Wnt信号通路发挥抑癌作用
2022-09-08孙光源王晓元任艳丽胡智洁武雪亮
孙光源, 王晓元, 任艳丽, 尹 洁, 胡智洁, 武雪亮, 薛 军
(河北北方学院附属第一医院 普通外科,河北 张家口 075000)
结直肠癌是胃肠道中常见的恶性肿瘤,其发病率和病死率在消化系统恶性肿瘤中仅次于胃癌、食管癌和原发性肝癌,发生率在不少地区有不同程度的增加趋势[1]。结肠癌早期症状不明显;大多患者在发现时已经处于疾病的中晚期,严重影响患者的救治和预后,也给患者的家庭和社会造成了经济负担。所以,结直肠癌的治疗关键在于早期发现、及时诊断和规范治疗[2]。中晚期结肠癌的治疗包括手术、化疗和免疫治疗[3]。由于预后不良,结肠癌治疗仍然面临着巨大的挑战,迫切需要在临床上探索新的治疗方法和诊断标志物。
Wnt信号通路是与结肠癌发生发展密切相关的促癌信号通路,其标志蛋白质β-联蛋白(β-catenin)激活对肿瘤异常增殖至关重要[4]。泛素样蛋白2(ubiquilin2, UBQLN2)是泛素样蛋白质家族的一员,UBQLN2在细胞信号传导、蛋白质泛素化降解、内质网应激、溶酶体稳态及自噬等过程中发挥着重要作用[5],其中UBQLN2在恶性肿瘤例如骨肉瘤的发生中发挥重要作用[6]。研究发现,UBQLN在许多人类肿瘤细胞系和原发性人类肺癌样本中缺失和低表达,在肺癌细胞中UBQLN1的下调诱导上皮细胞向间充质细胞转化,并且其可以作为非小细胞肺癌治疗的潜在标志物[5]。但是目前UBQLN2在结直肠癌中的表达及作用尚不清楚,UBQLN2与Wnt信号通路之间的研究尚未见报道。因此,本研究主要通过体外细胞实验探讨和研究UBQLN2对结肠癌细胞增殖和凋亡的影响,同时重点关注UBQLN2与Wnt信号通路之间的关系。
1 材料与方法
1.1 材料和患者资料
HT29、SW620、SW480、LOVO、HCT116和HIEC细胞购自中科院上海细胞库;DMEM、胎牛血清、胰蛋白酶消化液购自HyClone;青链霉素混合液、4%多聚甲醛购自北京碧云天有限公司。一抗UBQLN2(Abcam,ab190283)、β-联蛋白(Abcam,ab223075)、pGSK-3β(Cell Signaling Technology,9336)和肌动蛋白(actin)(Abcam,ab8226)。
选取河北北方学院附属第一医院在2020年1月~2021年1月期间手术切除的结直肠癌组织90例和癌旁正常组织90例。纳入标准:经病理检查确诊均为原发肿瘤,排除标准:术前行辅助放化疗,伴转移瘤、复发肿瘤,伴有心脑血管疾病及其他手术禁忌证。临床资料收集患者的肿瘤分期以及患者生存期等指标,分析UBQLN2蛋白质表达与临床病理特征。所有患者治疗均以手术切除为主,本研究经过本院伦理委员会批准。
1.2 细胞转染
转染前1 d,将HCT116细胞用胰酶消化,计数,接种6孔板,转染日细胞融合度为80%。在100 μL无血清DMEM培养基中分别加入2 μg pcDNA3.1-NC及pcDNA3.1-UBQLN2,再分别和100 μL含10 μL Lipofectamine的无血清DMEM培养基混合为转染试剂,室温保温30 min。用无血清培养基清洗细胞后每孔加入0.8 mL无血清DMEM培养基,加入0.2 mL 转染试剂。对照组细胞不加转染试剂,其他2组细胞分别加入含 pcDNA3.1-NC和pcDNA3.1-UBQLN2的转染试剂。37 ℃、5%CO2培养5 h,加入含血清DMEM培养基培养48 h后换筛选培养基。筛选培养基G418的浓度为500 μg/mL。筛选培养约20 d,获得稳定转染细胞株。
转染前1 d,对数期SW480细胞在6孔板中过夜,密度为3×105/well,每孔加入2.5 mL不含抗生素的生长培养基。待细胞生长密度达60%,细胞中去除生长培养基,加入1.5 mL新鲜的不含血清的生长培养基。对于每个转染的孔,按照如下方法分别准备si-NC,si-UBQLN2 (50 nmol/L)(序列见Table 1)和 Lipofectamine RNAiMAX 混合物,在250 μL的无血清生长培养基中加入100 pmole siRNA,柔和混匀。Lipofectamine RNAiMAX使用前先混匀,再向250 μL生长培养基中加入5 μL,Lipofectamine RNAiMAX进行稀释,室温下孵育5 min。混合稀释好的siRNA和Lipofectamine RNAiMAX,室温下孵育20 min。加入混合物到含有HeLa 细胞的6孔板中,每孔终体积为2 mL,并轻晃混匀。在37 ℃的二氧化碳培养箱中培养细胞 5~6 h。更换培养基并培养细胞48 h,转染36 h后收集细胞,以验证转染效率,供后续使用。
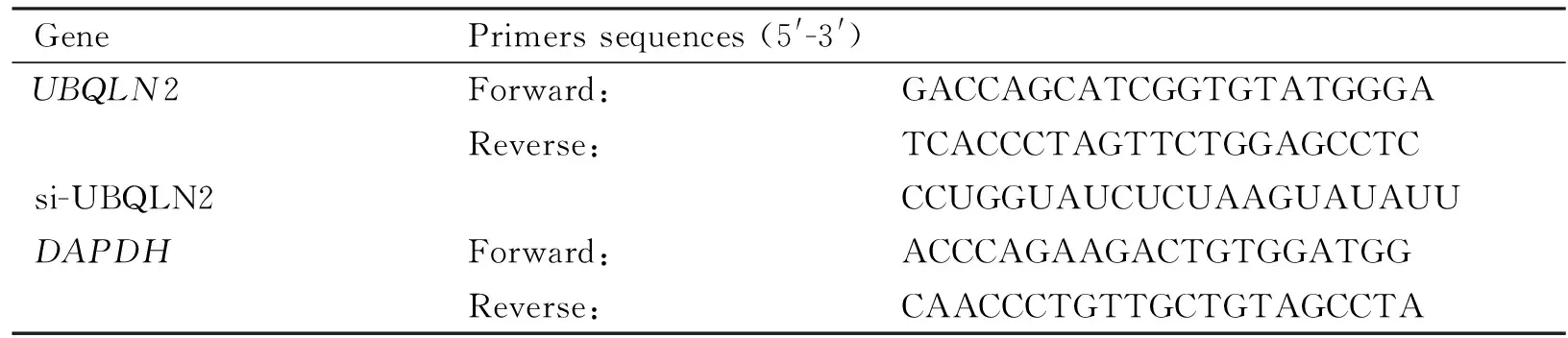
Table 1 Primer sequence
1.3 流式细胞仪检测细胞凋亡
收集细胞,数目约5×106个/mL,1 000 r/min离心5 min,弃去培养液。细胞洗涤,3 mL PBS洗涤1次。乙醇固定,离心去PBS,加入冰预冷的70%的乙醇固定,4 ℃,1~2 h。细胞重悬,离心弃去固定液,3 mL PBS重悬5 min。细胞过滤,400目的筛网过滤1次,1 000 r/min离心5 min,弃去PBS。染色,用1 mL PI染液染色,4 ℃避光30 min。流式细胞仪检测,PI用氩离子激发荧光,激光光波波长为488 nm,发射光波波长大于630 nm,产生红色荧光分析PI荧光强度的直方图也可分析前散射光对侧散射光的散点图。
1.4 CCK-8 检测细胞增殖
HCT116和SW480细胞分别过表达UBQLN2和沉默UBQLN2表达,培养细胞密度达70%,收集细胞制备为1×104/mL细胞悬液。96孔板每孔添加细胞悬液100 μL,分别于0、12、24、36、48 h加入10 μL CCK-8溶液,孵育2 h,用酶标仪检测450 nm波长下的吸光度值。
1.5 qRT-PCR检测泛素样蛋白2表达
HCT116和SW480细胞先用胰蛋白酶消化收集,PBS充分洗涤细胞去除残余培养基,再加入1 mL Trizol进行裂解。加入1 mL Trizol试剂,混匀,冰上孵育10 min;4 ℃,12 000 r/min离心10 min,转移上清液至新EP管中;加入200 uL氯仿,剧烈振荡15 sec,室温孵育5 min;4 ℃,12 000 r/min离心15 min。小心转移上层水相到新的EP管,不要吸取中间相,加入等体积的异丙醇,颠倒混匀约10次,室温放置10 min;4 ℃,12 000 r/min离心10 min。弃上清,1 mL 75%乙醇洗涤RNA沉淀2次;4 ℃,12 000 r/min离心5 min,弃上清,室温下风干5 min,将RNA溶于15 μL~50 μL DEPC水中;立即进行反转录反应,并-80 ℃保存。仪器检测目的基因相对GAPDH的表达水平。反应条件设定如下:在95 ℃预变性10 min;在95℃下退化10 s; 在60 ℃下退火20 s并在72 ℃下延伸35 s。2-△△t方法用于计算UBQLN2相对表达,实验重复3次。
1.6 免疫荧光检测Bcl-2/Bax
用聚乙烯亚胺或多聚赖氨酸涂覆盖玻片,在室温下放置 1 h,用无菌水充分漂洗盖玻片 3 次,每次 1 h。使结直肠癌细胞在玻璃盖玻片上生长,用PBS简单漂洗。固定细胞:室温下,在 4% 多聚甲醛中孵育细胞 10 min,用冰 PBS 洗涤细胞 3 次。抗原修复:将抗原修复缓冲液(100 mmol/L Tris,5%尿素,pH 9.5)预热至 95 ℃。具体方法为:玻片放入95 ℃水浴锅,抗原修复缓冲液中修复;在 95 ℃ 下加热盖玻片 10 min;从抗原修复缓冲液中取出盖玻片,随后PBS 洗涤细胞 3 次,每次 5 min。通透:用 PBS(含 0.1% ~0.25% Triton X-100)孵育样品 10 min,用 PBS 洗涤细胞 3 次,每次 5 min。封闭与免疫染色:用 1% BSA、22.5 mg/mL 甘氨酸的 PBST (PBS + 0.1% Tween 20) 孵育细胞 30 min;室温下,用稀释UBQLN2(1∶1 000)在湿盒中孵育细胞1 h;倒出溶液,用PBS洗涤细胞3次,每次5 min;室温下,用二抗(溶于1% BSA 中)避光孵育细胞1 h;倒出二抗溶液,用PBS避光洗涤细胞3次,每次5 min。复染:用0.1~1 μg/mL DAPI孵育细胞1 min,用PBS漂洗细胞。封片:用一滴封片介质封闭盖玻片,用树脂密封盖玻片,避免样品变干和在显微镜下移动,-20 ℃下避光保存。
1.7 免疫组化检测泛素样蛋白2
取出冷冻保存的标本(结肠癌组织和邻近的正常组织),用10%福尔马林固定,石蜡包埋,切成3~4 μm的切片。将石蜡切片放入3% H2O2中,分别用二甲苯I和二甲苯II脱蜡10 min,在100%乙醇中按升序脱水2 min,95%乙醇中脱水2 min,80%乙醇中脱水2 min,70%乙醇中脱水2 min。然后,在振动台中用蒸馏水(每次5 min)洗涤切片2次,在3% H2O2中浸泡10 min,并用蒸馏水清洗。在高压下进行抗原修复90 s,在室温下冷却切片,用磷酸盐缓冲盐水(PBS)溶液清洗,并于37 ℃下与5%牛血清白蛋白孵育30 min。添加UBQLN2抗体(1∶400),并在4 ℃下孵育过夜。再添加二抗、辣根过氧化物酶(HRP)结合山羊抗鼠抗体,并在37℃下培养30 min。苏木精用于细胞核染色30 s,3,3′-二氨基联苯胺用于显色。在盐酸-乙醇中将切片脱水至透明,用树胶固定切片,在显微镜下观察并拍照。免疫组织化学染色结果的评估标准:细胞质中出现棕色或棕黄色颗粒的细胞,或染色>25%的细胞为UBQLN2阳性细胞。平均阳性染色面积百分比法分析免疫组化结果,实验重复3次。
1.8 Western印迹检测
调整细胞数5×104/mL,细胞汇合度达70%左右,收集细胞,细胞裂解液冰上裂解30 min,于4℃ 15 000 g下离心30 min,随后4 ℃离心吸取上清即提供总蛋白质。蛋白质被定量后计算上样量,加上样缓冲液,样品100 ℃煮5 min。SDS-PACE凝胶进行电泳,电泳结束后将目的蛋白质转至PVD膜,脱脂牛奶封闭。然后在4 ℃下与一抗一起孵育过夜,UBQLN2(1∶1 000)、β-联蛋白(1∶1 000)、pGSK-3β(1∶1 000)和肌动蛋白(1∶1 000),次日再与二抗孵育,PBS清洗,ECL发光仪进行发光拍照,Image-J软件分析Western-blot灰度值。
1.9 统计学分析
数据应用 SPSS 20.0进计分析,组间比较用t检验,多组件比较用F检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 泛素样蛋白2在结肠癌组织中低表达
为了初步探讨UBQLN2在结肠癌中可能发挥的作用,免疫组化检测结肠癌患者肿瘤组织和手术中肿瘤组织边缘正常肠组织中UBQLN2的表达,结果发现:UBQLN2在结肠癌肿瘤组织中的IHC染色阳性面积(12.21±2.45)显著低于正常组织(35.75±11.98)(P=0.0032,Fig.1),且通过UBQLN2与结肠癌病理特征之间的关系(Table 2),初步可知UBQLN2在结肠癌中可能发挥抑癌作用。
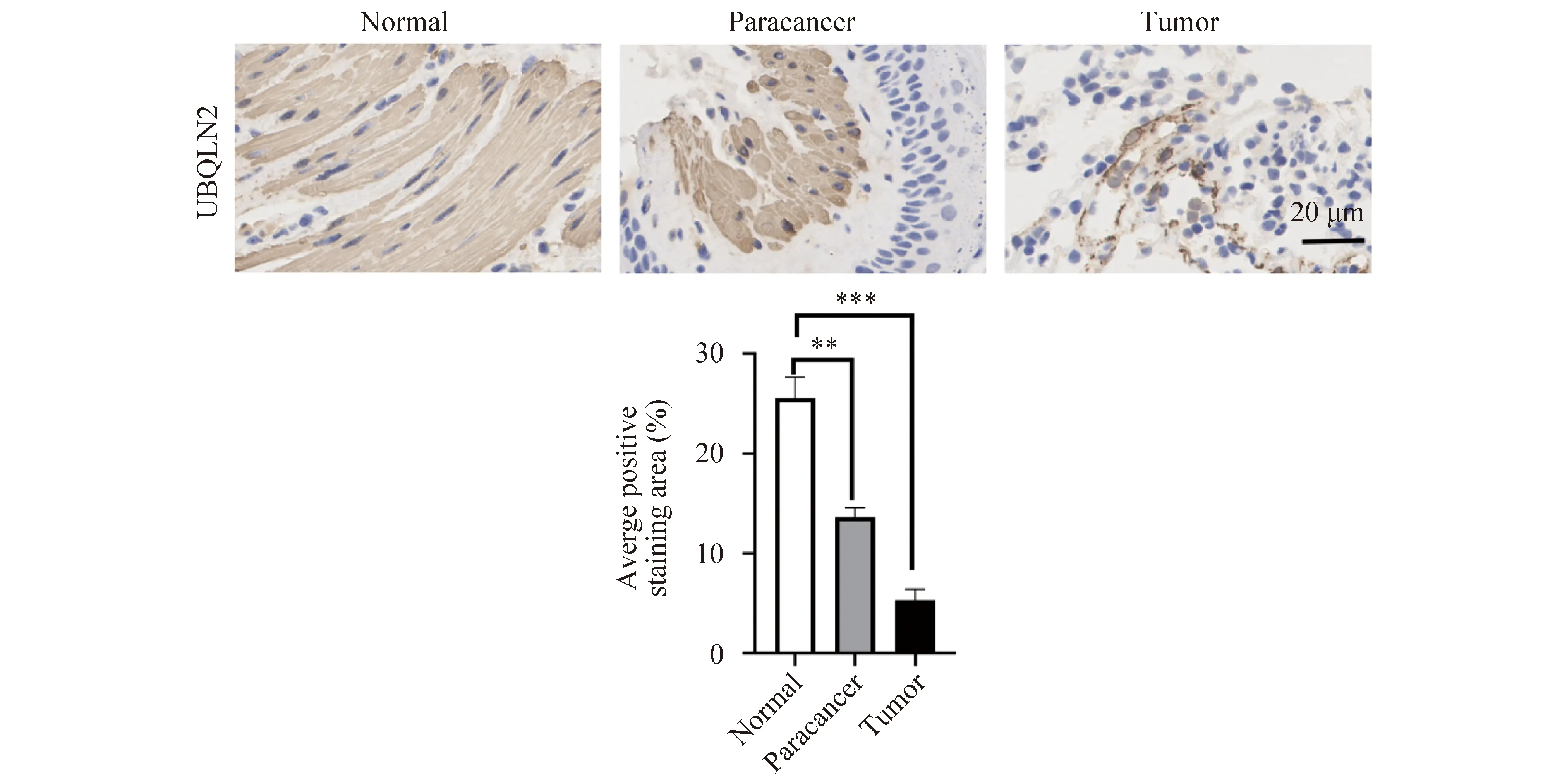
Fig.1 UBQLN2 is highly expressed in colorectal cancer tumor tissues UBQLN2 protein expression was detected by immunohistochemistry in different colon cancer tissues. Error bars represent the means±SD from three independent experiments. ***P<0.001, **P<0.01
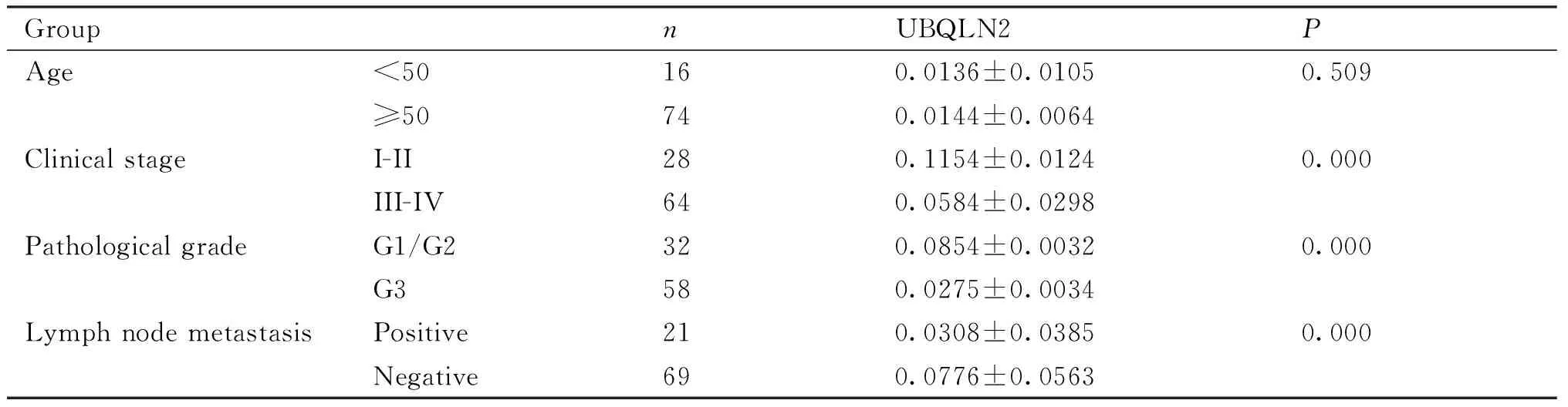
Table 2 Correlation between UBQLN2 expression and clinicopathological characteristics of human colon cancer
2.2 泛素样蛋白2在体外结肠癌细胞中低表达
在体外结肠癌细胞HT29、SW620、SW480、LOVO、HCT116和肠上皮正常细胞HIEC中进一步观察UBQLN2表达情况,结果发现:UBQLN2在HT29、SW620、LOVO、HCT116中表达均低于HIEC细胞,且HCT116细胞表达最低,为对照组HIEC的0.25倍(P<0.001, Fig.2),在SW480细胞中表达最高,灰度值为对照组HIEC的1.45倍(P=0.036, Fig.2)。
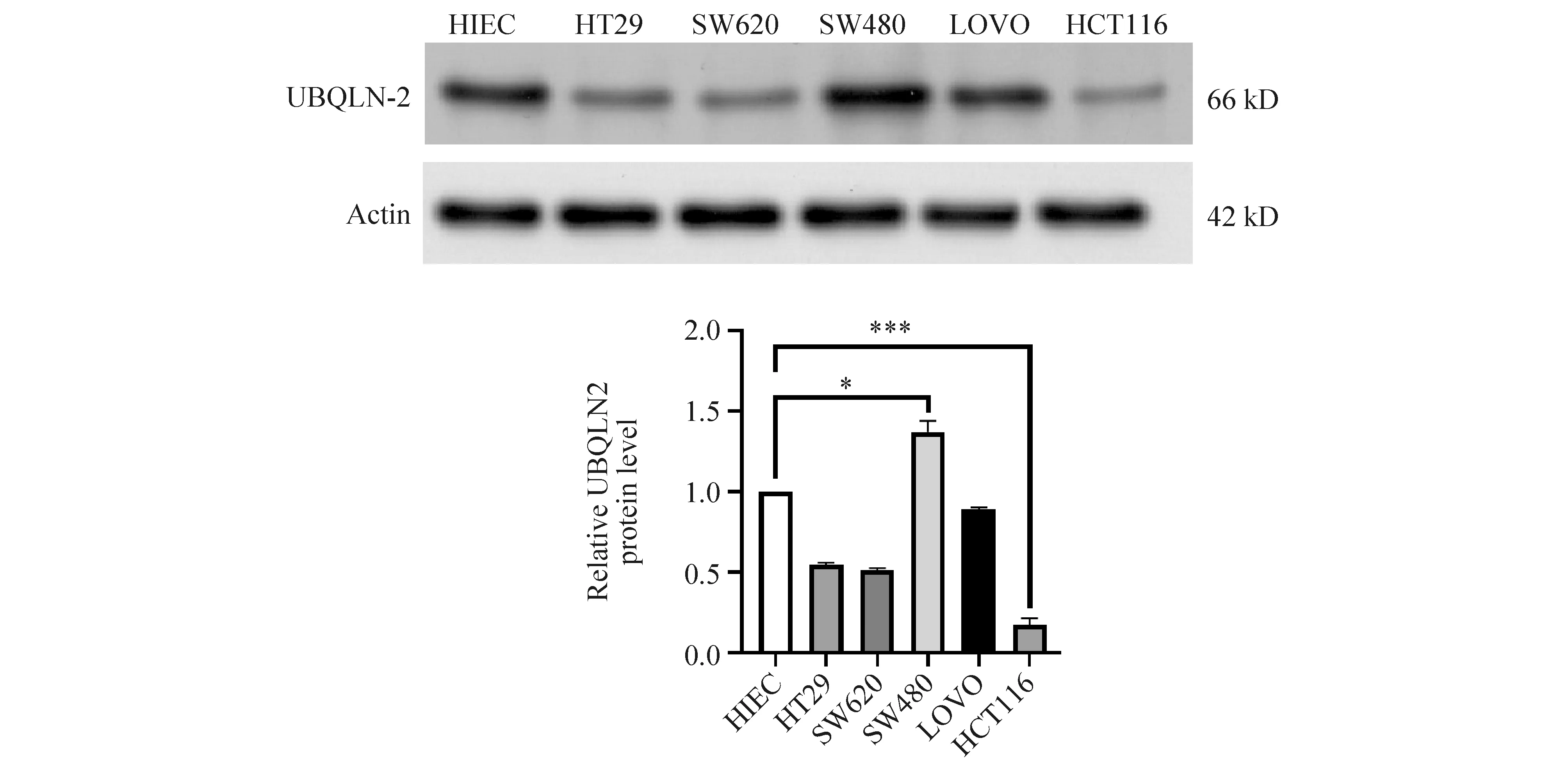
Fig.2 Expression of UBQLN2 is the highest in SW480 cells and the lowest in HCT116 cells Expression of UBQLN2 protein was detected by Western blotting in various colon cancer cell groups. Error bars represent the means±SD from three independent experiments. ***P<0.001, *P<0.05
2.3 泛素样蛋白2抑制结肠癌细胞增殖促进结肠癌细胞凋亡
为了研究UBQLN2在结肠癌中的作用,分别使用细胞转染技术在HCT116中过表达UBQLN2,在SW480细胞中敲低UBQLN2(Fig.3A),观察到转染后UBQLN2在HCT116细胞中过表达(P<0.001),在SW480细胞低表达(P<0.001)(Fig.3B)。随后,CCK-8进行细胞增殖检测,流式细胞术进行凋亡分析,以评估UBQLN2对HCT116和SW480细胞增殖和凋亡的影响。结果正如Fig.3C,D所示,生长曲线分析显示,HCT116细胞UBQLN2过表达培养48 h后细胞活力值0.76±0.13显著低于对照组0.94±0.19,(P=0.031,Fig.3B),SW480细胞UBQLN2敲低后培养48 h时细胞活力值1.12±0.24显著高于对照组0.92±0.18,(P=0.029,Fig.3B)。本文还进行了Annexin-V/PI染色,用以分析UBQLN对结肠癌凋亡影响。通过FACS分析凋亡结果发现,UBQLN2过表达使HCT116细胞凋亡率76.43%显著高于对照组 43.05%(Fig.3E),UBQLN2被敲低后SW480细胞凋亡率68.45%明显低于对照组86.04%(Fig.3E)。
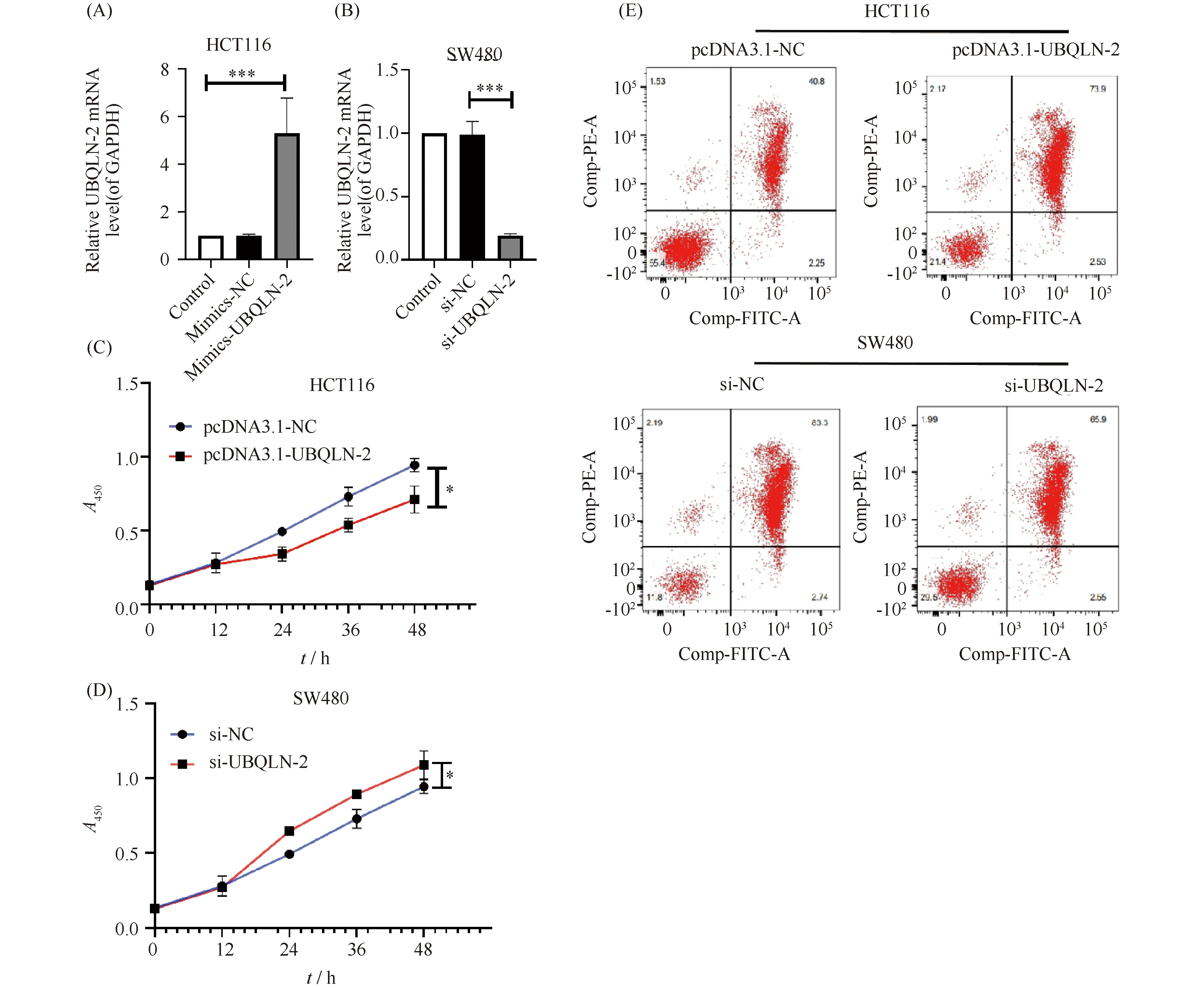
Fig.3 UBQLN-2 decreases cell proliferation and increases cell apoptosis in colon cancer cells (A,B) Expression of UBQLN2 mRNA was measured by RT-PCR. (C,D) Cell proliferation was determined by CCK-8 assay at 48 hours after transfection. (E) Apoptotic cells were analyzed by FACS analysis. Error bars represent the means±SD from three independent experiments. ***P<0.001, *P<0.05
进一步通过免疫荧光观察UBQLN2对结肠癌细胞凋亡蛋白质Bcl-2/Bax的影响,结果显示:HCT116细胞过表达UBQLN2后Bcl-2蛋白质水平降低(31.09±10.35vs11.46±2.98),Bax蛋白质水平增加(17.89±5.82vs34.09±15.43)(P<0.001,Fig.4A);SW480细胞敲低UBQLN2后Bcl-2蛋白质水平增加(19.91±6.09vs52.75±19.52),Bax蛋白质水平减少(25.15±8.75vs10.64±2.53)(P=0.0053,Fig.4B)。以上结果说明,UBQLN2能够调控结肠癌的异常增殖和凋亡,抑制结肠癌的发生发展。
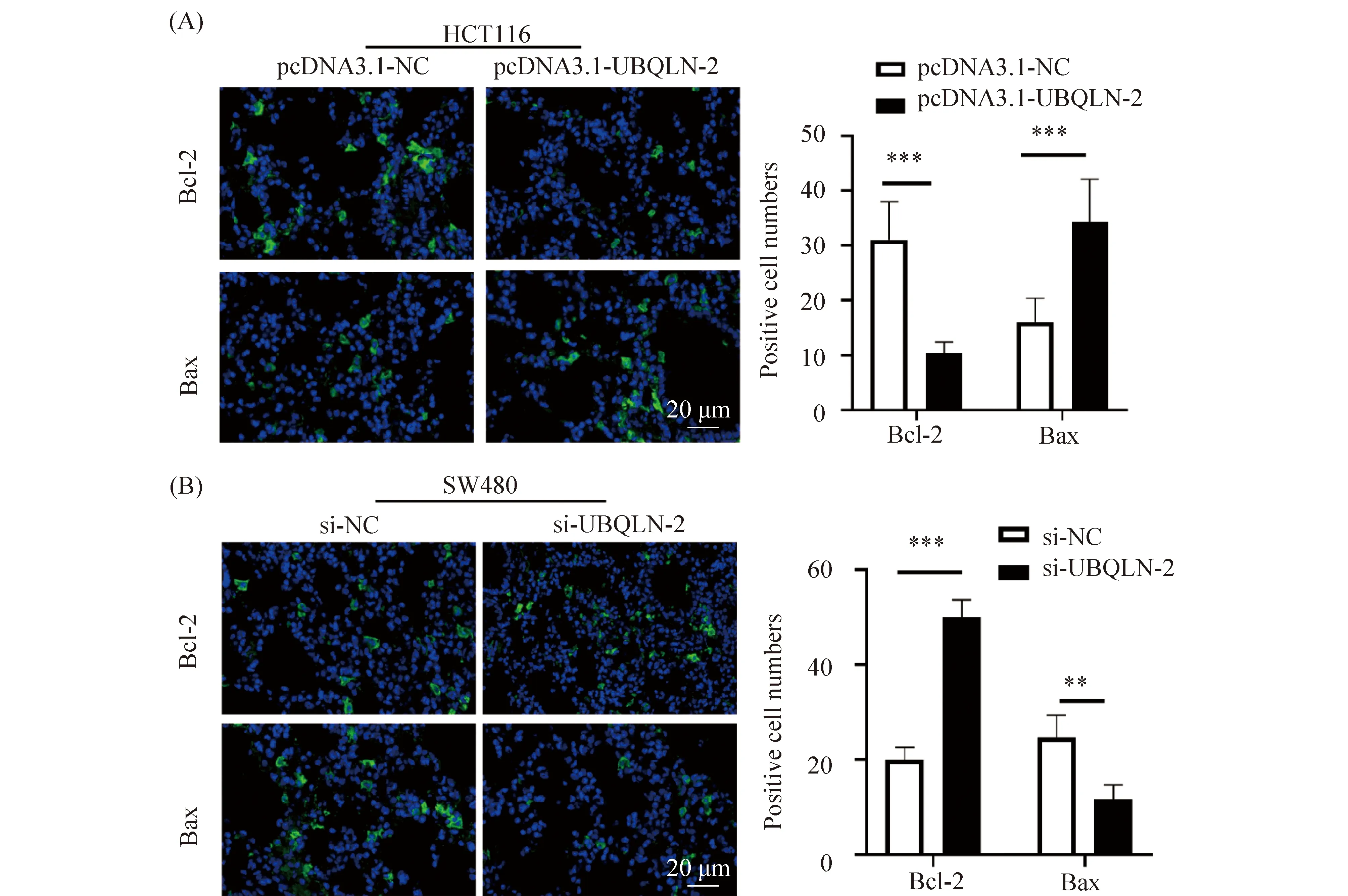
Fig.4 Effect of UBQLN2 on the expression of pro-and anti-apoptotic proteins Bax and Bcl-2 (A) The level of Bcl-2 and Bax after UBQLN2 overexpression was measured by immunofluorescence staining. (B) The level of Bcl-2 and Bax after UBQLN2 silencing was measured by immunofluorescence staining. Error bars represent the means±SD from three independent experiments. ***P<0.001, **P<0.01
2.4 泛素样蛋白2抑制结肠癌Wnt信号通路激活
Wnt信号通路激活是肿瘤细胞异常增殖的重要分子机制[4]。近年来,许多研究表明,Wnt通路的异常激活与人类癌症特别是结肠癌的发生发展密切相关[7-9]。因此,本文设计实验进一步观察UBQLN2与Wnt信号通路之间的关系。Western 印迹分析结果显示:HCT116细胞过表达UBQLN2后Wnt信号通路标志β-联蛋白表达减少71.99%,pGSK-3β表达增加8.12倍,SW480细胞敲低UBQLN2后β-联蛋白表达增加6.13倍,pGSK-3β表达减少71.43%(P<0.001,Fig.5),提示UBQLN2能够调控Wnt信号通路,二者的相互作用在结肠癌中发挥重要作用。

Fig.5 Marker proteins of Wnt signaling pathway are expressed after UBQLN2 overexpression and knockdown, respectively The level of β-catenin and pGSK-3β after UBQLN2 overexpression or knockdown was measured by Western blotting. Error bars represent the means±SD from three independent experiments. ***P<0.001
2.5 Wnt信号通路抑制结肠癌泛素样蛋白2的表达
UBQLN2能够调控Wnt信号通路,那么Wnt信号通路对UBQLN2的作用如何。为了进一步研究UBQLN2与Wnt信号通路之间的关系,分别用Wnt信号通路的激活剂Wnt3a和抑制剂Dkk1分别处理HCT116和SW480细胞,随后Western 印迹观察UBQLN2以及β-联蛋白和pGSK-3β变化,结果显示:与对照组相比Wnt3a激活HCT116细胞β-联蛋白表达5.54倍,pGSK-3β表达减少80.58%,UBQLN2表达减少57.81%;Dkk1抑制SW480细胞β-联蛋白表达2.38倍,促进pGSK-3β表达8.35倍,增加UBQLN2表达3.84倍(P<0.001,Fig.6)。此结果表明,在结肠癌发生发展过程中Wnt信号通路能够抑制UBQLN2表达,提示Wnt信号通路与UBQLN2表达在结肠癌中发挥重要作用。
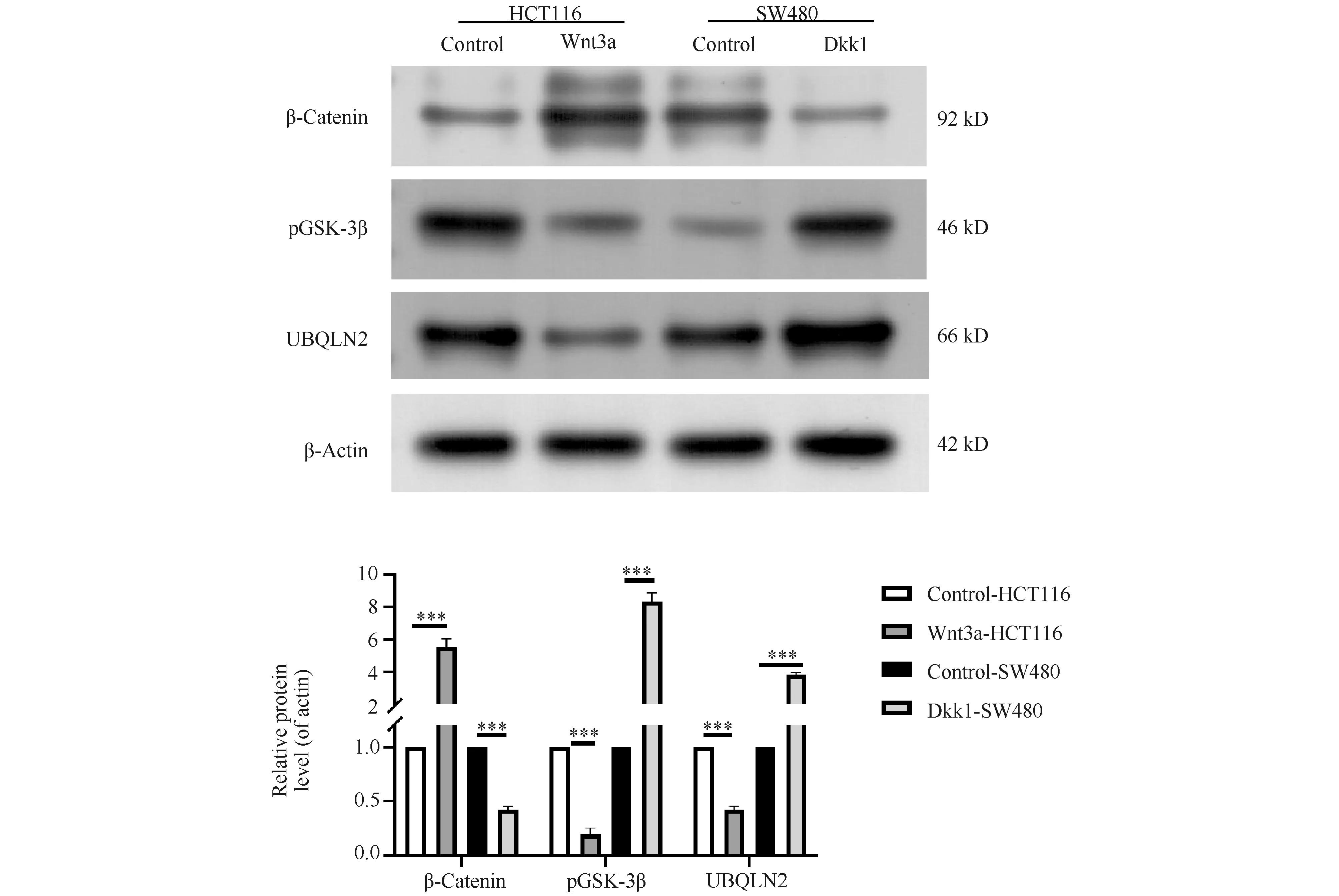
Fig.6 Marker proteins of Wnt signaling pathway were expressed after treatment with activator Wnt3a and inhibitor Dkk1, respectively The level of β-catenin, pGSK-3β and UBQLN2 were measured by Western blotting after treatment with activator Wnt3a and inhibitor Dkk1. Experiments were independently repeated three times. ***P<0.001
3 讨论
结肠癌是消化道常见的恶性肿瘤,其发病率逐年增高且发病人群越来越年轻,致死率仅次于消化道胃癌、食管癌和原发性肝癌[2]。结肠癌早期症状不明显,患者通常确诊时多已经处于中晚期,早期容易误诊和漏诊,严重影响结肠癌患者的诊治和预后[10],因此,结肠癌诊疗过程中早发现、早诊断和早治疗至关重要,针对结肠癌生物标志物的研究尤为重要。
泛素样蛋白质(ubiquilin)家族在肿瘤的发生发展过程中发挥重要作用[11, 12]。有研究发现,在肺癌细胞中UBQLN1的下调诱导上皮间充质转化,并且其可以作为非小细胞肺癌治疗的潜在标志物[13]。而UBQLN2的主要功能是帮助细胞清除危险的蛋白质团块,UBQLN2可识别热激蛋白质70(HSP70),并将其链接到蛋白酶复合体,让聚集和错误折叠的蛋白质开始降解[14]。有研究发现,UBQLN2在肺癌中低表达,且参与癌细胞的增殖[15];通过UBQLN2基因敲低,研究发现UBQLN2基因能够影响HeLa细胞增殖[16]。但是目前UBQLN2在结直肠癌中的表达及作用尚不清楚。
本研究已有结果证实,UBQLN2在肿瘤组织中的表达显著低于癌旁组织和正常组织,同时在体外实验中UBQLN2在结直肠癌细胞系中表达低于人正常肠上皮细胞,且UBQLN2与结肠癌患者临床病理特征密切相关。本研究在此基础上进一步研究UBQLN2对结肠癌细胞增殖和凋亡的影响及其具体的调控机制。已有结果提示,UBQLN2可能在结直肠癌中发挥抑癌作用,在HCTT116细胞和SW480细胞中分别过表达和敲低UBQLN2,结果发现,过表达后HCT116细胞增殖能力被抑制,而敲低后SW480细胞增殖能力增强,说明UBQLN2能够影响结直肠癌细胞的增殖能力,同时与正常对照组相比,过表达UBQLN2后HCT116细胞凋亡率显著增加,而敲低UBQLN2后SW480细胞凋亡率显著减少。随后观察了细胞凋亡相关蛋白质Bcl-2/Bax,结果显示,UBQLN2能够促进凋亡蛋白质增加,同时抑制结肠癌细胞周期相关蛋白质阻滞结肠癌的发生发展。以上结果进一步与前述结果相互印证,UBQLN2在结肠癌中发挥抑癌作用,能够抑制结肠癌细胞增殖能力同时促进结肠癌细胞凋亡。那么UBQLN2是如何发挥抑癌作用,具体通过哪条信号通路来实现的?
Wnt信号通路已经被证实是经典促进肿瘤发生的信号通路,其标志蛋白质β-联蛋白的激活代表Wnt信号通路的激活[17]。Wnt信号通路已经在多种肿瘤中被发现和研究[18-20],已有的相关研究报道很多,但是UBQLN2与Wnt信号通路在结肠癌中的研究鲜有报道。UBQLN2与Wnt信号通路关系如何,UBQLN2是否通过调控Wnt信号通路来发挥抑癌作用,本文对此进行了研究。同样在HCT116细胞和SW480细胞中分别过表达和敲低UBQLN2,观察Wnt信号通路标志蛋白质β-联蛋白和pGSK-3β表达情况,本文发现,随着UBQLN2的表达变化,β-联蛋白和pGSK-3β亦发生变化,UBQLN2过表达时抑制β-联蛋白表达,反之敲低后促进β-联蛋白表达,表明UBQLN2能够调控Wnt信号通路,很有可能抑制Wnt信号通路激活。为了进一步明确UBQLN2和Wnt信号通路的关系,本文使用Wnt信号通路的激活剂Wnt3a和抑制剂Dkk1分别处理HCT116和SW480细胞,观察Wnt信号通路被激活和抑制后UBQLN2的变化,结果发现,Wnt3a能够激活UBQLN2变化,而Dkk1显著抑制UBQLN2变化。此结果表明,UBQLN2能够调控Wnt信号通路,反过来Wnt信号通路也能够调控UBQLN2的表达,二者之间存在互相调节作用,但是具体的调节作用尚不清楚,将是我们下一步研究的重点。
综上所述,本研究初步探讨了UBQLN2在结肠癌中的表达及其对结肠癌细胞增殖和凋亡能力的影响,研究结果提示,UBQLN2可能是通过Wnt信号通路来实现抑癌功能,本研究不仅为结直肠癌的诊断寻找准确、有效的肿瘤标志物,也为结直肠癌的规范化治疗提供参考。
猜你喜欢
杂志排行
中国生物化学与分子生物学报的其它文章
- DeepCKI:一个基于变分图自编码器预测细胞-细胞因子相互作用的生物信息学模型
- 半翻转生物化学教学模式对学生学业成绩和自我认知的影响
- 人多能干细胞来源的肾定向分化平台的构建
- 两种表达系统来源新冠病毒RBD蛋白免疫小鼠后的IgG抗体水平对比研究
- Potent Anti-bacteria Activity of Tamsulosin Hydrochloride and Ningmitai Capsule in Combination by Regulating the Gene Expression Related to β-Lactamase, Hemolysis, and Virulence
- 利拉鲁肽抑制高糖诱导的小鼠胰岛细胞损伤
