局部晚期口腔鳞状细胞癌根治性切除术后预后模型的构建
2022-09-07林筱婉李翔杜池
林筱婉 李翔 杜池
作者单位:420000 武汉 1武汉市汉口医院口腔科;435000 黄石 2黄石市中心医院口腔科
口腔癌是全球常见的恶性肿瘤,每年约有35.5万例新病例[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔癌的主要组织学类型,约占口腔肿瘤的95%[2]。目前,局部晚期OSCC的预后并未显著改善[3-4]。因此,更好地了解预后因素,从而对患者进行合适的风险分层、优化治疗方法和进行个性化护理具有重要意义。TNM分期系统在临床实践中常用于评估OSCC患者生存率[5],但该系统考虑的临床病理特征有限,而OSCC预后与多种因素有关,如肿瘤部位、肿瘤分级、有无淋巴血管侵犯等病例因素以及患者特定特征如年龄和合并症等[6]。因此,综合考虑与预后相关的临床病理因素,才能更好地提供更准确的预后信息。
Cox比例风险模型是用于预测结果的一种常用方法[7]。在Cox回归基础上的列线图模型是一种统计工具,用于可视化复杂模型,以个性化预测患者的结果[8],目前已被广泛用于评估癌症患者的预后[9-10]。然而,预后模型精确度仍存在一定的局限[11]。此外,基于Cox回归的预后模型不能反映临床特征与研究结局的非线性关系[12]。因此,需要更好的算法分析非线性变量。机器学习是一个快速发展的数据分析领域,能解释众多特征之间的交互作用[13]。机器学习作为人工智能的一种形式可以迭代地提高算法性能,并模仿人类作出决策。目前已开发了几种机器学习模型分析生存数据,如随机生存森林(random survival forest,RSF)模型。该模型采用多个决策树集成来估计危险函数,与传统的生存分析方法相比,该模型允许根据个体疾病特征预测患者的特定风险比[14]。为了提高OSCC生存率估计的精确度,本研究通过回顾性分析局部晚期OSCC患者临床病理资料确定影响预后的因素,同时基于这些特征构建预后预测模型,以期对局部晚期OSCC进行更好的风险分层和临床决策。
1 资料与方法
1.1 研究设计及对象
回顾性招募2009年2月至2016年1月在武汉市汉口医院行根治性切除术的401例OSCC患者为研究对象。所有患者均经组织病理证实为局部晚期(Ⅲ期或Ⅳ期)非转移性OSCC,且行原发肿瘤切除术。其中排除158例患者,包括复发或转移癌39例,合并其他原发癌42例,术前接受放化疗或手术23例,病历信息不完整18例,失访36例。剩余243例患者纳入最终分析,其中182例患者被随机分配至训练集用于建立预测模型,61例被分配到验证集以评估模型的性能。本研究遵循《赫尔辛基宣言》,并获得武汉市汉口医院伦理委员会的批准。
1.2 预测变量
从本院电子病历系统收集患者数据,包括诊断时的年龄、性别、合并症、吸烟状况、术前血液检查结果、TNM分期、肿瘤分级、神经周围浸润情况、肿瘤浸润深度、阳性淋巴结数量、淋巴血管浸润、原发肿瘤部位、囊外延伸、安全边际范围等。TNM分期根据头颈部肿瘤AJCC(2010年第七版)TNM分期判断。采用卡普兰-范斯坦指数(Kaplan-Feinstein index,KFI)[15]评估合并症。
术前3 d内收集血液样本,用于检测中性粒细胞计数、单核细胞计数和血小板计数。全身炎症指数(systematic immune-inflammation index,SII)由术前外周血血小板(P)、中性粒细胞(N)和淋巴细胞(L)计数计算得出,公式:SII=P×N/L。中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)和血小板与淋巴细胞比值(platelet-lymphocyte ratio,PLR)计算公式:NLR=N/L,PLR=P/L。采用X-tile软件计算SII、NLR和PLR对总生存期(overall survival,OS)的最佳截断值,最佳截断值分别为521.3、2.7和160.1,分别根据截断值将患者分为两组。
1.3 预测结局及随访
本研究的主要预测结局为3年、5年OS率,OS定义为从手术日到研究结束或患者死亡的时间间隔。随访截至2021年2月。出院后通过电话或门诊复诊的形式进行随访,前3年每3个月随访1次,5年内每6个月随访1次,此后每年随访1次。
1.4 统计学方法
计量资料采用均数±标准差描述,组间比较采用独立样本t检验;分类资料采用n(%)描述,组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法计算生存率,组间比较采用log-rank检验。在训练集中采用Cox比例风险回归分析影响OS的因素,计算风险比(hazard ratio,HR)及其对应的95%可信区间(confi-dence interval,CI)。基于危险因素通过R软件中的rms程序包建立列线图模型,randomForestSRC程序包构建RSF模型,其中分类变量进行one-hot编码转换。RSF模型训练采用5折交叉验证。分别在训练集和验证集的评价列线图、RSF模型的效能。采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(AUC)和校准曲线评价模型的区分度和校准度,计算方法采用Bootstrap法,重抽样次数为1 000次。在验证集中评估模型的分层能力,首先采用X-tile软件计算风险概率的最佳临界值;其次根据最佳临界值将患者分为低风险组、中风险组和高风险组;最后采用log-rank检验比较各组生存曲线的差异。通过R软件中的rmda程序包中的相关函数采用决策曲线分析(decision curve analysis,DCA)在验证集中评估预测模型的临床净收益[16]。采用R 3.5.2软件(https://www.r-project.org)进行数据分析,所有统计检验均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料及生存情况
本研究共纳入了243例OSCC患者(其中男性185例)进行分析,平均年龄为(61.5±11.7)岁(范围:10~80岁)。肿瘤常见位置为活动的舌头和口腔底部。182例患者被分配至训练集,61例患者被分配至验证集。两组患者的人口统计学资料、临床病理资料等相似(均P>0.05),详见表1。
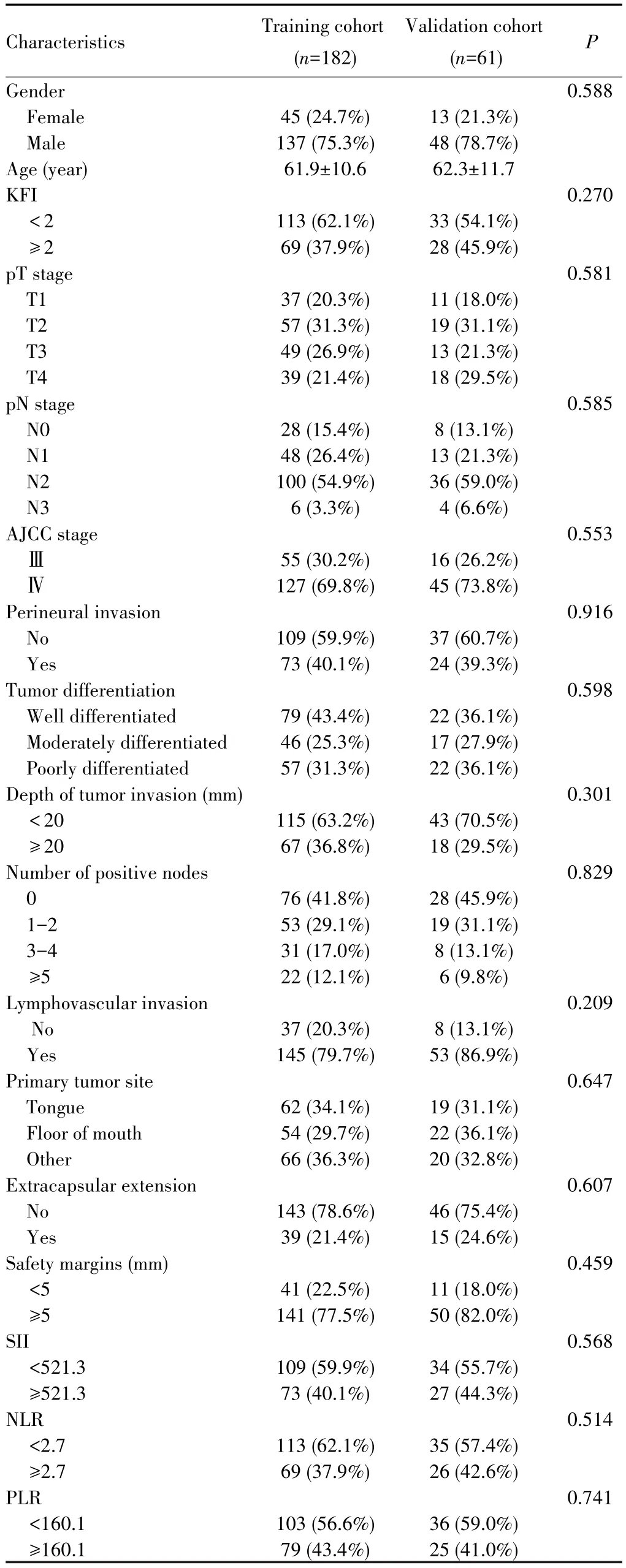
表1 243例局部晚期OSCC患者的一般资料*Tab.1 Characteristics of 243 locally advanced OSCC patients*
中位随访55个月(范围:2~87个月)。随访结束时,死亡115例,其中癌症相关死亡74例,因其他原因死亡41例。在训练集中,3年和5年OS率分别为67.1%和54.5%;在验证集中,3年和5年OS率分别为63.0%和55.4%。
2.2 影响预后的Cox回归分析
在单因素Cox回归中,年龄、KFI指数、pT分期、pN分期、AJCC分期、阳性淋巴结数、SII、NLR、PLR与OS有关(均P<0.05)。将单因素分析中差异有统计学意义的因素纳入多因素Cox回归,并执行逐步后退回归,结果显示年龄、KFI指数、pT分期、pN分期、AJCC分期、阳性淋巴结数、SII均是OS的独立预测因素(均P<0.05)。见表2。

表2 局部晚期OSCC患者OS的单因素和多因素Cox回归分析Tab.2 Univariable and multivariable Cox analyses for OS in locally advanced OSCC patients
2.3 预测模型构建与评价
基于Cox回归分析结果,本研究构建了预测3年和5年OS率的列线图模型,见图1。其可以通过绘制从变量到“点轴”的垂直线来确定每个因素的得分。通过将总分相加并在总分轴上定位,获得每3年、5年的估计OS率。本研究还基于独立危险因素构建RSF模型,其最优超参数见表3,预测变量的重要性见表4,其中排在前5位的变量依次为阳性淋巴结数≥5枚、阳性淋巴结数3~4枚、阳性淋巴结数1~2枚、N3期和N2期。

表3 随机生存森林的超参数Tab.3 Optimal hyperparameters for random survival forest model

表4 预测变量的重要性Tab.4 Permutation feature importance

图1 预测局部晚期OSCC患者OS的列线图模型Fig.1 Nomograms for OS prediction in locally advanced OSCC patients
采用ROC曲线在训练集和验证集中评价RSF模型、列线图模型以及AJCC分期的预测效能,结果显示,在训练集中RSF模型预测3年、5年OS率的AUC分别为0.803、0.794;在验证集中分别为0.782、0.780。不管是在训练集还是验证集中,列线图模型预测3年、5年OS率的AUC均高于AJCC分期(均P<0.05),而RSF模型的AUC均高于列线图模型(均P<0.05),见图2。

图2 局部晚期OSCC患者预测模型的ROC曲线Fig.2 ROC curves of predictive models in locally advanced OSCC patients
校正曲线和Hosmer-Lemeshow检验显示,RSF模型、列线图模型以及AJCC分期在训练集和验证集中预测3年、5年OS率的校准曲线均与45°斜线靠近,表明所有模型均具有良好的校准度(均P>0.05),见图3。
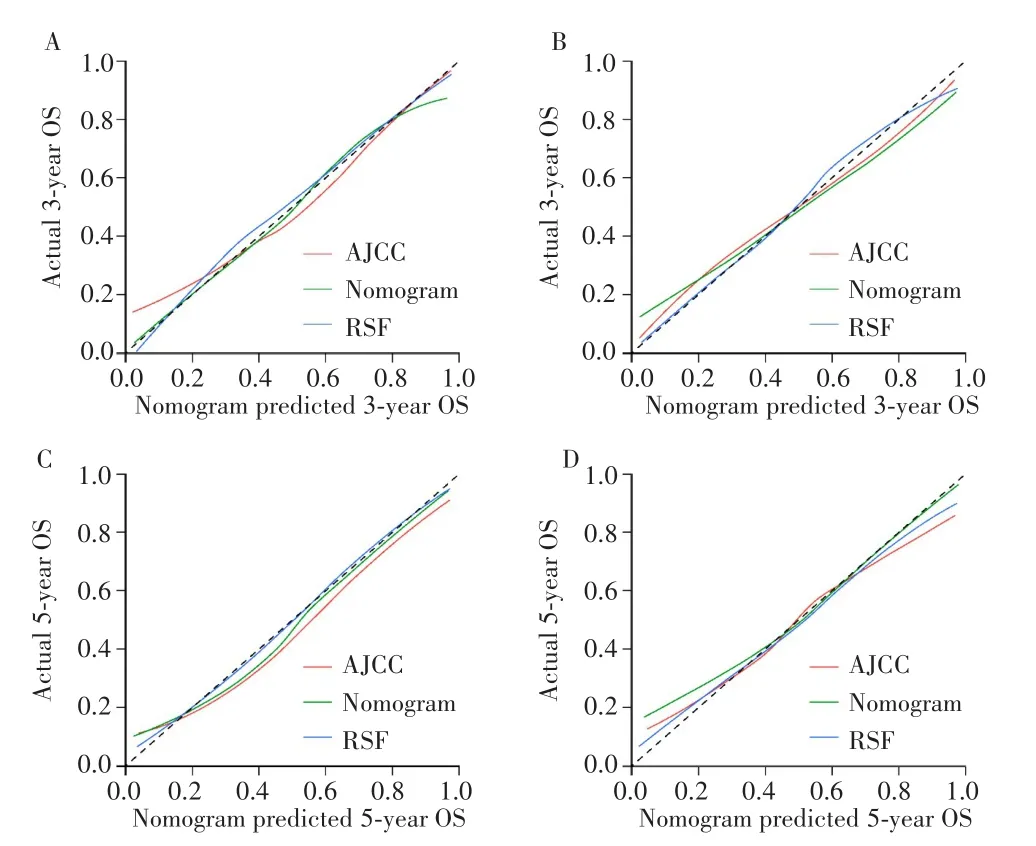
图3 局部晚期OSCC患者预测模型的校准曲线Fig.3 Calibration curves of predictive models in locally advanced OSCC patients
2.4 预测模型的DCA
各预测模型曲线与“None线”和“All线”之间的区域表示该模型的临床实用性,模型曲线离“None线”和“All线”越远,说明列线图的临床价值越好。在验证集中3年、5年的DCA显示,列线图模型的临床价值高于AJCC分期,RSF模型的临床价值高于列线图模型,见图4。

图4 验证集中预测模型的DCAFig.4 DCA for the predictive models in the validation cohort
2.5 RSF模型的危险分层能力
从ROC曲线、校准曲线以及DCA来看,RSF模型的预测效能最高,故选择该模型为最终模型构建危险分层系统。在训练集中采用RSF模型计算每个患者的风险概率,X-tile软件计算风险概率的最佳临界值,根据最佳临界值0.24、0.57将患者分为低风险组(<0.24)、中风险组(0.24~0.57)和高风险组(>0.57),且任意两组之间的生存曲线差异均有统计学意义(均P<0.001),见图5A;在验证集中亦获得相同结果,见图5B。表明RSF模型具有良好的危险分层能力。
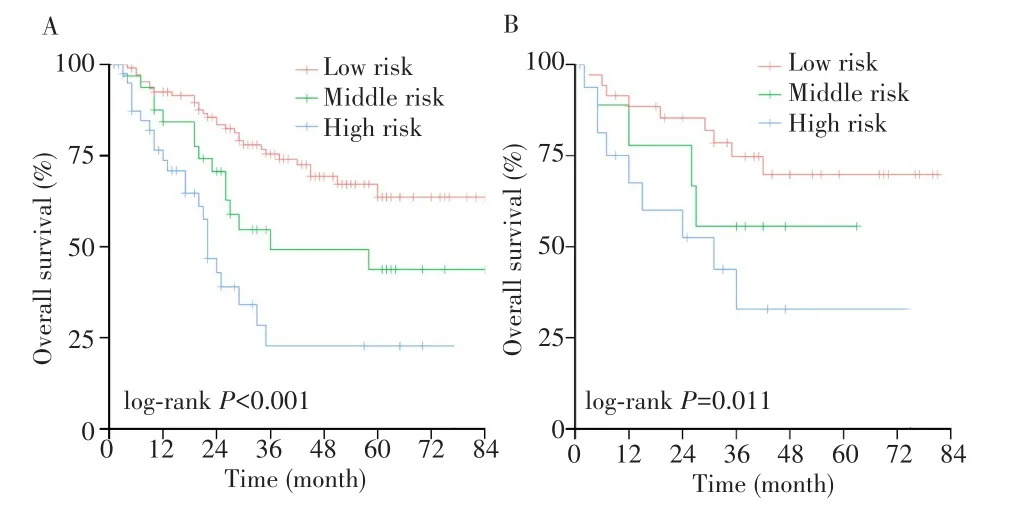
图5 RSF模型的Kaplan-Meier生存曲线和风险分层能力Fig.5 Kaplan-Meier survival curves and risk group stratification of RSF model
3 讨论
传统的TNM分期系统或单个分子生物标志物预测肿瘤患者预后的准确度有限,列线图已广泛用于临床肿瘤学的预后预测。目前已有多项研究采用列线图预测OSCC的患者生存情况[17-19]。近年来,机器学习算法在医疗保健领域的应用越来越突出,但是目前尚未研究报道用于预测局部晚期OSCC患者预后的模型。本研究尝试采用列线图、RSF模型预测局部晚期OSCC患者术后的生存情况,结果发现RSF模型在预测患者预后方面优于传统的AJCC分期以及列线图模型,且有助于对患者进行个体化风险分层,有望用于个体化疾病管理。
本研究的列线图模型、RSF模型均是基于Cox比例风险回归分析而在182例治愈性手术后局部晚期OSCC患者的训练队列中构建。首先多因素分析发现年龄、KFI指数、pT分期、pN分期、AJCC分期、阳性淋巴结数、SII均是OS的独立预测因素,然后基于这些重要的预测因素,本研究开发了预测OS的列线图以及RSF模型。RSF模型显示出良好的区分能力,在验证集中AUC分别为0.782、0.780;校准曲线亦表明RSF模型与实际生存率具有较高的一致性。此外,DCA也表明该RSF模型有较高的净临床益处。此外,基于该模型构建的危险分层系统亦能对患者进行较好区分。以上研究结果说明,本研究成功构建了可用于预测局部晚期OSCC患者预后的RSF模型,且该模型的性能优于传统的列线图模型和AJCC分期。本研究纳入的重要预后因素在临床上易于获取且经济,特别是包括新型术前全身炎症免疫生物标志物SII。但值得注意的是,越来越多的证据表明,中性粒细胞、血小板、单核细胞和淋巴细胞等炎症细胞在促进恶性细胞增殖和存活、血管生成以及转移等方面也发挥重要作用[20]。
作为一种机器学习分析工具,RSF模型更广泛地应用于临床决策。首先,RSF模型对非线性关联变量具有很强的适应性,而真实世界中的临床因素往往与结局呈现非线性关系。与其他模型不同,RSF模型可以整合与结局相关的非线性风险函数[21]。其次,RSF模型在处理复杂的临床因素方面具有灵活性,不仅可以从未解释的临床数据中自动学习特征,还可以分析删失数据[22]。最后,RSF模型在大数据分析中被证实具有更好的预测能力。由于RSF模型学习能力强,在处理多维度和大样本方面具有优势,因此在生物医学分析中将发挥越来越重要的作用[23-25]。但是,机器学习模型在改善治疗结果中的性能仍需在现实世界中进行可靠验证[26]。
本研究存在以下局限性。⑴本研究是一项回顾性研究,因此选择偏倚不可避免。⑵机器学习模型的训练和验证计算成本较高,且预测过程难以解释,但本研究的预测因素均为经Cox回归确认的独立影响因素,在一定程度上具有可解释性。⑶本研究缺乏外部验证。
综上所述,本研究构建并验证了基于临床可用特征的机器学习模型RSF,其可用于预测局部晚期OSCC患者的3年和5年OS。该模型显示出相对良好的性能和潜在的临床价值,将有助于对患者进行个体化风险分层,并有助于个体化疾病管理。
