PGRMC1在激素治疗中促进乳腺癌细胞增殖的机制研究
2022-09-07赵越阮祥燕谷牧青许新程姣姣
赵越 阮祥燕 谷牧青 许新 程姣姣
作者单位:100026 北京 首都医科大学附属北京妇产医院/北京妇幼保健院内分泌科
绝经激素治疗(menopausal hormone therapy,MHT)是解决绝经问题的最佳方案[1],但是,近年来大量研究表明激素治疗可增加乳腺癌的发生风险[2-5],如经典的妇女健康倡议(women′s health initiative,WHI)研究发现激素治疗5年后乳腺癌发生风险增加了21%[2]。因此,深入探索激素与乳腺癌发生风险的机制具有重要意义。既往研究[6]显示,激素致乳腺癌增殖与孕激素膜受体过表达密切相关。孕激素膜受体组分 1(progesterone receptor membrane components 1,PGRMC1)属于膜相关孕激素受体蛋白家族,相对分子量为22~26 kDa,是多蛋白孕酮复合物的成员之一。PGRMC1也是细胞膜上孕激素重要的特异性结合位点,且与肿瘤的生物学特性密切相关。本团队前期研究发现乳腺浸润性导管癌组织中PGRMC1阳性表达率高达70%,且其表达与乳腺癌淋巴结转移、肿瘤大小及组织学分级相关[7],提示PGRMC1可能与乳腺癌的恶性表型有关。此外,在体外及动物实验中发现,PGRMC1高表达的雌激素受体(estrogen receptor,ER)阳性乳腺癌细胞在雌孕激素联合刺激下可明显促进细胞增殖,且这种促癌作用可能与PGRMC1调控ER信号通路有关[8-9]。在此基础上,本研究进一步探索在雌孕激素联合刺激下,PGRMC1与ER信号通路抑制蛋白复合物的相互作用及其对下游ER信号通路的调控作用,为阐明PGRMC1在激素治疗中促进乳腺癌发展的分子机制提供依据。
1 材料与方法
1.1 细胞及主要试剂
人乳腺癌细胞株MCF7购自国家生物医学实验细胞资源库,接种至预先添加1×10-10moL雌二醇激素(E2758)、1×10-6moL孕烯二酮激素(P0130)的DMEM培养基,并置于37℃、5%CO2细胞培养箱中培养。胚肾细胞HEK293T购自上海研生生化试剂所。雌二醇激素(E2758)、孕烯二酮激素(P0130)购自Sigma公司,DMEM培养基、胎牛血清购自Gibco公司,CCK-8细胞增殖检测试剂盒购自碧云天生物技术有限公司,Protein G琼脂珠购自南京金斯瑞生物技术有限公司,BCA蛋白定量试剂盒、ECL免疫印迹发光底物购自Thermo公司,EDU检测试剂盒(C0075)、ER抑制因子1(PHB1)抗体(ab75766)、PGRMC1抗体(ab194879)、β-actin抗体(ab8226)、血小板凝血酶蛋白1(thrombospondin-1,THBS1)抗体(ab224054)和 GAPDH 抗体(ab8245)均购自美国Abcam公司,标签抗体Flag-tag抗体(8146)、GST-tag抗体(9101)、His-tag抗体(12698)均购自美国CST公司,ER抑制因子2(PHB2)抗体(sc-133094)购自美国Santa Cruz公司,逆转录酶、qPCR Mix均购自南京诺唯赞生物技术有限公司,空质粒(HA-Vector)、过表达PGRMC1的慢病毒质粒均购自上海吉凯基因化学技术有限公司。
1.2 细胞系构建
1.2.1 稳定过表达PGRMC1细胞系的构建 按照本课题组前期研究[8]构建方法,将PGRMC1蛋白质编码区构建到慢病毒载体PCDH中,并将空质粒(HA-vector)和过表达PGRMC1的慢病毒质粒分别转染至人胚肾细胞HEK293T中,收集细胞上清进行慢病毒浓缩。将浓缩后的慢病毒液感染MCF7细胞系,并用嘌呤霉素筛选阳性细胞,即得到稳定过表达PGRMC1细胞系(PGRMC1组)及稳定转染HA-vector(对照组)的乳腺癌细胞系。
1.2.2 稳定下调PHB复合体(PHB1和PHB2)细胞系的构建 将shPHB1序列(shPHB1-1、shPHB1-2)构建到慢病毒载体SHC201上,质粒构建均由武汉淼灵生物科技有限公司完成;用人胚肾细胞HEK293T对空质粒(shNC)及shPHB1慢病毒质粒进行包装。将浓缩后的慢病毒液感染MCF7细胞系,并用嘌呤霉素进行阳性细胞筛选,即得到稳定敲降PHB1细胞系(shPHB1-1组、shPHB1-2组)及空质粒的乳腺癌细胞系(NC组)。shPHB1序列如下:shPHB1-1正义5′-CCAGAAATCACTGTGAAATT-3′;shPHB1-2 正义 5′-CGTGGGTACAGAAACCAATT-3′。
1.2.3 敲降PHB1后稳定过表达PGRMC1细胞系的构建 将稳定过表达PGRMC1的慢病毒液感染已稳定敲降PHB1的MCF7细胞系,并用灭瘟素S进行阳性细胞筛选,即得到敲降PHB1后稳定过表达PGRMC1的细胞系。
1.3 免疫共沉淀联合质谱分析检测PGRMC1相互作用蛋白
1.3.1 检测PGRMC1相互作用蛋白PHB1/PHB2 将Flag空载质粒和Flag-PGRMC1过表达质粒(上海生工构建)分别转染MCF7细胞,转染48 h后收集细胞,用PBS清洗后,加入RIPA细胞裂解液裂解,4℃下14 000 r/min离心10 min,将上清液转移到新的离心管中,采用BCA法测定蛋白浓度。按照2 μg抗体/1 mg总蛋白的标准加入Protein G琼脂珠和4 μg抗体,4℃下过夜孵育;次日离心收集Protein G琼脂珠,用PBS清洗3次,收集蛋白并加入适量蛋白上样缓冲液,在伯乐SDS-PAGE系统上进行凝胶电泳,经考马斯亮蓝染色和脱色后,从泳道上端一直到泳道下端将凝胶切下,送至中科院生物物理所质谱中心进行质谱分析。鉴定到相互作用蛋白后,按照上述流程进行免疫共沉淀,用SDS-PAGE分离蛋白,然后用抗Flag、PHB1和PHB2抗体检测其相对表达情况。
1.3.2 检测PHB1与ER的相互作用 实验分为3组,其中第1组用HA-vector对照细胞系转染Flag空载质粒,第2组和第3组分别用HA-vector对照细胞系和过表达PGRMC1的细胞系转染Flag-PHB1。转染48 h后,收集细胞,加入RIPA细胞裂解液提取蛋白后进行免疫共沉淀,然后用抗ER和PHB1抗体检测其相对表达情况。
1.4 免疫印迹法检测PHB1、PHB2和PGRMC1的表达情况
将加入适量RIPA的细胞裂解液置于冰上充分裂解各组细胞,离心后取上清液,按照BCA法检测蛋白的浓度,根据蛋白浓度加入适量蛋白上样缓冲液,调节蛋白浓度为1 mg/mL。经SDS-PAGE电泳后将蛋白条带转印至PVDF膜上,用5%脱脂奶粉封闭1 h后,加入PGRMC1、GAPDH、PHB1、PHB2、Flag、GST、His和β-actin的一抗,4℃过夜孵育;用PBST洗膜3次,加入HRP标记的二抗,室温孵育1 h后再用PBST洗膜3次,在PVDF膜上加入适量的显影底物,在免疫印迹显影仪上显影检测目的蛋白的表达。
1.5 GST pull-down实验验证蛋白间的直接相互作用
将上海生工构建的重组PGRMC1、PHB1和PHB2质粒转化到大肠杆菌菌株BL21(DE3),并置于含100 mg/L氨苄青霉素或卡那霉素的LB培养基中培养,用酶标仪检测各组细胞600 nm波长处的光密度(OD)值,当OD值达到0.8~1.0时,添加异丙基-β-D-硫葡糖苷酶至终浓度为0.5 mmol/L,16℃诱导培养20 h后,5 000 r/min离心10 min,收集细胞。将细胞重悬于裂解缓冲液(20 mmol/L Tris,pH 8.0,400 mmol/L NaCl)中,超声裂解后,16 000 r/min 离心30 min去除沉淀,用Ni-NTA亲和柱纯化PHB1和PHB2,用谷胱甘肽琼脂糖4B树脂纯化PGRMC1;通过考马斯亮蓝染色验证重组蛋白的完整性。
将谷胱甘肽琼脂糖4B树脂珠与2 μg的GST或GST-PGRMC1融合蛋白偶联,并在4℃下与His标签的PHB1或PHB2孵育4 h,然后用PBS缓冲液洗涤4次。通过SDS-PAGE分离与偶联Flag抗体的微珠(beads)结合的蛋白,并用抗His和抗GST抗体进行免疫印迹。
1.6 CCK-8实验检测细胞增殖能力
取各组MCF7细胞分别接种至96孔板(5 000/孔)中,置于培养箱中培养过夜,每组设置5个平行。分别在24 h、48 h和72 h后向每孔中加入10 μL CCK-8溶液。以加入相应量的细胞培养物和CCK-8但未加入细胞的孔作为空白对照。各组细胞在37℃孵育1 h后,用酶标仪测定450 nm波长处的OD值。
1.7 EDU实验检测细胞增殖能力
取各组MCF7细胞分别接种至24孔板(2×104/孔)中,并置于培养箱中培养过夜,每组设置3个平行。根据EDU检测试剂盒说明书对细胞增殖进行检测,用荧光显微镜拍照记录。
1.8 流式细胞术检测细胞周期
将各组MCF7细胞分别接种至6孔板(2×105/孔)中,孵育24 h后,用胰蛋白酶消化,离心,洗涤,收集细胞并在4℃的70%乙醇中固定过夜,次日离心除去乙醇固定液。将细胞样品与含有10 mg/mL的RNase A的碘化丙啶(PI)工作溶液在37℃下继续孵育30 min,用FACScan流式细胞仪(BD C6,美国)分析样品,使用FlowJo 10.0软件保存并分析数据。
1.9 RT-qPCR检测相关因子mRNA的表达
使用Trizol试剂提取各组MCF7细胞中的总RNA,并用随机引物和MMLV逆转录酶合成cDNA的第一条链,使用CFX96实时荧光定量PCR系统(Bio-Rad)进行RT-qPCR反应分析。PCR反应条件:预变性95℃2 min;变性95℃30 s;退火58℃30 s;延伸72℃ 30 s。引物序列:GAPDH正义5′-GAAGGTGAAGGTCGGAGTC-3′,反义5´-GAAGATGGTGATGGGATTTC-3′;PHB1正义 5′-GACCACGTAATGTGCCAGTC-3′,反义 5′-GCACACGCTCATCATAGTCC-3′;PHB2 正义 5′-GTTGTCTCGACCCAATGCTC-3′,反义5′-CACTCTTGAGCACCTCGTTG-3′;THBS1 正义 5′-GCTCTACCAGTGTCCTCCTC-3′,反义 5′-TGGCTTGCAAGTCCTTTGTC-3′;趋化因子配体 12(C-X-C chemokine ligand 12,CXCL12)正义5′-ATGAACGCCAAGGTCGTGG-3′,反义 5´-AAGTGGATTCAGGAGTACC-3′;乳腺癌雌激素调控基因1(growth regulation by estrogen in breast cancer 1,GREB1)正义 5′-ACGTGCTACCAGAATTCCCA-3′,反义 5′-TAGACGGTAAGCAGGAGCTG-3′。以GAPDH为内参,并通过2-ΔΔCt法计算目的基因的相对表达水平。每个样品重复测量3次。
1.10 统计学方法
采用SPSS 21.0统计软件进行数据分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析。两两比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PGRMC1与PHB1/PHB2存在直接相互作用关系
通过免疫共沉淀纯化Flag-PGRMC1,再利用质谱鉴定技术分析,结果显示PHB1和PHB2均存在于Flag-PGRMC1的免疫共沉淀组分中,见图1A。通过质谱分析鉴定免疫共沉淀产物并进行数据库检索,结果在MCF7细胞中共鉴定到463种编码的蛋白质;进一步采用免疫共沉淀技术验证质谱分析结果,发现在Flag-PGRMC1组分中也检测到PHB1和PHB2信号,见图1B。在体外条件下进行GST pull-down实验,结果显示,在无其他蛋白因子干扰情况下,PGRMC1与PHB1和PHB2之间存在直接相互作用关系,见图1C。

图1 PGRMC1与PHB1和PHB2相互作用的鉴定Fig.1 Identification of PGRMC1 interaction with PHB1 and PHB2
2.2 过表达PGRMC1在雌孕激素刺激下促进乳腺癌细胞周期进程及细胞增殖
MCF7细胞经雌孕激素联合刺激后,免疫印迹和RT-qPCR检测结果显示,PGRMC1组中PGRMC1 mRNA和蛋白的表达水平均显著高于对照组(均P<0.01),表明成功构建稳定过表达PGRMC1的MCF7细胞系,见图2A~B。CCK-8检测结果显示,PGRMC1组细胞增殖速度较对照组明显加快(均P<0.05),见图2C;EDU染色实验显示PGRMC1组中EDU标记的阳性细胞明显多于对照组(P<0.01),见图2D。流式细胞术检测结果显示,与对照组相比,PGRMC1组细胞周期中的S期和G2/M期阳性细胞比例均明显增加(均P<0.05),G0/G1期阳性细胞分布明显降低(P<0.01),见图2E。RT-qPCR检测结果显示,PGRMC1过表达后MCF7细胞中ER信号通路下游靶基因THBS1、CXCL12和GREB1的表达水平均较对照组明显升高(均P<0.01),见图2F。提示在雌孕激素联合作用下,PGRMC1过表达可能通过促进有丝分裂进程促进细胞增殖。
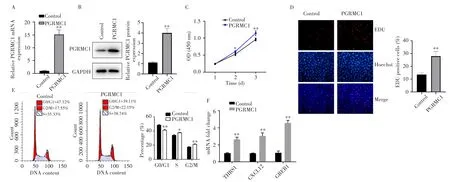
图2 雌孕激素刺激下过表达PGRMC1可促进乳腺癌细胞周期进程及细胞增殖Fig.2 Overexpression PGRMC1 promoted cell cycle progression and proliferation in breast cancer during hormone stimulation
2.3 PGRMC1通过PHB复合体调控ER下游信号通路
免疫印迹和RT-qPCR检测结果显示,两种shPHB1慢病毒侵染MCF7细胞后,PHB1的mRNA和蛋白表达水平均较NC组显著降低(均P<0.01),表明成功构建稳定下调PHB复合体的MCF7细胞系,见图3A~B。CCK-8检测结果显示,下调PHB1可促进MCF7细胞增殖(P<0.01),见图3C。EDU染色实验同样显示,下调PHB1后EDU标记的阳性细胞明显多于NC组(P<0.001),见图3D。流式细胞术检测结果也显示,与NC组相比,下调PHB1后MCF7细胞周期中S期和G2/M期阳性细胞比例均明显增加(均P<0.05);而下调PHB1后再过表达PGRMC1,细胞周期中S期和G2/M期阳性细胞比例与单独下调PHB1比较差异均无统计学意义(均P>0.05),见图3E,提示PGRMC1可能通过PHB1复合体调控细胞周期。RT-qPCR检测结果显示,下调PHB1可促进ER信号通路下游靶基因THBS1、CXCL12和GREB1的表达(均P<0.01),见图3F。免疫共沉淀实验结果显示,PGRMC1过表达后MCF7细胞中PHB1与ER的相互作用减弱,见图3G。以上实验结果表明,PGRMC1可能通过PHB复合体调控ER下游信号通路从而促进乳腺癌细胞增殖。

图3 PGRMC1通过PHB复合体调控ER下游信号通路Fig.3 PGRMC1 regulated ER downstream signaling through PHB complex
3 讨论
MHT中最重要的安全问题是乳腺癌风险[10]。乳腺癌的发生、发展、转移与细胞内的信号通路密切相关,其中ER信号通路在乳腺癌细胞内的直接或交互作用尤为重要[11-12]。已知PGRMC1介导的P450代谢途径可参与调节雌孕激素的代谢与合成,其中参与激素合成的羟化酶及芳香化酶都属于P450基因家族[13]。因此推测,PGRMC1可能参与雌激素合成及信号转导。本课题组前期的体内外实验[8,11,14]均显示了雌激素联合孕激素对PGRMC1高表达的ER阳性乳腺癌细胞增殖的协同效应,而且这种增殖作用可被ER拮抗剂完全阻断,提示PGRMC1可在体内外增强雌激素的信号转导。CAHILL等[15]也报道在PGRMC1高表达的ER阳性乳腺癌细胞中添加雌孕激素可明显促进细胞增殖。临床研究也发现乳腺癌组织中PGRMC1表达与ER表达呈高度正相关[16-17]。本研究也发现PGRMC1过表达在雌孕激素作用下不仅能明显促进乳腺癌细胞周期进程及细胞增殖,还能促进ER信号通路下游靶基因THBS1、CXCL12和GREB1的表达,再次印证了上述研究观点,提示PGRMC1可能通过促进ER信号通路下游靶基因的表达,从而加速激素刺激条件下乳腺癌细胞的恶性增殖。
既往研究[17]显示ER与ER抑制因子(PHB1/PHB2)结合可抑制ER下游信号通路传导,从而阻断乳腺癌细胞增殖,因此推测PHB1和PHB2可能是PGRMC1的潜在相互作用对象。为了印证这一假设,本研究首先采用免疫沉淀结合质谱分析筛选相互作用的蛋白,结果发现PHB1和PHB2均存在于PGRMC1共沉淀的复合体中,进一步的GST pull-down实验证实在排除其他蛋白因子干扰下,PGRMC1和ER信号通路抑制因子PHB1和PHB2之间存在直接相互作用的关系。同时,为了进一步验证PGRMC1对ER阳性乳腺癌细胞的促进作用是否依赖于PGRMC1与PHB1和PHB2的相互作用,本研究在ER阳性MCF7细胞中通过RNA干扰技术下调PHB1表达,并观察其对细胞增殖、细胞周期等的影响,结果发现下调PHB1可促进乳腺癌细胞增殖,并激活ER信号通路下游靶基因THBS1、CXCL12、GREB1的表达,同时过表达PGRMC1后细胞的有丝分裂进程并未明显加速。此外,免疫共沉淀检测还发现在PGRMC1过表达细胞中PHB1与ER的相互作用明显减弱,说明PGRMC1可能通过PHB复合体调控ER下游信号通路,进而促进乳腺癌细胞增殖。
综上所述,本研究初步探索了激素与PGRMC1结合诱导乳腺癌细胞增殖的分子机制,初步证实PGRMC1可通过与PHB复合体结合,解除后者对ER信号通路的抑制作用,从而促进ER信号通路的活化及其下游靶基因的表达,最终加速乳腺癌细胞增殖。但本研究的体外实验培养时间较短,无法完全反映体内激素治疗的长期过程,此外PGRMC1协同激素促进乳腺癌细胞增殖确切的作用机制仍需在动物实验研究中进一步证实。
