CEUS在肝细胞肝癌局部热消融疗效评估中的临床应用价值
2022-09-07刘凌晓陈荣新包静文陈彦玲王文平
王 坤,董 怡,刘凌晓,陈荣新,包静文,陈彦玲,王文平
1.复旦大学附属中山医院超声科,上海 200032;
2.复旦大学附属中山医院介入治疗科,上海 200032;
3.复旦大学附属中山医院肝肿瘤内科,上海 200032
肝癌是临床上比较常见的恶性肿瘤,分为原发性肝癌与继发性肝癌两大类。原发性肝癌为中国第4位常见恶性肿瘤,其发病隐匿,早期症状及体征无明显特异性,病程相对较短,恶性程度较高,早期就可能发生转移,主要病理学类型为肝细胞肝癌(hepatocellular carcinoma,HCC)。手术切除是HCC常用的治疗手段,但是临床上大部分患者有肝实质的病变,导致肝脏储备功能的不足,另外肝癌的多中心性发生、术后容易复发等,使得手术切除治疗方式有着较大的局限性[1-2]。近几年来,微波、射频、激光、冷冻等微创治疗技术广泛应用于肝癌的临床治疗中,应用比较广泛的为射频及微波消融[3]。研究[4]显示,随着肝脏肿瘤直径的增大,消融治疗很难将目标肿瘤完全包括在消融范围内,会出现肿瘤消融不彻底的现象。早期及时发现肿瘤残余病灶并进行补充消融治疗可提高患者的生存率[5]。目前临床上评价肝癌热消融治疗的参考标准为增强磁共振成像(magnetic resonance imaging,MRI)或计算机体层成像(computed tomography,CT),但CT及MRI检查存在不足之处,如CT检查有辐射、MRI检查时间长、受患者体内金属异物的影响等。超声造影(contrast-enhanced ultrasound,CEUS)因具有较高的诊断准确度在临床上得到了广泛应用,其对消融范围及消融效果的评估均具有良好的效果[6]。本研究对CEUS在HCC热消融治疗后评估中的临床应用价值进行探讨。
1 资料和方法
1.1 一般资料
前瞻性收集2021年5—11月于复旦大学附属中山医院肝肿瘤内科及介入治疗科行热消融的44例HCC患者。其中,男性35例,女性9例;年龄32~79岁,平均年龄(56.2±12.3)岁;肿瘤最大径9~42 mm,平均(18.1±7.6)mm;Child-Pugh分级A级36例,B级8例。所有患者经病理学检查或两种以上影像学检查(增强CT、增强MRI或CEUS)证实。本研究经医院伦理委员会批准。纳入标准:① 肝内病灶数≤3个,肿瘤最大径≤3 cm;单发肿瘤最大径≤5 cm;② 年龄18~80岁,无严重的心血管或呼吸系统疾病;③血小板计数>50×109/L;④ 临床资料齐全。排除标准:① 肝功能Child-Pugh分级C级;② 门静脉癌栓;③ 肝外脏器转移;④ 肿瘤数目>3个;⑤ 单发肿瘤最大径>5 cm;⑥ 凝血功能障碍;⑥ 严重心、脑、肺、肾等脏器功能衰竭。
1.2 方法
热消融术前对患者的全身状况及肝内病灶情况进行评估,包括血常规、出凝血时间、肝功能、肾功能、肿瘤标志物[甲胎蛋白(α-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)19-9]。行CEUS、增强CT或增强MRI明确肿瘤位置、病灶数目、病灶大小等情况。超声引导穿刺成功后,采用射频消融仪或微波消融仪对患者行热消融治疗。热消融术后1个月行CEUS及钆塞酸二钠(Gd-EOBDTPA)增强MRI检查,并随访记录患者血常规、肝肾功能及肿瘤标志物的检查结果。
1.3 观察指标
术后1个月以Gd-EOB-DTPA增强MRI检查为标准,分析CEUS检查评估HCC热消融后疗效的准确度。评估病灶热消融治疗后的灭活情况,完全消融:病灶未见明显增强;不完全消融:治疗后的病灶增强范围减小,部分有增强;无变化:病灶治疗前后的强化方式无明显变化。
1.4 统计学处理
采用SPSS 22.0软件进行统计学分析。计量资料符合正态分布,用±s表示,两组间比较采用配对样本t检验或独立样本t检验;计数资料以百分数表示,样本率比较采用χ2检验(McNemar检验)。一致性检验采用Kappa检验。P<0.05为差异有统计学意义。
2 结 果
2.1 HCC患者热消融术后病灶的CEUS变化
44例HCC患者热消融术后灰阶超声图像显示多为稍高回声不均质团块,后方回声轻度衰减,CEUS提示41例完全消融,CEUS表现为热消融病灶内未见造影剂进入,消融灶周边未见不规则结节样强化(图1),3例不完全消融,CEUS表现为消融灶边缘不规则结节样强化影(图2)。

图1 典型病例1[患者,男性,36岁,AFP(-),乙肝病史]灰阶超声及CEUS图像
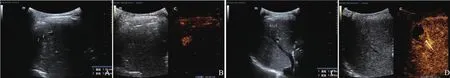
图2 典型病例2[患者,男性,57岁,AFP(-),乙肝病史]灰阶超声及CEUS图像
2.2 HCC患者热消融前后AFP及CEUS评价病灶大小情况比较
44例患者热消融治疗后1个月AFP值明显降低,与术前AFP相比差异有统计学意义(P=0.002),热消融术前CEUS评价病灶最大径均值为17.4 mm,热消融术后病灶最大径均值为29.0 mm,治疗前后病灶最大径比较差异有统计学意义(P=0.000,表1)。
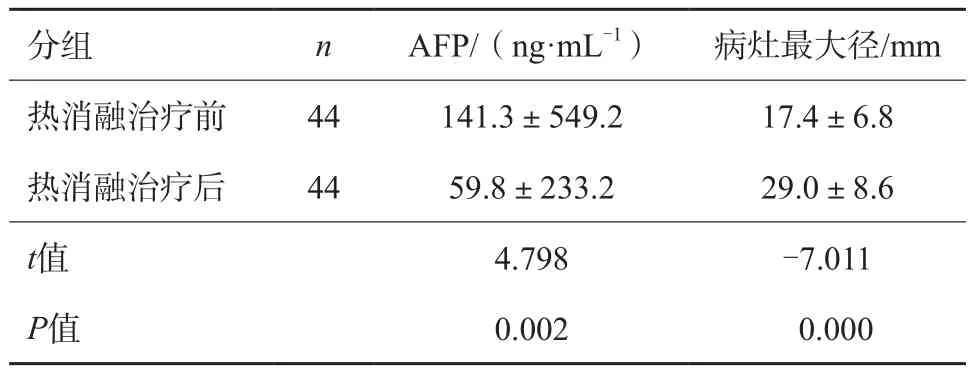
表1 热消融前后AFP水平及CEUS评价病灶大小情况比较
2.3 Gd-EOB-DTPA增强MRI、CEUS评估HCC患者热消融后病灶大小情况比较
热消融术后CEUS评价病灶最大径均值为29.0 mm,Gd-EOB-DTPA增强MRI评估病灶最大径均值为28.6 mm,两种影像学评价治疗后病灶最大径差异无统计学意义(P=0.574,表2)。

表2 热消融治疗后CEUS、Gd-EOB-DTPA增强MRI评价病灶大小情况比较
2.4 Gd-EOB-DTPA增强MRI、CEUS对病灶热消融情况评估的对比分析
热消融治疗后1个月,对患者进行Gd-EOBDTPA增强MRI和CEUS检查,经Gd-EOB-DTPA增强MRI提示病灶完全消融40例,不完全消融4例,经CEUS检查提示病灶完全消融41例,不完全消融3例;一致性检验,Kappa约为1,P=0.000,说明两种影像学检查方法评估热消融存在一致性;以Gd-EOB-DTPA增强MRI检查为标准,CEUS诊断的灵敏度为75.0%,特异度为100%,准确度为97.7%,对比CEUS与Gd-EOBDTPA增强MRI两组数据,差异无统计学意义(χ2=0.320,P>0.05,表3)。

表3 CEUS评估热消融的价值
3 讨 论
外科手术治疗是肝癌患者首选的治疗方式,但是大多数患者就诊时期比较晚,已失去最佳手术时机,另有部分患者因肝脏功能不全或伴有其他基础疾病不能耐受手术。肝癌术后复发的概率较高。热消融作为局部微创治疗方法在肝癌的治疗中受到了广泛的重视,热消融在早期肝癌治疗方面已经可以作为手术切除的替代疗法,对于直径<5 cm的肿瘤,有90%的消融成功率,其预后与手术效果相当[7]。本研究发现,肝癌患者热消融治疗后AFP较术前明显降低,44例热消融患者术后仅1例出现右侧胸腔积液,未出现其他并发症。
影响肝癌热消融疗效的主要原因为病灶消融不完全或者病灶局部又复发,决定热消融治疗是否成功的关键在于该肿瘤组织的彻底灭活,病灶热消融治疗不彻底时需要再次行热消融治疗以彻底灭活病灶[8]。肝癌患者热消融治疗后准确评价其消融治疗的效果,并及时发现残余病灶及局部复发病灶,对这些病灶进行补充治疗能够提高热消融的治疗效果[9]。因此在临床工作中迫切需要一种能够及时并且较为准确地评价病灶消融情况的影像学检查方法,早期发现消融不全病灶及早期局部复发病灶,能够有效地改善患者的预后,延长患者的生存期。
目前临床上较为常用的评价肝癌热消融疗效的方法是增强CT及增强MRI,而且增强MRI的作用更为明显,是目前国内外评估肝癌患者热消融治疗效果的主要依据[10]。研究[11]显示,增强MRI诊断准确度能够达到91.5%,肿瘤消融区域未见明显增强提示病灶消融彻底,其病理学基础为热消融完全的病灶内部无血供和凝固性坏死。这两种影像学检查手段在临床应用中也受到一定程度的限制,如CT检查有辐射,MRI检查时间较长,对于装有心脏起搏器、血管支架等的患者检查受限。临床上比较常用的热消融治疗后的随访手段为超声检查,通过观察病灶大小的变化情况、病灶边界、病灶血流情况评估消融是否彻底,但是有研究[12]指出,传统超声检查在评估肿瘤消融术后的疗效方面存在局限性,不能够全面准确地反映肿瘤的坏死程度及灭活情况,诊断准确度不高。
CEUS是目前临床应用比较广泛的一种影像学检查技术,其在肝脏疾病诊断及鉴别诊断中的应用越来越广泛[13]。相关研究[14-15]显示,CEUS能够对肿瘤部位的微循环血流信息进行准确评价,能够实时动态地观察肿瘤的强化过程,应用于肝脏局灶性病变的诊断及鉴别诊断,CEUS也可以应用于肝肿瘤介入微创治疗的定位指导及术后随访。HCC患者热消融治疗后疗效与病灶是否彻底灭活密切相关,因此要求术中消融的范围要比病灶本身略大(0.5~1.0 cm)。CEUS可以直观实时显示病灶内血流灌注情况,与传统的超声相比较,能够有效地检出消融后的残留病灶,通过观察病灶的血流灌注情况的变化对消融疗效进行评价[16]。本研究显示,消融术后病灶的大小较术前增大,符合热消融治疗过程中消融范围的原则,肝癌病灶热消融坏死区域术后1个月常规超声检查表现为稍高回声不均质团块,多伴有后方回声的轻度衰减,CEUS表现为消融病灶未见超声造影剂充填,消融不全病灶可在病灶周边见局灶性结节状造影剂充填强化表现。
MRI空间分辨率和时间分辨率比较高,能清晰地显示肿瘤的病理学改变及血液供应情况,其对于热消融疗效的效果评价良好[17]。Gd-EOBDTPA增强MRI能够提高小肝癌尤其是直径≤1.0 cm的肝癌的检出率。本研究应用Gd-EOBDTPA增强MRI对热消融术后疗效进行评估,44例患者发现4例不完全消融;以Gd-EOB-DTPA增强MRI为金标准,评价CEUS评估热消融疗效的价值,结果显示,CEUS发现3例不完全消融灶,漏诊1例,两种影像学检查结果比较,差异无统计学意义(P>0.05),CEUS与Gd-EOBDTPA增强MRI检查的符合率较高,以Gd-EOBDTPA增强MRI为标准,CEUS诊断的准确度、灵敏度及特异度分别为97.7%、75.0%、100.0%,在肝癌局部热消融术后疗效评价中,CEUS与增强MRI作用基本相同,CEUS同样可以较准确地判断肝癌病灶热消融后是否彻底灭活、是否存在残留及复发情况,可以成为肝癌局部热消融治疗早期随访的重要检查手段。本研究中CEUS漏诊1例,考虑原因为该病灶位置较高,不完全消融部分受肺气干扰及患者呼吸动度影响显示不清。
综上所述,肝癌局部热消融疗效评价中,CEUS与增强MRI检查效果基本相同,CEUS可以较准确地判断肝癌局部热消融后是否消融彻底及复发情况,可以作为评估热消融疗效的有效方法,并可成为热消融术后早期随访的影像学检查手段。
