抗癌中药活性成分毛兰素衍生物18F-FEE的18F标记及其体内性质MicroPET/CT评价
2022-09-07张丰盛张勇平宋少莉王明伟
王 撵 ,张丰盛 ,张勇平, ,宋少莉, ,杨 红,王明伟,
1.上海师范大学化学与材料科学学院,上海 200234;
2.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
3.复旦大学生物医学影像研究中心,上海 200032;
4.上海分子影像探针工程技术研究中心,上海 200032
中医药在抗肿瘤和抗病毒等方面历史悠久,为了应对肿瘤和新型病毒对人类健康的威胁,中药活性成分一直是新药研发和创制的重要来源之一[1-2]。毛兰素是名贵中药材石斛的主要活性成分之一,它和其衍生物具有明显的抗肿瘤活性,已经成为抗癌药物的重要研究方向[3-6]。Zhao等[7]设计合成了多种毛兰素衍生物,发现其在体外对多种肿瘤细胞具有较强的抗增殖活性,比如乙氧基毛兰素(ethoxylerianin,EBT)。Lam等[8]报道了一种毛兰素衍生物ZJU-6,具有较强的抗增殖、促凋亡和抗血管生成的作用。然而,目前毛兰素等中药活性成分及其衍生物的作用评价主要为体外细胞毒性实验,较少开展进一步的体内分布等药代学评价。
传统上,同位素标记示踪技术常被用于开展药物代谢等体内药代学研究。随着核医学分子影像,特别是正电子发射体层成像(positron emission tomography,PET)/计算机体层成像(computed tomography,CT)的发展,正电子核素标记和PET/CT的联合应用已经成为现代新药评价的最为有力的先进技术[9-10]。由于核素18F具有理想的物理和化学特性,如较长的半衰期(t1/2=109.7 min),其对应同位素氟(19F)又是-OH等多种基团的电子等排体,而且很多药物分子结构本身含有氟原子,从化学分子结构上和18F标记物完全就是同一个化合物,因此18F标记和PET/CT就成为候选新药体内效果评价的理想方式和发展趋势[11-13]。
为了更好、更快地评价基于中药活性成分衍生物的潜在抗肿瘤候选新药,本文利用18F标记和PET/CT的现代先进技术,以具有抗肿瘤性质的毛兰素衍生物氟乙氧基毛兰素(fluoroethoxylerianin,FEE)为目标,开展其对应的18F标记化合物18F-FEE的合成条件优化,并用小动物PET/CT进行可视化研究观察其在正常小鼠与HepG2移植瘤模型的体内分布,为揭示FEE的体内药代学特征提供直观的参考。
1 资料和方法
1.1 主要仪器与试剂
仪器:采用德国Siemens公司的医用回旋加速器Eclipse和小动物MicroPET/CT Inveon,美国Agilent公司的分析型HPLC 1200系列,配有可变波长紫外检测器、Zorbax 300SB-C18分析柱(4.6×250 mm,5 µm),美国Capintec公司的放射性活度计CRC®-15PET,上海日环仪器设备有限公司的γ放射性免疫计数仪SN-697型,德国Raytest公司的放射性检测器Gabi Star和放射性薄层色谱扫描仪miniGita Star,上海力辰邦西仪器科技有限公司的三用紫外分析仪ZF-1,杭州米欧仪器有限公司的恒温金属浴DKT200-1。
试剂:标记前体2-甲氧基甲氧基-甲苯磺酸-乙氧基-毛兰素(2-methoxymethoxytolsylethoxylerianin,MMEE)、对照品19F-FEE(纯度>95%)是由上海应用技术大学吴范宏教授惠赠。K222(Kryptofix 222)、无水乙腈和无水碳酸钾为美国Sigma-Aldrich公司产品;HPLC/光谱纯乙腈为美国Tedia公司产品;N,N-二甲基甲酰胺(DMF,99.8%)、乙腈(99.9%)、二甲基亚砜(DMSO,99.7%)购自瑞士Adamas-Beta公司。
肿瘤细胞和模型:人肝癌细胞系HepG2购自于中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,使用含10%FBS(美国Gibco公司)、1%谷氨酰胺、1%非必需氨基酸和1%丙酮酸钠的MEM培养基,在CO2体积分数为5%的37 ℃潮湿环境下进行培养。实验中所用到的5周龄BALB/c正常小鼠与裸小鼠均购自于上海灵畅生物科技有限公司,将处于对数增长期的HepG2细胞经消化离心处理后,溶解于磷酸盐缓冲生理盐水(phosphate buffer saline,PBS)中,取0.1 mL(1×107个细胞)细胞悬液,注射在裸小鼠前肢腋窝皮下。待肿瘤生长至0.5~1.0 cm时,便可用于动物实验。
1.2 18F-FEE的放射化学合成条件优化
18F-FEE的放射化学合成路线如图1所示。参考文献[14]制备活化的18F-离子,经无水乙腈溶解后用于条件优化实验。取一定量的18F-与前体MMEE溶液混合,置于恒温金属浴中加热进行18F标记反应。达到反应时间后停止加热,冷却至室温,取样,用放射性薄层色谱法(radio-TLC)分析标记率,所用展开剂为乙酸乙酯/环己烷(V/V 1/4)。然后加入HCl溶液,加热进行水解反应,达到反应时间后,进行取样和radio-TLC分析,测量水解效率。
图1 18F-FEE的放射化学合成与条件优化
为了优化18F-FEE的制备条件,本文针对标记反应和水解反应的多个实验参数,分别设计了一系列条件实验。对于第一步标记反应,考察标记率的影响因素包括时间、温度、前体浓度与溶剂,对于第二步水解反应,考察水解效率的影响因素包括HCl浓度、时间与温度。
1.3 18F-FEE的放射化学分析
根据优化的放射化学合成条件,制备18F-FEE,用于后续实验。为了分析18F-FEE的放射化学纯度,本文采取了radio-TLC和放射性高效液相色谱法(radio-HPLC)两种方法。对于radio-TLC分析,采用GF254硅胶板,展开剂为乙酸乙酯/环己烷(V/V 1/4)。对于radio-HPLC分析,流动相为水(含0.1%三氟乙酸,A)和乙腈(B)的混合液,其浓度梯度为0~10 min由50%A+50%B线性变为30%A+70%B,到15 min时逐渐变为10%A+90%B,直到20 min变为50%A+50%B。同时,采取同样的方法,分别分析参考品19F-FEE的TLC和HPLC,对其18F-FEE结果进行验证。
1.4 生物分布
通过尾静脉将18F-FEE溶液(3.7×106Bq,200 μL)注射到BALB/c小鼠体内,在注射后2、10、30、60 min等4个时间点(n=3),采取脱颈方式处死小鼠,解剖并获取心、肝、脾、肺、肾、膀胱、肌肉、骨、脑、血液等,然后称重,并用γ计数仪测量组织放射性,计算每克组织百分注射剂量率(%ID/g)。
1.5 MicroPET/CT
通过尾静脉将18F-FEE溶液[(3.7~11.1)×106Bq,200 μL]注射到正常BALB/c小鼠和HepG2移植瘤模型小鼠体内(n=3),于注射后30、60、90 min进行MicroPET/CT,勾画感兴趣区,计算肿瘤和心、肝等主要器官的%ID/g和对应的肿瘤-肌肉比值(T/M)。
1.6 统计学处理
2 结 果
2.1 18F标记反应的条件优化
2.1.1 反应时间对标记率的影响
将前体M M E E乙腈溶液(0.1 m L,20 mg/mL)与活化的18F-溶液(0.1 mL)在玻璃反应瓶内混合均匀,在反应温度为120 ℃时分别反应10、20、30 min。反应时间对标记率的影响如图2A所示,10 min时标记率已经接近90%,随时间延长仅略有增加,并且20和30 min的标记率与10 min的差异无统计学意义。因此,综合考虑18F衰变和标记率,优化的标记反应时间是10 min。
2.1.2 反应温度对标记率的影响
前体MMEE溶液与18F-溶液的组成和用量同上2.1.1,在100、120和140 ℃均反应10 min(上述优化的标记反应时间)。反应温度对标记率的影响结果如图2B所示,100 ℃时标记率为93%,而120 ℃时为92%,140 ℃时只有88%。由此可见,随着温度升高,标记率并未呈升高趋势,同时三者之间差异无统计学意义。因此,综合考虑标记率和高温安全性,优化的标记反应温度是100 ℃。
2.1.3 前体浓度对标记率的影响
前体MMEE溶液与18F-溶液的组成和总体积同上2.1.1,加入一定量MMEE,使前体浓度分别为5、10和20 mg/mL,均在100 ℃下反应10 min(上述优化的时间和温度),考察前体浓度对标记率的影响。如图2C所示,前体浓度为5、10 mg/mL时标记率均为92%,而浓度为20 mg/mL时为86%。由此可知,增大前体浓度,标记率并没有明显增加,同时三者之间差异无统计学意义(P>0.05)。因此,综合考虑标记率和节约前体用量,优化的前体反应浓度为5 mg/mL。
2.1.4 反应溶剂对标记率的影响
分别配制前体MMEE的乙腈、DMF和DMSO溶液(20 mg/mL),各取0.1 mL与活化的18F-溶液(0.1 mL)在玻璃反应瓶内混合均匀(需要指出的是,此处反应体系前体的实际浓度为10 mg/mL,与上述2.1.1和2.1.2保持一致),均在100 ℃反应10 min(上述优化的温度和时间),从而探究反应溶剂对标记率的影响。如图2D所示,反应溶剂对标记率的影响比较明显,溶剂为无水乙腈时标记率最高(93%),而DMF和DMSO为溶剂时标记率分别为86%和71%。因此,综合考虑标记率和溶剂的低沸点和易挥发性等有利特性,优化的反应溶剂为无水乙腈。

图2 不同反应条件对标记率的影响
2.2 水解反应的条件优化
2.2.1 反应时间对水解效率的影响
将标记反应混合液(0.1 mL)与HCl溶液(0.1 mL,6 mol/L)在玻璃反应瓶中混合均匀,在100 ℃下分别反应10、15、20 min,探究反应时间对水解效率的影响。如图3A所示,反应时间为10 min时水解效率在38%,15、20 min时为48%,然而三者之间差异无统计学意义(P>0.05),即延长反应时间对水解效率并没有显著影响。因此,综合考虑18F衰变和水解效率,优化的水解反应时间为10 min。
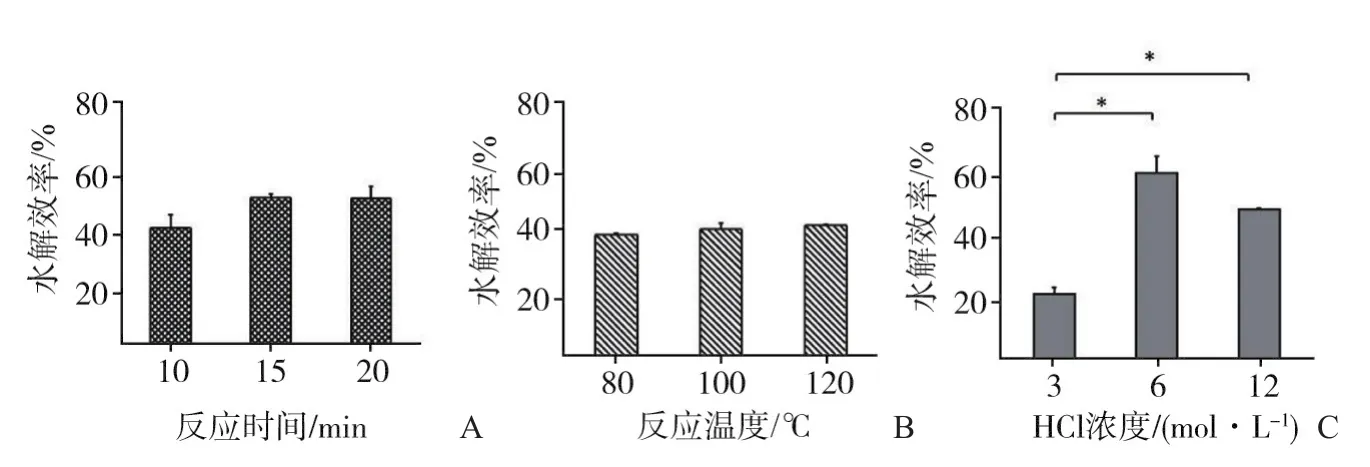
图3 不同反应条件对水解效率的影响
2.2.2 反应温度对水解效率的影响
标记反应混合液与HCl溶液的体积和组成同2.2.1,在80、100、120 ℃下均反应为10 min(上述的优化时间),考察反应温度对水解效率的影响。如图3B所示,3种反应温度的水解效率分别为38%、40%、41%,统计分析发现,80与120 ℃之间的水解效率差异有统计学意义,而100与120 ℃之间的差异无统计学意义。因此,综合考虑水解效率和高温安全性,优化的水解反应温度为100 ℃。
2.2.3 HCl浓度对水解效率的影响
取标记反应混合液(0.1 mL),吹干后分别加入不同浓度(3、6、12 mol/L)的HCl溶液(0.1 mL),均在100 ℃反应10 min(上述优化的时间和温度),考查HCl浓度对水解效率的影响。如图3C所示,HCl浓度为6 mol/L时的水解效率最高(61%),而3和12 mol/L时的水解效率分别为22%和49%。因此,综合考虑水解效率和高浓度HCl的挥发性,优化的HCl浓度为6 mol/L。
2.3 18F-FEE放射化学纯度及分析
根据上述标记反应和水解反应的优化条件,成功制备了18F-FEE。图4A是18F-FEE的radio-TLC谱图,与参考品19F-FEE的比移值(Rf)一样(图4B,Rf值为0.4)。图4C是18F-FEE的radio-HPLC谱图,其保留时间(tR)=6.8 min,与参照物19F-FEE的保留时间匹配(tR=6 min)。根据18F-FEE的radio-TLC和Radio-HPLC图谱可知,18F-FEE的放射化学纯度大于95%以上,确保能够用于后续体内试验。

图4 18F-FEE的放射化学分析
2.4 18F-FEE的体内生物分布
18F-FEE的正常小鼠体内生物分布如表1所示。注射后2 min,18F-FEE在心、肝、肺、肾等的%ID/g都到达最大值,然后从2 min到10 min再到30 min均在较大幅度地快速降低,而从30 min到60 min的降低幅度则较小。由表1可知,肝脏是18F-FEE的最主要分布组织,在所有时间点肝脏的%ID/g均最高,其次是肾脏,说明肝胆和泌尿系统均为18F-FEE的排泄途径。同时,注射后60 min,18F-FEE在心脏和血液中的%ID/g分别为0.94±0.14和1.21±0.30,说明其血液系统的循环时间较长,其肺、肌肉等组织分布时间较长,这也是注射30 min后主要脏器%ID/g降幅较小的原因。因此,18F-FEE在主要器官均呈现快速的吸收和分布特征、先快后慢的清除特征。

表1 18F-FEE的正常小鼠体内生物分布
2.5 18F-FEE的体内MicroPET/CT
为了更加直观连续观察18F-FEE的体内分布性质,本文开展了注射后不同时间点18F-FEE的正常小鼠与HepG2肝癌移植瘤模型MicroPET/CT,分别如图5、6所示。根据正常小鼠MicroPET/CT可知(图5A),在注射后30、60和90 min,18F-FEE在小鼠体内主要分布于肠道和膀胱,说明其经肝-肠和泌尿双通道进行药物代谢,与上述生物分布结果一致。为了进一步直接观察比较18F-FEE在代表性脏器中的分布,图5B是对应的定量值%ID/gmean。对比分析发现,在注射后的每个时间段,18F-FEE的心脏分布较低,肝脏与肾脏的较高,肠道和膀胱最高。随着时间延长,18F-FEE在肝脏和肾脏等主要组织的%ID/gmean都呈下降趋势,注射后30 min时肝、肾的%ID/g分别为4.1±0.38、3.1±0.57,90 min时分别降到了1.8±0.09、1.1±0.35。值得注意的是,18F-FEE的肠道停留时间较长,积累较多,30 min时肠道%ID/g为69.0±32.0,而90 min时仍达59.8±19.7。

图5 18F-FEE的正常小鼠体内MicroPET/CT显像与分析
根据18F-FEE的HepG2肝癌移植瘤模型MicroPET/CT可知,18F-FEE在正常组织内的分布与上述正常小鼠的生物分布和显像结果一致。特别需要强调的是,18F-FEE的肿瘤分布较为明显,注射后30、60和90 min的%ID/gmean分别为2.0±0.42、1.6±0.70和1.4±0.64,整体呈现缓慢下降趋势,这与其它正常组织%ID/g的变化趋势不一样。同时,18F-FEE的肿瘤和肌肉的定量分布%ID/gmean的比值(T/M)随着时间延长而增加,3个时间点的T/M分别为6.69±0.08、10.2±0.03和22.2±0.02。实验结果表明,18F-FEE的肿瘤分布较高、停留时长较长。

图6 18F-FEE 的HepG2移植瘤模型MicroPET/CT与分析
3 讨 论
作为广受关注的中药活性成分的代表之一,毛兰素及其衍生物作为潜在的抗癌新药候选对象具有重要的研发价值。研究[7]发现,EBT比毛兰素的抗肿瘤活性更大,并且其对应的磷酸化前药(EBTP)水溶性更好,能够通过破坏血管而抑制肿瘤生长[15]。由于特殊的氟效应,含氟的药物分子往往具有更好的药效和药代学性质[12],因此在EBT分子结构中引入氟原子设计而成的一种新型衍生物FEE具有较好的抗癌潜力。为了更为直观地评价FEE的体内分布性质,本文探索了18F-FEE的18F标记方法及其制备条件,开展了MicroPET/CT可视化评价其体内分布的研究。
由于目前未见18F标记毛兰素衍生物的研究报道,本文首先优化建立18F-FEE的合成方法。合成18F-FEE的第一步是18F标记反应,其标记率是18F-FEE产率的首要决定因素,因此本文从反应时间、反应温度、前体浓度和反应溶剂等4个主要影响因素优化了标记条件。结果显示,浓度为5.0 mg/mL的前体MMEE的乙腈溶液,与活化的18F-离子,在100 ℃下加热反应10 min就能达到理想的标记率。对于第二步水解反应,本文从反应时间、反应温度和HCl浓度3个关键的影响因素优化了水解条件。结果显示,中间体18F-FMEE在6 mol/L的HCl中,于100 ℃下加热反应10 min即可实现高效的水解反应。根据上述标记反应和水解反应的优化条件,本文成功制备了18F-FEE,其放射化学纯度大于95%,便于开展后续的生物分布和MicroPET/CT等体内评价。
对于天然中药活性成分进行化学结构改造,是发现和创制新药的重要来源之一[2]。FEE是根据氟效应进行化学结构改变而成的EBT类似物,二者化学结构非常相似,又都是毛兰素的衍生物,潜在的抑瘤能力更强。与以前侧重体外评价筛选候选新药不同,本研究联合利用18F标记和PET/CT,发挥核素标记示踪与PET/CT可视化的多重优势,首先尝试评价18F-FEE的体内正常组织分布和肿瘤分布情况。正常小鼠的生物分布和MicroPET/CT显示,18F-FEE主要分布于肝、肠、肾和膀胱等代谢组织,心、肺等组织的分布较低,提示FEE作为抗癌药物具有较好的安全耐受性。特别重要的是,HepG2肝癌移植瘤模型MicroPET/CT发现,18F-FEE长时间广泛分布于肿瘤组织,肿瘤%ID/gmean高,注射60 min后T/M高达10以上,提示FEE有望用于抗肿瘤治疗。
综上所述,本研究优化建立了抗癌中药活性成分毛兰素衍生物18F-FEE的18F标记条件,同时利用MicroPET/CT探索了其体内正常组织分布和肿瘤组织分布情况。本研究发现,18F-FEE主要分布于肝、肠、肾等药物代谢组织,而且其在肿瘤内分布广泛,证实FEE抗肿瘤潜能大、安全耐受性好。总之,18F等正电子核素标记与PET/CT非常有利于天然活性中药成分及其衍生物作为潜在抗癌药物的评价,进而更快、更好地从中医药宝库中发掘造福民众健康的新药。
