18F-FAPI-42 PET/CT在脑胶质瘤分级预测中的初步研究
2022-09-07刘少玉赖名耀李海南山常国成丽娜蔡林波王欣璐
吕 杰,林 涛,侯 鹏,刘少玉,赖名耀,李海南,山常国,成丽娜,温 馨,蔡林波,王欣璐
1.广州医科大学附属第一医院核医学科,广东 广州 510120;
2.广东三九脑科医院神经外科,广东 广州 510510;
3.广东三九脑科医院肿瘤综合诊疗科,广东 广州 510510;
4.广东三九脑科医院病理科,广东 广州 510510;
5.广东三九脑科医院影像科,广东 广州 510510
脑胶质瘤是最常见的颅内原发肿瘤,占颅内原发恶性肿瘤的80%,是原发性脑肿瘤的主要死亡原因[1]。根据世界卫生组织(World Health Organization,WHO)分类标准,胶质瘤可分为高级别胶质瘤(high-grade glioma,HGG,WHOⅢ-Ⅳ级)与低级别胶质瘤(low-grade glioma,LGG,WHO Ⅰ-Ⅱ级);而根据异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变状态将其细分为IDH野生型及IDH突变型[2]。组织病理学分级及客观的分子特征是对胶质瘤患者评估的关键,往往会对胶质瘤的治疗决策产生影响。目前,对于胶质瘤的显像,功能性磁共振成像(magnetic resonance imaging,MRI)和18F-FDG正电子发射体层成像(positron emission tomography,PET)/计算机体层成像(computed tomography,CT)仍不能满足临床诊疗的需求。
成纤维细胞活化蛋白-α(fibroblast activation protein-α,FAP-α)是一种细胞表面丝氨酸蛋白酶,在大多数正常成人组织中不表达,但在胶质瘤的细胞表面呈高表达,尤其是在胶质母细胞瘤的间质亚型中表达最高,并可提高肿瘤实质的侵袭性以及促进上皮到间质的转化[3-4]。近期有研究[5]表明,IDH野生型胶质母细胞瘤和IDH突变型HGG68Ga-成纤维活化蛋白抑制剂(fibroblast activation protein inhibitor,FAPI)摄取增高,但其研究样本量及胶质瘤病理学类型非常有限,未能进一步研究不同IDH表型的同级别胶质瘤FAPI摄取是否存在差异。因此,本研究进一步探讨18F-FAPI-42 PET/CT在脑胶质瘤分级及IDH基因表型预测中的临床应用价值。
1 资料和方法
1.1 研究对象
回顾并纳入2020年6月—2021年5月初诊怀疑脑胶质瘤或怀疑胶质瘤复发的患者25例,年龄17~67岁。纳入标准:① 根据增强MRI或多参数MRI(包括弥散加权成像、磁共振波谱成像或血流灌注成像)考虑为脑胶质瘤或胶质瘤复发;② 术前均行18F-FAPI-42 PET/CT;③ 所有患者均经立体定向穿刺活检或手术后病理学检查确诊;④ 既往接受放化疗的患者,治疗完成与PET/CT扫描之间间隔3个月以上(以避免治疗对放射性示踪剂吸收的影响)。排除标准:① 未经病理学检查证实;② 经病理学检查证实为其他肿瘤。本研究经医院伦理委员会批准,所有患者签署知情同意书。
1.2 18F-FAPI-42 PET/CT显像
1.2.1 药物合成
FAPI前体(AlF-NOTA螯合剂)购买自希施生物科技(上海)有限公司。按照先前的方案[6]进行18F-FAPI制备,18F-FAPI的放射化学纯度超过95%,最终产品用生理盐水稀释,通过0.22 μm Millipore过滤器进入无菌多剂量注射器进行消毒。最终产物是无菌和无热原的。
1.2.2 图像采集
按照患者体重静脉注射18F-FAPI-423.70 MBq/kg,静息60 min行头部PET/CT显像(采用美国GE公司的Discovery ST 8),设置自动电流,电压120 kV,扫描层厚3.75 mm。采用二维有序子集期望最大化(ordered subset expectation maximization,OSEM)算法和128×128图像矩阵重建PET数据。
1.2.3 图像分析
18F-FAPI-42 PET/CT图像由1名经验丰富的核医学科医师盲法分析。参照患者MRI增强扫描图像,在PET/CT图像上勾画出脑胶质瘤感兴趣区(region of interest,ROI),系统自动计算出脑胶质瘤病灶最大标准摄取值(maximum standardized uptake value,SUVmax),记为Tmax。取病灶对侧正常脑组织为本底,勾画直径为2 cm的ROI,测定其SUVmax,记为Bmax。计算肿瘤病灶靶本比值(target to background ratio,TBR;TBR=Tmax/Bmax)。
1.3 统计学处理
采用SPSS 25及GraphPad Prism 5软件分析数据。符合正态分布的计量数据以±s表示,不符合正态分布的计量数据以M(P25,P75)表示。两组间PET/CT指标比较采用Mann-WhitneyU检验及t检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,获得各指标鉴别HGG与LGG的最佳截断值。ROC曲线的曲线下面积(area under curve,AUC)取值范围0.5~1.0,AUC越接近于1.0,说明诊断效果越好。根据约登指数最大值计算各指标相对应的灵敏度及特异度。P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本特征资料
本研究共纳入25例脑胶质瘤患者(初诊患者14例,疑似肿瘤复发者11例),平均年龄(40.00±2.44)岁,年龄范围为17~67岁。在25例患者中发现26个病灶,其中23个病灶位于两侧大脑半球,1个病灶位于延髓,1个病灶位于小脑,1个病灶位于脑干。所有病灶最终均经病理学检查证实,其中12个病灶由立体定向穿刺活检证实,14个病灶由手术后病理学检查证实。HGG(WHO Ⅲ-Ⅳ级)19个,包括IDH野生型10个,IDH突变型9个;LGG(WHO Ⅱ级)7个,包括IDH野生型2个,IDH突变型5个(表1)。

表1 患者基本特征资料
2.2 不同级别胶质瘤病灶指标比较及预测效能
HGG病灶SUVmax[1.75(1.25,3.19)]明显高于LGG病灶[0.32(0.31,1.14)],两者差异有统计学意义(U=25.00,P=0.018)(图1A、1B)。HGG病灶TBR(26.24±4.83)明显高于LGG病灶(9.47±2.81),两者差异有统计学意义(t=2.280,P=0.032)(图1C、1D)。SUVmax预测HGG最佳阈值为1.20,相应ROC曲线的曲线下面积(area under curve,AUC)为0.812(95%CI 0.609~1.000),灵敏度为0.789,特异度为0.857(图2A)。TBR预测HGG最佳阈值为9.09,相应AUC为0.850(95%CI 0.686~1.000),灵敏度为0.842,特异度为0.857(图2B)。图3为LGG与HGG图像比较。
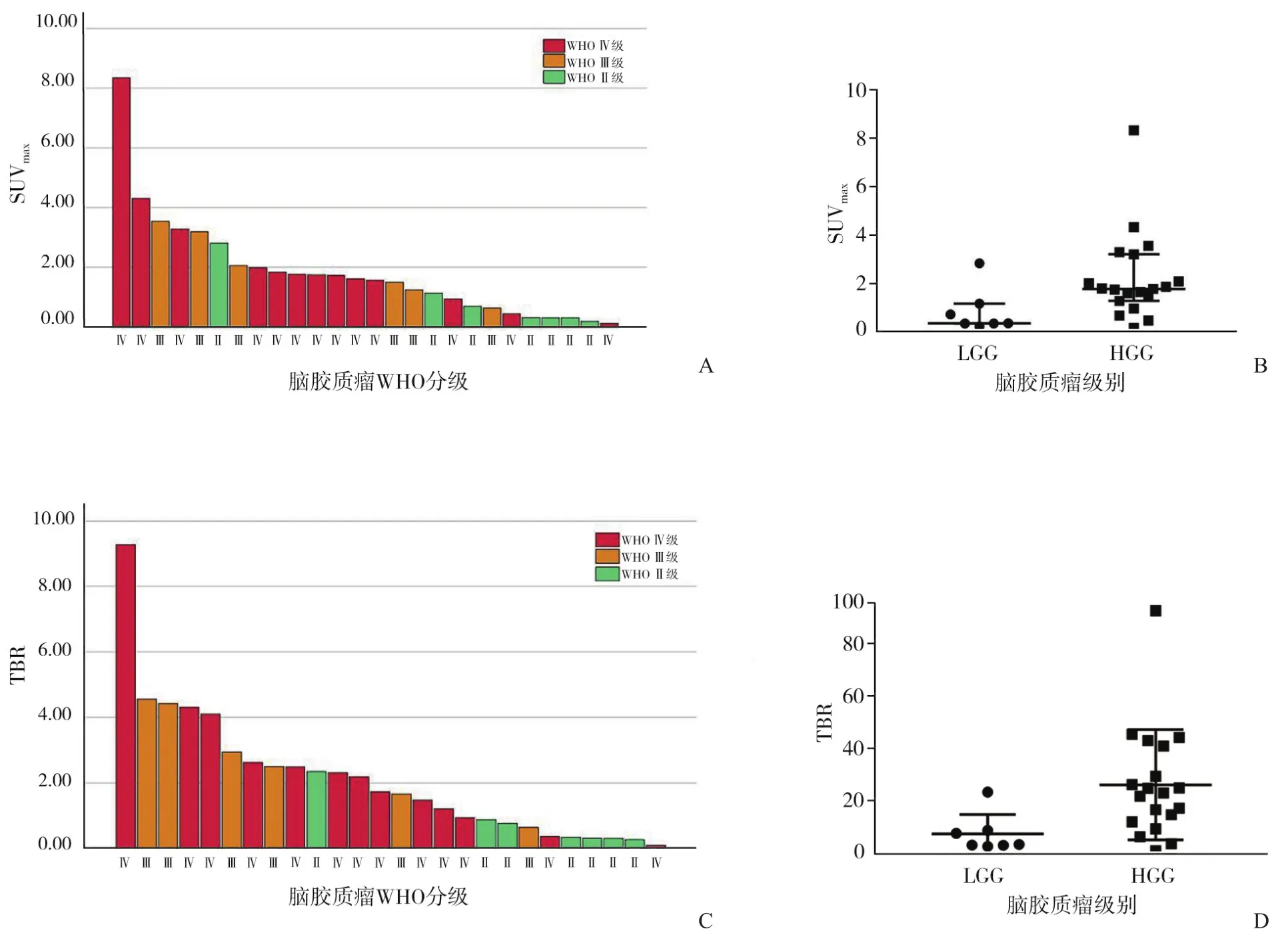
图1 不同级别胶质瘤SUVmax及TBR差异

图2 SUVmax及TBR预测HGG ROC曲线

图3 不同级别脑胶质瘤图像比较
2.3 不同IDH表型脑胶质瘤病灶指标比较
对于所有26个脑胶质瘤病灶,IDH野生型与IDH突变型病灶之间SUVmax[1.68(0.99,2.61)vs1.38(0.32,2.34)]及TBR[19.59(8.93,24.52)vs15.71(3.38,32.32)]差异均无统计学意义(U=71.00,P=0.520;U=80.00,P=0.860)。对于19个HGG病灶,IDH野生型与IDH突变型病灶之间SUVmax[1.68(0.82,2.57)vs1.84(1.38,3.33)]及TBR[19.59(7.97,29.44)vs26.29(15.71,42.63)]差异均无统计学意义(U=36.00,P=0.462;U=30.00,P=0.221,表2)。

表2 IDH表型不同的胶质瘤病灶指标比较
3 讨 论
本研究共纳入26个脑胶质瘤病灶,包括19个HGG与7个LGG,研究结果表明18F-FAPI-42 PET半定量参数SUVmax及TBR在HGG与LGG病灶中均存在明显差异,这与Röhrich等[5]的研究结果是一致的。本研究结果显示当SUVmax阈值为1.20时,预测HGG灵敏度为0.789,特异度为0.857,AUC为0.812;而TBR在预测HGG中表现出更佳的效能,当TBR>9.09时,其预测HGG的灵敏度为0.842,特异度为0.857,AUC为0.850;这与Röhrich等[5]的研究结果(SUVmax/BG阈值2.745,灵敏度1.000,特异度1.000)有一定差异,可能与不同研究样本量存在差异以及不同研究纳入不同级别胶质瘤患者的人群有关。
目前关于不同放射性示踪剂在脑胶质瘤分级的应用已有较多报道[7-11]。有meta分析通过纳入8项FDG PET研究、4项FET PET研究、6项MET PET研究、3项同时使用FDG与FET PET研究及2项同时使用FDG与MET的研究进行分析,结果表明FDG PET在脑胶质瘤分级中灵敏度为0.63(95% CI 0.51~0.74),特异度为0.89(95%CI 0.73~0.95);FET PET在脑胶质瘤分级中灵敏度为0.88(95% CI 0.82~0.93),特异度为0.57(95% CI 0.40~0.73);MET PET在脑胶质瘤分级中灵敏度为0.94(95% CI 0.79~0.98),特异度为0.55(95% CI 0.32~0.77)[12]。因为FDG在正常脑组织较高的生理摄取,同时大部分氨基酸代谢类显像剂半衰期过短且特异度不高导致临床应用受限,因此糖代谢及氨基酸代谢类显像剂在脑胶质瘤方面应用受限。在脑胶质瘤分级方面,本研究显示18F-FAPI PET/CT衍生的不同半定量指标具有较高的灵敏度及特异度。FAPI显像剂有望为PET/CT在脑胶质瘤分级应用中提供新方法。
最近,有研究[3]表明,许多IDH野生型LGG可能与胶质母细胞瘤一样具有侵袭性,并且其预后与组织学为WHO Ⅳ级的肿瘤非常相似。相反,与IDH野生型胶质母细胞瘤及野生型低级别(WHOⅡ-Ⅲ级)胶质瘤相比,IDH突变型胶质母细胞瘤可具有明显更好的预后[13]。因此,术前预测胶质瘤IDH突变状态可能对胶质瘤的临床管理具有十分重要的意义。然而,本研究结果显示IDH突变型胶质瘤与IDH野生型胶质瘤之间FAPI摄取差异无统计学意义。这与Röhrich等[5]的研究结果并不一致,一方面该研究样本量极其有限,另一方面该研究纳入的IDH野生型胶质瘤病例均为HGG,该研究忽视了不同级别胶质瘤对IDH表型的影响。本研究样本量相对较大,同时注意胶质瘤级别对IDH表型可能存在的影响。在本研究中,IDH突变型HGG与IDH野生型HGG之间FAPI摄取无明显差异。本研究中,由于样本量有限,并未进一步比较LGGIDH表型的差异。然而,在本研究中有一例IDH野生型LGG(患者5)FAPI摄取高于IDH突变型LGG,LGG不同IDH表型FAPI摄取可能存在差异。因此,对于FAPI PET/CT显像与胶质瘤IDH表型的关系需要进一步扩大样本量进行探讨。
本研究存在以下缺陷。首先,病例数较少且数据分布不均衡,尤其是LGG病灶数只有7个,因此未能对初诊胶质瘤及胶质瘤复发患者行亚组分析,无法说明两者生物学行为是否有差异。其次,由于研究时间有限,本研究仅探讨FAPI摄取不同病理学类型脑胶质瘤之间关系,并未进一步深入研究FAPI摄取与患者预后之间是否存在关联。
综上所述,18F-FAPI-42 PET/CT对脑胶质瘤分级具有较好的临床价值,FAPI摄取与脑胶质瘤IDH基因表型及患者预后的关系有待进一步深入探讨。
