厚壳贻贝两种新型防御素的分子鉴定
2022-09-07杨金月何建瑜张晓林何梦岚严小军
刘 璐, 杨金月, 王 莹, 何建瑜, 张晓林, 何梦岚, 严小军, 廖 智
(浙江海洋大学海洋科学与技术学院海洋生物资源与分子工程研究室, 浙江 舟山 316022)
贻贝在全球有着广泛的分布, 是一类具有重要经济价值的双壳贝类。贝类因其滤食性特征导致其在生存过程中会富集水体中大量的微生物。同时,贝类作为无脊椎动物仅具有先天免疫系统。因此, 在当前贝类养殖业发展过程中, 因高密度养殖以及水体污染等导致养殖贝类大规模病害甚至死亡的事件时有发生[1-4]。但令人感兴趣的是, 同样是双壳贝类, 贻贝在养殖过程中却表现出较强的疾病耐受性。迄今为止, 尚无贻贝属(Mytilus)在养殖过程中大规模病害的报道[4,5]。在贻贝、牡蛎以及蛤类混养海域中, 高密度的弧菌、病毒以及寄生虫等通常造成牡蛎及蛤类的大量死亡, 但并未对同海域生存的贻贝产生明显危害[4-6]。上述研究结果表明, 相较于其他贝类, 贻贝具有独特而强大的免疫系统。因此, 贻贝已成为海洋无脊椎动物免疫相关研究的重要对象[6,7]。目前, 已知贻贝的免疫系统对病原微生物表现出极强的耐受性[8, 9], 表明贻贝独特的免疫防御机制能有效抵御水体中各种微生物的侵袭。因此, 对贻贝的免疫系统及其分子机制研究具有重要的科学意义[10]。
目前的研究结果表明, 贻贝具有一套复杂的免疫体系。其先天免疫系统可分为粘液免疫体系, 细胞免疫体系以及体液免疫体系三个子系统[11]。其免疫体系的基本工作机制包括免疫感受、识别和效应三个方面, 涉及的分子过程包括免疫吞噬、包裹、免疫细胞聚集、酚氧化酶系统、氮自由基系统、裂解酶系统以及免疫细胞释放免疫效应因子等[7,11-13]。值得关注的是, 在当前对于贻贝免疫效应分子研究中, 贻贝抗菌肽表现出较强的分子多样性和广谱的抗菌活性。目前,已报道的贻贝抗菌肽已超过10种不同家族[7]。且在同一家族内, 贻贝抗菌肽也表现出极强的分子多样性特征, 具有不同的转录本。例如,贻贝抗菌肽myticin,其家族成员(转录本)数量超过20种[14];而另一种贻贝抗菌肽mytimycin, 被发现在贻贝属中具有106种不同亚型,并可归纳为13个亚家族[15]。从已报道的贻贝属物种的基因组序列来看, 贻贝抗菌肽的分子多样性可能来自于其在基因组中的高拷贝数量、基因的可变剪切、以及不同贻贝个体间存在的高度差异化的非必需基因(dispensable genes)[16,17]。目前, 贻贝已成为海洋生物中发现抗菌肽数量最为丰富的物种之一, 其丰富的抗菌肽分子多样性也为开发贻贝抗菌肽为来源的新型生物抗生素提供了一个资源宝库。
厚壳贻贝(Mytiluscoruscus)是我国东部海域最重要的养殖贝类之一。此前的研究已从厚壳贻贝中鉴定到丰富的各类抗菌肽分子, 包括mytilin[18], myticin[19], myticusin[20]以及mytichitin[21]等。为进一步发现和筛选厚壳贻贝新型抗菌肽分子, 通过对厚壳贻贝血细胞转录组[22]进行数据挖掘, 从中筛选到2种新型的贻贝抗菌肽分子。序列分析结果表明, 该新型抗菌肽与节肢动物防御素具有较强的结构相似性, 因而被命名为类节肢动物防御素(arthropod like defensin, ALD)。尽管此前已有报道,发现在地中海贻贝(Mytilusgalloprovincialis)转录组数据库中存在ALD, 但对于该类抗菌肽在贻贝体内的免疫功能并未开展相关研究。为此, 以厚壳贻贝新发现的2种ALD为研究对象, 在序列分析的基础上, 开展了2种ALD在厚壳贻贝体内的分布特征及其在贻贝免疫过程中的作用研究; 同时也对2种厚壳贻贝ALD分子开展了固相化学合成以及功能验证。上述研究一方面为深入了解厚壳贻贝的抗菌肽分子多样性以及新型防御素在贻贝免疫过程中的分子角色奠定了基础, 也为后续开发厚壳贻贝新型防御素为来源的生物抗生素提供了科学依据。
1 材料与方法
1.1 厚壳贻贝血细胞转录组数据挖掘与序列分析
此前已完成厚壳贻贝血细胞转录组测序, 共获得63 942条单基因簇(unigene)[22]。采用美国国家生物技术信息中心(National Center of Biotechnology Information, NCBI)的BlastX程序对厚壳贻贝血细胞转录组unigene进行同源序列搜索, 数据库为NCBI的非冗余蛋白质数据库(NCBI non-redundant protein sequences), 阈值(E-value)设置为小于1E-05。从序列搜索结果中筛选与节肢动物防御素(arthropod defensin)具有较高相似性(序列一致性大于40%),且开放阅读框完整的unigene序列。
Unigene的开放阅读框采用Lasergene软件的Editseq模块(版本7.1.0)进行分析。开放阅读框推导的氨基酸序列采用在线网站SMART(http://smart.embl-heidelberg.de/)以及SignalP 4.0[23]分析序列中的结构域和信号肽。序列中成熟肽采用ProP软件[24]进行预测。蛋白质二级结构利用在线网站Prabi(http://pbil.ibcp.fr/)进行预测。蛋白质三级结构预测采用SWISS MODEL服务器在线进行。多序列比对于网站(https://www.ebi.ac.uk/Tools/msa/clustalo/)在线进行。进化树采用MEGA X软件以邻近法(Neighbor-Joining method)进行分析[25]。
1.2 PCR分析
对筛选到的厚壳贻贝ALD序列首先进行序列验证。根据其序列中开放阅读框两端的核酸序列设计特异性引物(Table 1), 利用PCR技术进行扩增, 对扩增产物进行测序并将所测序列与原始序列进行比较。进一步利用厚壳贻贝ALD开放阅读框内序列设计荧光定量PCR(quantitative PCR, qPCR)引物(Table 1)并开展基因表达分析。

Table 1 Primers for qPCR analysis
组织表达差异分析步骤如下。成年厚壳贻贝个体采集自浙江舟山嵊泗海域的贻贝养殖场。收集厚壳贻贝各组织(后闭壳肌、血细胞、外套膜、消化腺、性腺、足和鳃),经液氮研磨后, 以TRIzol试剂进行总RNA提取。采用试剂盒(PrimeScriptTMRT reagent kit, TaKaRa公司)进行RNA的逆转录; 逆转录后的cDNA作为模板用于厚壳贻贝ALD的组织表达差异分析。
厚壳贻贝的细菌诱导实验参照文献方法进行[26]。事先对厚壳贻贝进行不同微生物诱导, 包括金黄色葡萄球菌Staphylococcusaureus(CGMCC1.128), 溶藻弧菌Vibrioalginolyticus(CGMCC1.1616), 和白色念珠菌Candidaalbicans(CGMCC1.1630)。将金黄色葡萄球菌和溶藻弧菌接种于Luria-Bertani培养基中, 白色念珠菌接种于马铃薯葡萄糖琼脂培养基中,37℃培养4 h至A600值为0.4~0.6,离心(2 000 ×g,5 min)收集菌体,分别重悬于灭菌磷酸盐缓冲液(PBS)(pH 7.4),调菌浓度至A600为0.4,取菌液100 μL,从贻贝后闭壳肌内注射。贻贝经诱导后分别于0.5, 2, 4, 8, 24和48 h采集外套膜和血淋巴。其中, 血淋巴采用内含抗凝剂阿氏液注射器进行收集,离心(1 000 ×g,5 min)获得血细胞。分别对外套膜和血细胞进行总RNA提取和逆转录, 所得血细胞cDNA作为模板开展后续荧光定量PCR分析。
不同发育阶段的厚壳贻贝幼虫及成年贝采集自浙江舟山嵊泗的石柱山贻贝育苗厂。包括D型幼虫(trochophore)、担轮幼虫(veliger)、壳顶幼虫(metamorphosis)、匍匐幼虫(pediveliger)、稚贝(juvenile), 以及3月龄, 6月龄和9月龄3种成年贝(adult), 共8种不同发育阶段。幼虫不同发育阶段的判定参照文献报道[27], 以及光学显微镜形态观察判定。采集的不同发育阶段贻贝样本, 取全组织经液氮研磨后, 进行总RNA提取和逆转录,所得cDNA用于后续荧光定量PCR分析。
荧光定量PCR在MX3000P实时定量PCR系统(Stratagene公司, 美国)进行。荧光染料为SYBR Green。PCR程序设置为95℃,预变性180 s, 之后为95℃变性20 s, 59℃退火20 s, 72℃延伸25 s,循环数为35,特异性引物及内参基因引物见Table 1。表达量依据CT值采用2-△△Ct方法[28]进行分析。
1.3 贻贝节肢动物防御素的固相多肽化学合成及鉴定
多肽固相化学合成参照文献[29], 在十二通道半自动多肽合成仪(上海强耀公司自主专利产品)上合成, 合成方向为从C-端向N-端。合成后的线性多肽粗品以高效液相色谱仪(Agilent 1260, 美国安捷伦公司)进行分离纯化,色谱柱为 C8 反相柱(4.6×250 mm, 5 μm), 洗脱液分别为A液:含0.1%TFA的纯水;B液:含0.1%TFA的乙腈;洗脱梯度为20 min内B液比例由30%上升到65%;流速为1.0 mL/min;采用紫外检测器进行检测, 检测波长为 220 nm, 收集洗脱目标峰开展质谱分析, 采用质谱(ZQ2000, 美国 Waters 公司)对合成后的多肽纯品进行分子量鉴定。质谱检测条件为: 气动辅助电喷雾离子化(ESI);毛细管电压为 2.5 kV;检测器电压为 1.5 kV;离子源温度为450℃;离子检测方式为选择性离子检测;离子极性为正离子。
参照文献方法[29], 采用谷胱甘肽氧化型和还原型按1∶10配置混合溶液对固相合成后的ALD进行复性; 复性在避光以及4 ℃条件下进行, 复性时间为 24 h。复性后的多肽进一步经高效液相色谱纯化, 收集目的峰, 经冻干后开展抑菌活性分析。
1.4 抑菌活性测试
参照文献方法[30], 对复性后的ALD采用生长曲线抑制法进行抑菌活性测试。测试菌种均购自北京中国普通微生物菌种保藏管理中心, 包括大肠杆菌Escherichiacoli、巨大芽孢杆菌Bacillusmegaterium(ATCC 19161)、金黄色葡萄球菌Staphylococcusaureus(ATCC25923)、副溶血弧菌VibrioParahaemolyticus(ATCC17802)、白色念球菌Moniliaalbican(ATCC10231)以及藤黄叠球菌Sarcinalutea(ATCC4698)。
1.5 统计学方法
采用SPSS 软件(v25.0)进行统计学分析。数据以平均值±方差表示。数据图以GraphPad Prism8.2软件绘制。组间比较采用One-way ANOVA方法进行显著性差异分析,P<0.05代表具有显著性差异。
2 结果
2.1 厚壳贻贝节肢动物防御素具有典型的防御素结构特征
经序列验证后的厚壳贻贝ALD-1和ALD-2序列已上传GenBank数据库, 序列号分别为MW922034.1(QXT26513.1)和MW922035.1(QXT26514.1)。ALD-1基因开放阅读框长度为291 bp, 编码1条96个氨基酸残基组成的前体多肽, 包括信号肽(22个氨基酸残基)、pre-pro区(31个氨基酸残基)和成熟肽(43个氨基酸残基)(Fig.1A)。其成熟肽序列中含有6个半胱氨酸, 推测形成3对二硫键, 其半胱氨酸排列模式为C-X16-C-X3-C-X9-C-X4-C-X1-C(C代表半胱氨酸; X代表其他氨基酸残基, 数字代表残基数目), 该排列模式与经典的节肢动物防御素基本一致[31]。ALD-2基因开放阅读框长度为204 bp, 编码的前体肽长度为67个氨基酸残基, 包括信号肽(24个氨基酸残基)和成熟肽(43个氨基酸残基), 无可预测的pre-pro区(Fig.1B)。其成熟肽序列中含有8个半胱氨酸, 推测形成4对二硫键, 其半胱氨酸排列模式为C-X6-C-X3-C-X4-C-X5-C-X9-C-X1-C-X3-C。该排列模式与节肢动物抗菌中具有抗真菌活性的防御素类似[32,33]。ALD-1理论分子量为4 471.14D, 理论等电点为8.69, 属于碱性多肽,其成熟肽中含量最丰富的氨基酸为甘氨酸和半胱氨酸, 其含量均为14%; ALD-2理论分子量为4 688.41D, 理论等电点为7.51, 属弱碱性多肽,成熟肽中含量最丰富的氨基酸为半胱氨酸(占比18.6%), 其次为甘氨酸(占比14%)。

Fig.1 cDNA sequence and derived amino acid sequence of ALD-1(A)and ALD-2(B) The predicted signal peptide is boxed.The putative mature region is in bold.Asterisk indicates the stop codon.Sequence alignment of cDNA with deduced amino acids of ALD-1(GeneBank: MW922034)and ALD-2(GeneBank: MW922035)were performed by DNAMAN8 software
二级结构预测结果表明,ALD-1序列中, Alpha螺旋区(alpha helix)含量占比为39.58%, 完全伸展区(extended strand)占比16.67%, 无规卷曲(random coil)占比37.50%(Fig.2)。ALD-2序列中, Alpha螺旋区含量较低, 占比仅为13.43%, 完全伸展区占比36.23%, 无规卷曲占比55.22%(Fig.2)。进一步结构域预测结果表明, ALD-1序列中含有1个Knot1结构域(结构域编号: SM000505), 其位置位于前体肽的55~96号残基(Fig.2)。该结构域典型特征在于其中的胱氨酸结(cystine-knot), 即由二硫键介导的结节状构象, 普遍存在于植物及节肢动物抗菌肽, 以及部分蝎毒素多肽序列中[34], 是一种较为稳定的结构域。ALD-2的序列中含有1个Defensin_2结构域(结构域编号: PF01097), 其位置为25~63号残基(Fig.2)。该结构域典型特征在于其序列中保守的6个半胱氨酸及由此形成的3对二硫键, 该结构域普遍存在于节肢动物抗菌肽中[35-37]。进一步的三级结构预测结果表明, ALD-1和ALD-2均采取了经典的二硫键稳定α/β结构[38]。其三级结构特征包括均包含一段位于序列C-端的α-螺旋和序列N-端的2~4段反平行β-折叠(Fig.2), 且三级结构预测结果与二级结构预测结果具有类似特征。
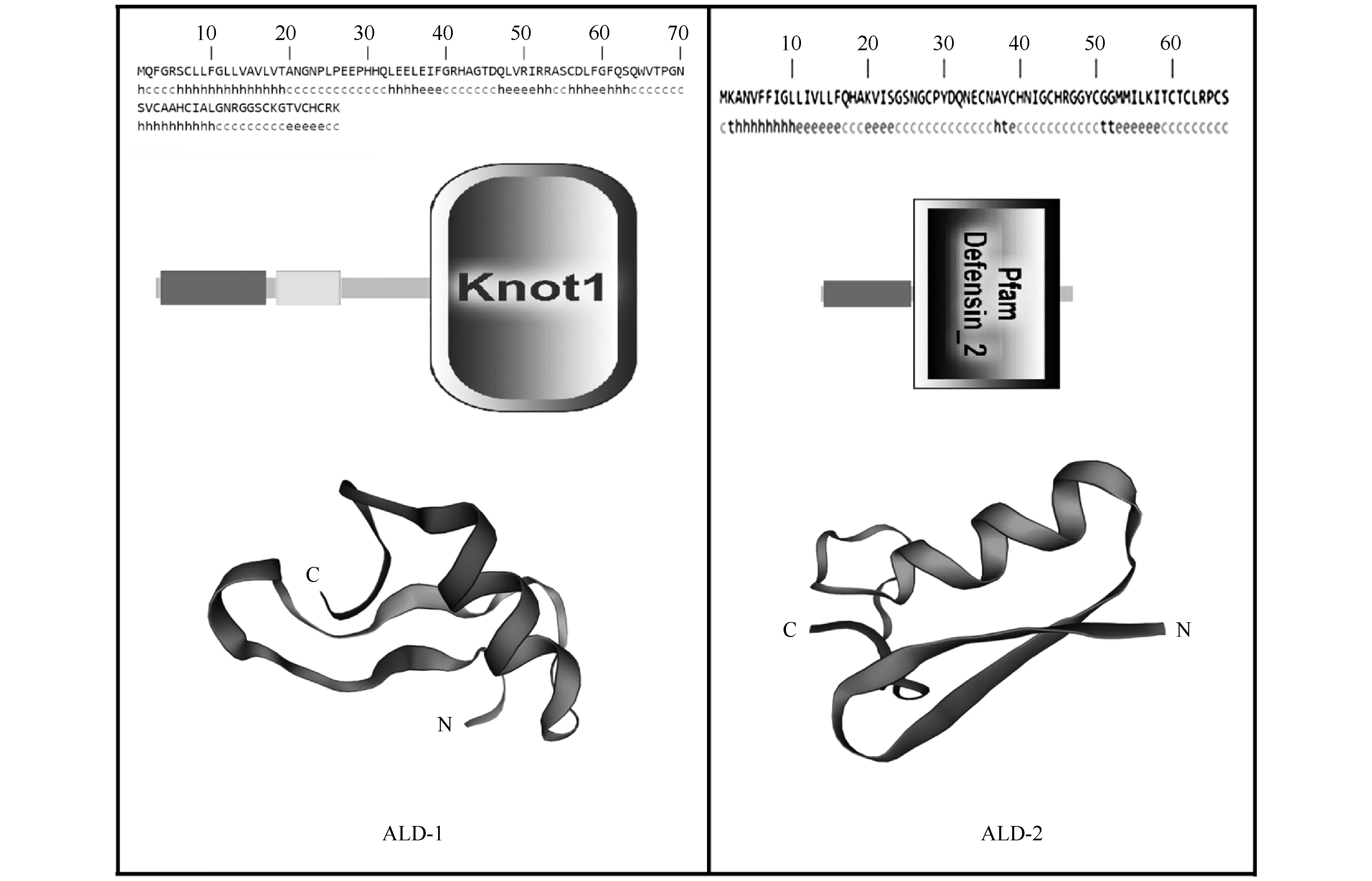
Fig.2 The structural features of ALD-1 and ALD-2 From the top to bottom, secondary structure, domain, and spatial structure prediction are presented.The secondary structure was predicted by Prabi(http://pbil.ibcp.fr/)online(h represents helix, c represents coil, and e represents sheets, respectively).The domain was predicted by SMART.The spatial structure was predicted by SWISS MODEL server.The template for spatial structure prediction are Coprisin A of Copristripartitus(PDB:2LN4)for ALD-1, and Micasin A of Microsporumcanis(PDB: 2LR5)for ALD-2, respectively.“N” and “C” represent the N-terminal and the C-terminal of peptide, respectively
对ALD-1和ALD-2的序列同源搜索比对结果表明, ALD-1与来自椎椿以及臭虫属的防御素具有较高序列相似性(Fig.3);而ALD-2则与来自蜱属的防御素具有较高序列相似性(Fig.3)。进一步的进化树分析表明, ALD-1主要与臭虫属以及椎椿属防御素聚为一支, 但进化地位相对独立(Fig.4); 而ALD-2则主要与革蜱属以及扇头蜱属的防御素聚为一支, 而与同为双壳贝类的牡蛎防御素分支较远(Fig.4)。上述结果表明, 厚壳贻贝ALD-1和ALD-2与低等节肢动物的防御素在进化上可能具有近缘关系。
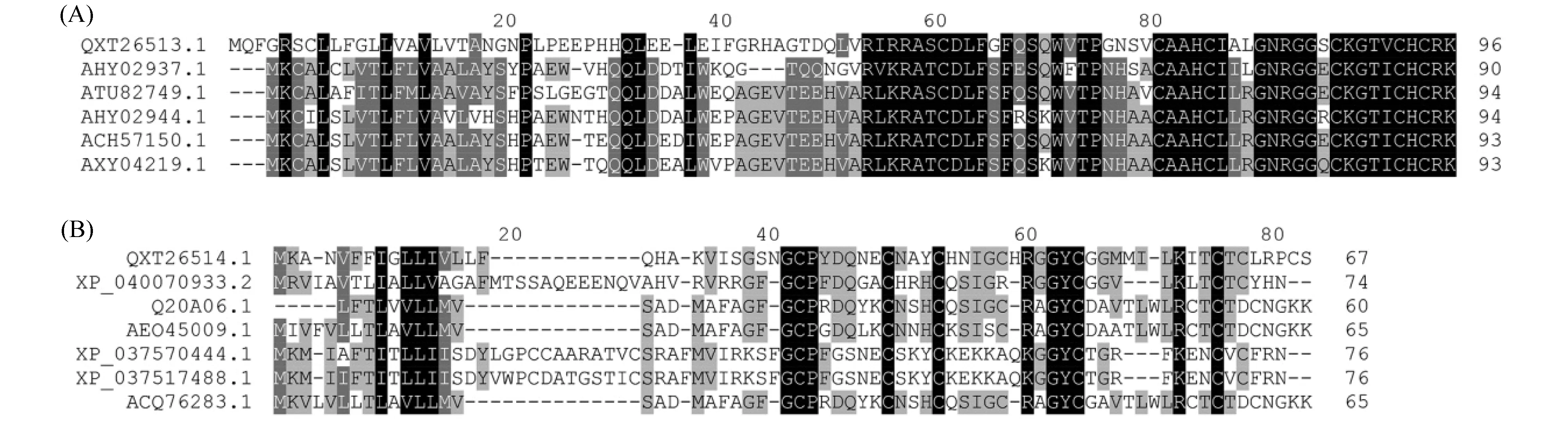
Fig.3 Multiple alignment of ALD-1(A)and ALD-2(B)with other homologous sequences Conserved amino acid are represented by black, gray indicates amino acids with strong similarities.QXT26513.1:Mytiluscoruscus ALD-1; AHY02937.1: Panstrongylus megistus defensin B; ATU82749.1:Pristhesancusplagipennis secreted Defensin-like peptide; AHY02944.1:Rhodniusprolixus defensin A P;ACH57150.1:Triatomabrasiliensis defensin 3;AXY04219.1:Meccuspallidipennis defensin 4.1;(QXT26514.1:Mytiluscoruscus ALD-2;XP_040070933.2:Ixodesscapularis defensin-like;Q20A06.1:Crassostreagigas Hemocyte defensin Cg-Defh1; AEO45009.1:Crassostreagigas mantle defensin; XP_037570444.1:Dermacentorsilvarum defensin-like; XP_037517488.1:Rhipicephalussanguineus defensin-like; ACQ76283.1:Crassostreagigas defensin
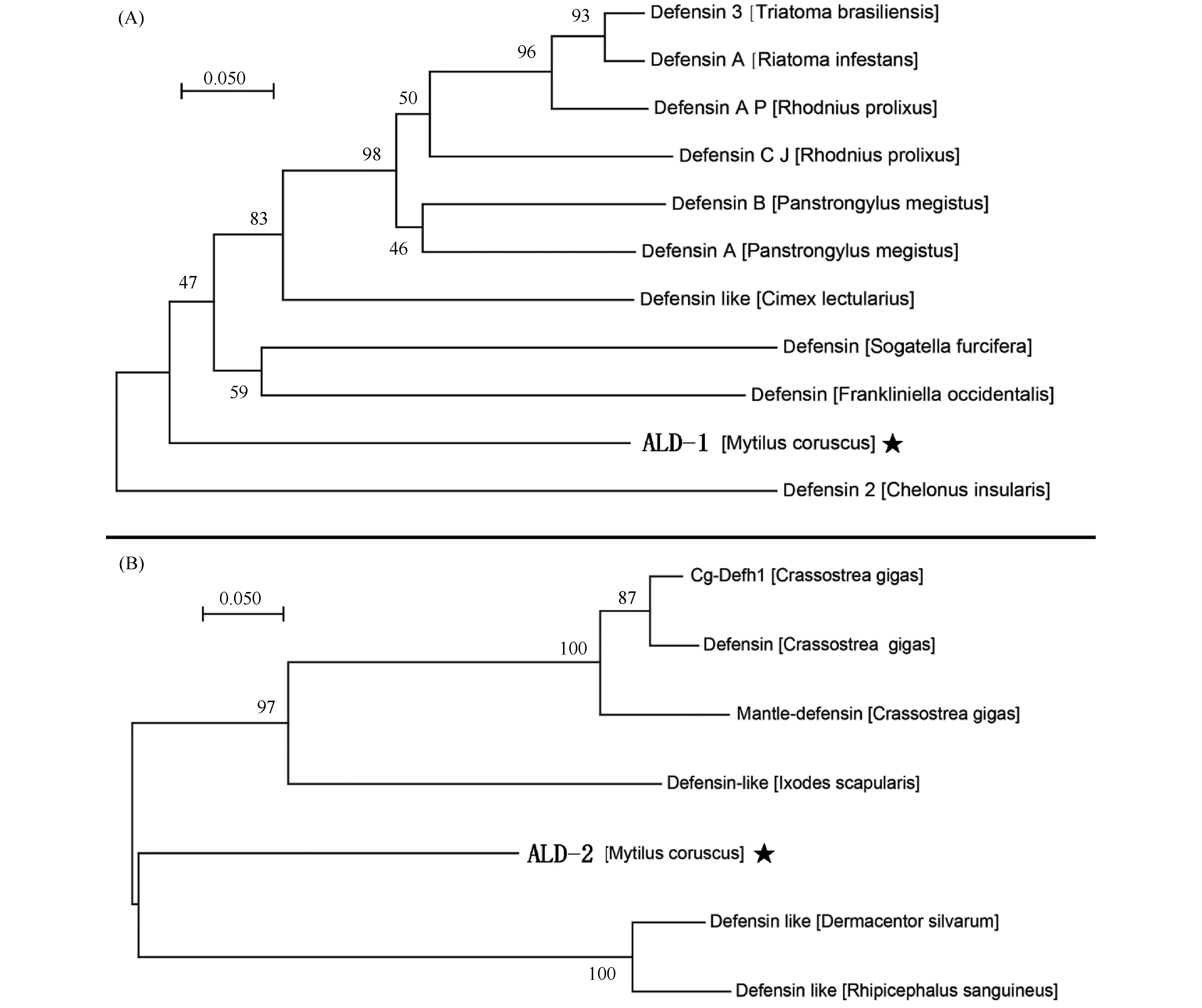
Fig.4 Phylogenetic tree of ALD-1(A)and ALD-2(B)with homologous sequences Phylogenetic analysis was done by the neighbor-joining algorithm within the MEGAX based on ClustalW alignment.Numbers at tree nodes indicate the bootstrap confidence values from 1000 replicates.“★”labeled target sequence
2.2 厚壳贻贝节肢动物防御素具有不同的组织及发育阶段表达差异性
利用荧光定量PCR技术, 首先对ALD 在厚壳贻贝各组织中的表达量进行分析, 结果见Fig.5A。由图可见, ALD-1在厚壳贻贝7种组织中均有表达, 其相对表达量最大的组织出现在外套膜, 其次是消化腺(Fig.5A)。ALD-2同样呈现组成型表达特征, 其相对表达量最大的组织是消化腺, 其次为外套膜(Fig.5A)。2种抗菌肽在后闭壳肌以及血细胞中表达量均较低。
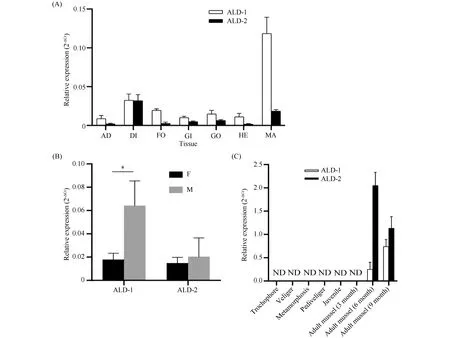
Fig.5 Tissue specific expression, sex specific expression, and developmental stage specific expression of ALD-1 and ALD-2 in M.coruscus (A)Tissue-specific expression of ALD-1 and ALD-2;(B)The relative expression of ALD-1 and ALD-2 in gonad of male and female mussel, respectively;(C)The expression of ALD-1 and ALD-2 at different developmental stages of larval and adult mussel.The statistical analysis of differences was performed by SPSS(v25.0)with one-way ANOVA followed by Tukey’s multiple range test.Differences were considered significant as P<0.05(n = 3).AD: Adductor muscle; DI: Digestive gland; FO: Foot; GI: Gill; GO: Gonad; HE: Hemocytes; MA: Mantle.F, female; M, male
进一步的性别差异表达结果表明, 2种抗菌肽在雌性和雄性贻贝的性腺组织中表达模式不同, 其中ALD-1在雄性贻贝性腺组织中表达量要显著高于雌性贻贝性腺(P<0.05,n=3);而ALD-2则在雄性和雌性贻贝性腺中的表达量无明显差异(P>0.05,n=3)(Fig.5B)。ALD-1和ALD-2在贻贝幼虫不同发育阶段以及不同年龄阶段的成年个体中, 具有不同的表达特征(Fig.5C)。2种ALD均表现为在幼虫阶段无表达, 且在低龄(3月龄)贻贝中也未能检测到表达;但是自6月龄开始, ALD-1和ALD-2均出现高表达(Fig.5C), 表明2种ALD在厚壳贻贝中主要负责成年贻贝的免疫防御。
2.3 厚壳贻贝节肢动物防御素在不同组织对不同微生物刺激具有不同的免疫反应模式
为进一步分析ALD在厚壳贻贝免疫过程中的作用, 考虑到2种ALD均在外套膜组织有高表达; 同时, 尽管2种ALD在血细胞中表达量较低, 但是考虑到贻贝血细胞是其主要的免疫防御组织, 因此, 我们选择外套膜和血细胞, 研究了2种ALD在不同微生物刺激下其表达量变化的时间曲线。所选用的微生物包括革兰氏阳性菌Staphylococcusaureus, 革兰氏阴性菌Vibrioalginolyticus, 以及真菌Candidaalbicans, 研究结果见Fig.6。由Fig.6A可见, 在外套膜组织中, ALD-1对在真菌刺激下, 其相对表达量显著上升(P<0.01), 其表达量峰值分别出现在0.5(2-△Ct值接近4)和24 h(2-△Ct值超过3);革兰氏阴性菌刺激也造成ALD-1在外套膜组织中的表达量出现显著上调(P<0.01), 其表达量峰值出现在24 h(2-△Ct值约为7);但是革兰氏阳性菌刺激对ALD-1的表达量影响较弱, 其表达量峰值出现在2 h(2-△Ct值约为1)(Fig.6A)。而在血细胞中, ALD-1表现出对革兰氏阳性菌的较强敏感性, 其表达量变化峰值出现在2和4 h, 2-△Ct值达到1.3;真菌和革兰氏阴性菌刺激下, ALD-1也表现出明显的表达量上调, 其峰值出现在2 h, 但是2-△Ct值较低, 均未超过1(Fig.6B)。
ALD-2表现出与ALD-1不同的免疫反应(Fig.6C, D)。在外套膜中, ALD-2表现出对革兰氏阳性菌的敏感性, 在革兰氏阳性菌刺激下, 其表达量在4 h达到峰值, 其2-△Ct值达到9;此外, 真菌刺激导致ALD-2的表达量在2 h达到峰值, 其2-△Ct值超过6;但是革兰氏阴性菌刺激对ALD-2的影响相对较弱(Fig.6C)。而在血细胞中, ALD-2受真菌刺激影响较强, 其表达量在2 h显著上调(P<0.01), 且其高表达一直持续到48 h, 其2-△Ct值维持在1以上;而革兰氏阳性菌和革兰氏阴性菌对血细胞的ALD-2的表达影响相对较弱, 其2-△Ct值多在0.6以下。其中,革兰氏阳性菌刺激后, ALD-2在血细胞的表达量峰值出现在4 h, 且持续到48 h;革兰氏阴性菌刺激下, ALD-2在血细胞中的表达量在24 h出现峰值(Fig.6D)。
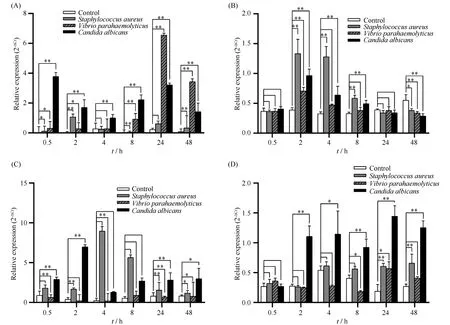
Fig.6 The relative expression level of ALD-1 and ALD-2 in hemocytes and mantle of Mytiluscoruscus, respectively, after infection with Staphylococcus aureus, Vibrio Parahemolyticus and Candida albicans (A)The relative expression level of ALD-1 in the mantle of post-infection;(B)The relative expression level of ALD-1 in the hemocytes of post-infection;(C)The relative expression level of ALD-2 in the mantle of post-infection;(D)The relative expression level of ALD-2 in the hemocytes of post-infection; The statistical analysis of differences was performed by SPSS(v25.0)with one-way ANOVA followed by Tukey’s multiple range test.* and** represents the significance of the difference P<0.05 and P<0.01(n=3), respectively
2.4 采用固相化学合成手段成功获得ALD-1和ALD-2
采用固相多肽合成策略, 完成对厚壳贻贝ALD-1和ALD-2的预测成熟肽区的化学合成。合成产物的纯化与鉴定结果分别见Fig.7,8。由图可见, ALD-1合成后经高效液相色谱纯化, 其纯度达到90%以上; 质谱鉴定结果表明, 合成的ALD-1分子量为4 471.5, 与理论分子量(4 471.14)一致(Fig.7); 合成的ALD-2经高效液相色谱纯化, 其纯度达到90%以上, 其质谱鉴定分子量为4 688.4, 与理论分子量(4 688.4)一致(Fig.8)。上述结果表明, 厚壳贻贝ALD-1和ALD-2的预测成熟肽区合成成功, 可用于后续研究。

Fig.7 Purification of solid chemical synthesized ALD-1 by HPLC(A)and the mass spectrum of the fraction collected from HPLC elution(B) The synthesized peptide was purified by c8 reverse phase column(4.6×250 mm, 5 μm), and the mass of purified peptide was determined by a mass spectrometry.*indicates the eluted target peptide
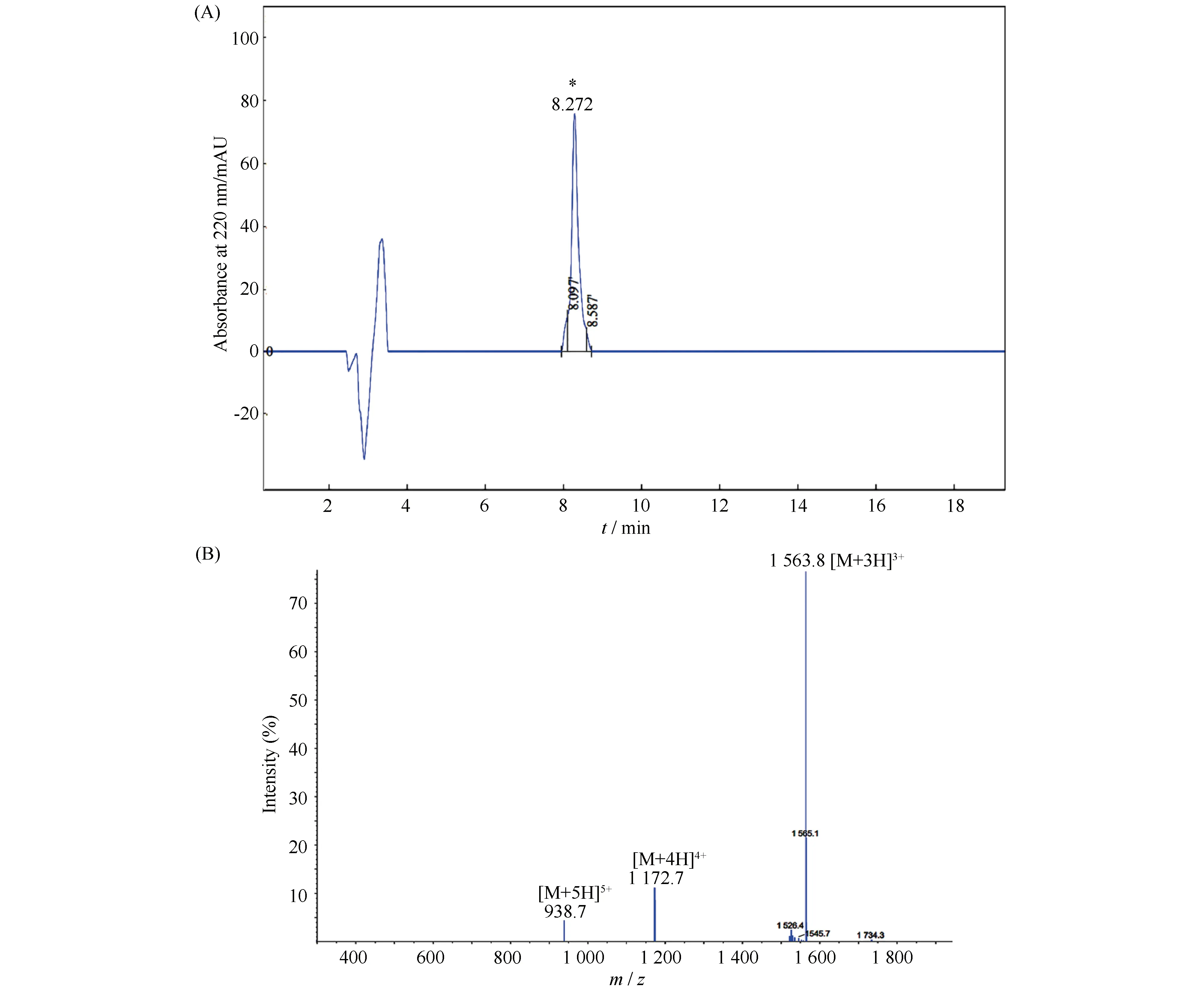
Fig.8 Purification of solid chemical synthesized ALD-2 by HPLC(A)and the mass spectrum of the fraction collected from HPLC elution(B) The synthesized peptide was purified by c8 reverse phase column(4.6×250 mm, 5 μm), and the mass of purified peptide was determined by a mass spectrometry.*indicates the eluted target peptide
2.5 化学合成的ALD-1和ALD-2具有明显抑菌活性
对合成后的厚壳贻贝ALD-1和ALD-2分子进行氧化复性;复性后的ALD分子经高效液相色谱脱盐及纯化, 并开展抑菌活性实验, 结果见Fig.9。由图可见, 合成的ALD-1和ALD-2在0.1 mmol/L浓度下, 对所测试的微生物均表现出抑菌活性。其中, ALD-1对S.aureus的抑制率较高, 达到70%以上。但对S.lutea,E.coli和B.megaterium抑制率较低, 仅为20%~40 %; ALD-2则对V.parahaemolyticus的抑制率较高(80%以上), 但对E.coli,S.lutea和B.megaterium的抑制率较低(小于50%)。
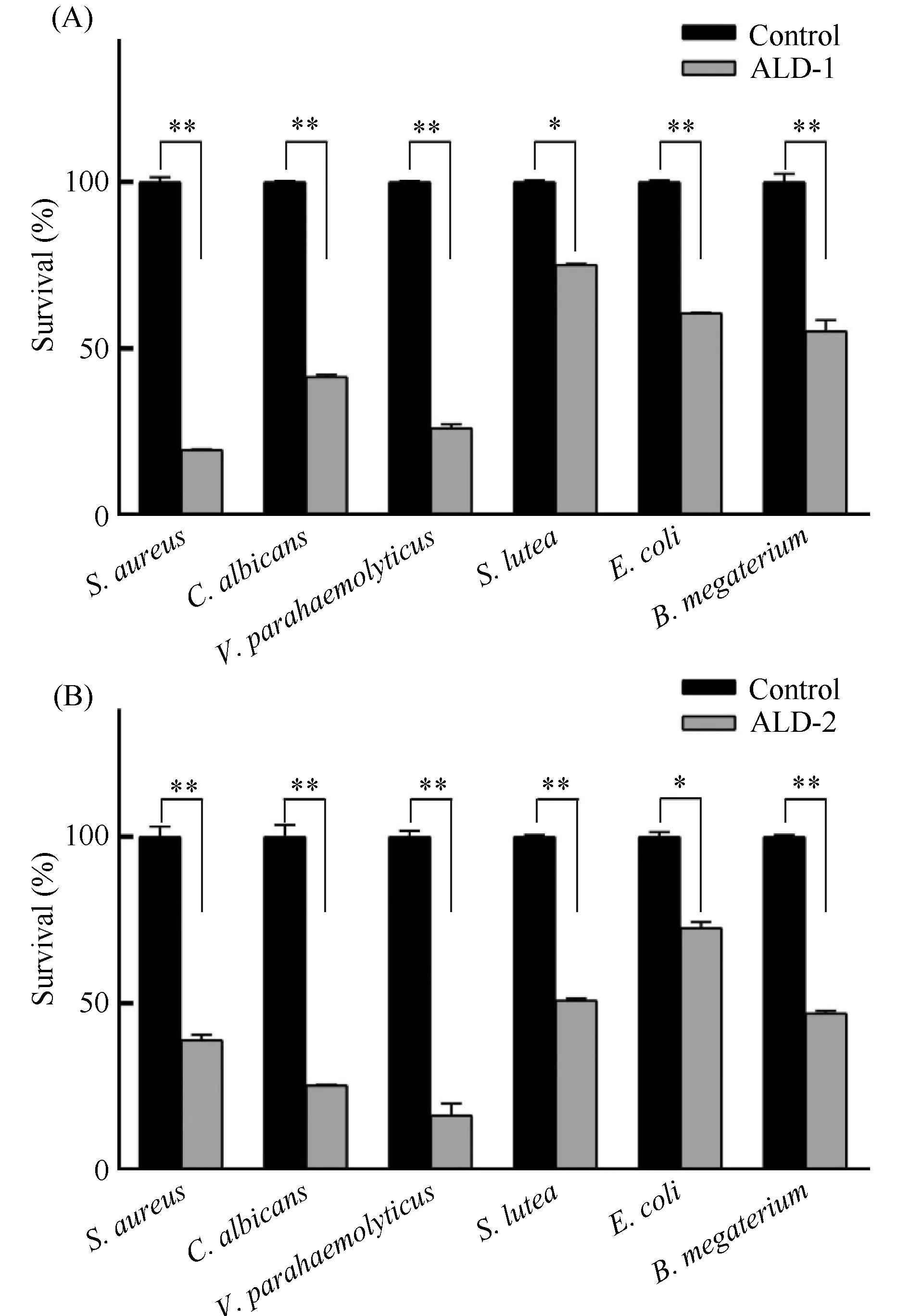
Fig.9 The antimicrobial activities of chemical synthesized and refolded ALD-1 and ALD-2 The antimicrobial activity was calculated based on the OD630 value of microbes in control and experiment group.The statistical analysis of differences was performed by SPSS(v25.0)with one-way ANOVA followed by Tukey’s multiple range test.* and** represents the significance of the difference P<0.05 and P<0.01(n=3), respectively
3 讨论
贻贝因其丰富的抗菌肽家族及表现出来的极强的抗菌肽分子多样性, 不仅赋予了贻贝具有较强的疾病耐受性, 也使得贻贝成为新型生物抗生素研发的重要来源物种。随着组学技术的进展以及厚壳贻贝基因组序列和多种组织转录组数据的公布,厚壳贻贝已成为新型抗菌肽筛选的重要物种。ALD是一类贻贝中新发现的与节肢动物防御素相似的抗菌肽分子。此前已从地中海贻贝的转录组序列中发现了ALD的序列[7], 但是对贻贝ALD的分子特性及其在贻贝免疫过程中的作用和机制尚不清楚。为此, 本文对厚壳贻贝中筛选到的2种ALD开展了表达谱、多肽合成及功能验证分析。
从厚壳贻贝ALD-1和ALD-2的序列及结构来看, 2种ALD均表现出与节肢动物防御素相似的特征, 包括半胱氨酸的分布、结构域特征以及三级结构特征等, 表明软体动物与节肢动物在抗菌肽分子起源上可能具有某种保守性。早期人们已发现, 软体动物防御素和节肢动物防御素在氨基酸序列, 二硫键配对模式, 抗菌机制以及抗菌谱等方面具有较大相似性, 但两者在前体序列架构上具有明显差异[39]。例如, 已报道的贻贝防御素MGD(Mytilusgalloprovincalisdefensin)分子前体序列中, 其成熟肽区下游存在一段成熟肽后区域, 及所谓Pro-region[40];而节肢动物防御素的后区域通常出现在信号肽与成熟肽之间[41]。厚壳贻贝ALD-1在序列中存在可预测的一段后区域, 且位于序列的信号肽和成熟肽之间, 这一点与节肢动物防御素类似;而ALD-2则无可预测的后区域(Fig.1), 表明ALD-2与节肢动物防御素在序列结构上存在差异。此外, 软体动物防御素和节肢动物防御素在基因内含子的数量和分布方面也存在差异[39]。表明软体动物与节肢动物在其物种进化过程中, 其防御素分子也在协同进化。
厚壳贻贝2种ALD分子的表达谱的结果显示, 2种ALD均在外套膜和消化腺具有较高表达量, 但在血细胞中表达量较低(Fig.5)。从以往的研究表明, 多数已报道的贻贝抗菌肽, 其主要表达部位在于血细胞[7], 因而贻贝血细胞被认为是贻贝免疫防御的主要组织[42]。但有研究表明, 部分贻贝抗菌肽的主要表达部位并非血细胞, 而是其他组织。例如, 贻贝抗菌肽big defensin和mytimacin的表达量主要出现在鳃、消化腺和外套膜[43]; 贻贝抗菌肽myticalin的最大表达部位出现在外套膜[44]; 而贻贝抗菌肽mytichitin的最大表达部位是性腺[21]。上述结果表明, 贻贝不同组织可能有其特异的抗菌肽表达谱, 以满足不同组织在应对外来入侵微生物过程中的特殊需求。厚壳贻贝ALD分子在外套膜和消化腺组织的高表达, 意味着这2种防御素可能参与了贻贝外套膜及消化腺的免疫防御。但是2种ALD在血细胞中的较低表达量并不意味着其在贻贝血细胞中不发挥免疫作用。事实上, 部分贻贝抗菌肽即使在血细胞中表达量不高, 但是在微生物刺激下, 其表达量也会出现明显上调并参与到免疫防御过程[43, 44]。
值得注意的是, ALD-1在雄性贻贝性腺中的表达量明显高于雌性贻贝性腺(Fig.5), 表明ALD-1可能具有性别表达特异性特征。这也是首次发现贻贝抗菌肽具有性别差异表达。以往的研究表明, 部分节肢动物抗菌肽分子会表现出明显的性别差异, 特别是在雄性个体中表达量较大[45-47]。ALD-1在雄性性腺中的较高表达量推测与其在贻贝生殖过程中, 对雄性配子发育以及排精过程中对于性腺的免疫保护有关。此外, ALD-1和ALD-2在贻贝幼虫的不同发育阶段均未检测到其表达。但在成年贝中, 特别是6月龄及以后的贻贝个体中出现高表达。这表明,2种ALD在厚壳贻贝中主要是负责成年个体的免疫保护。以往的研究表明, 多数贻贝抗菌肽均表现为幼虫阶段的低表达以及稚贝期后的高表达[48,49], 这表明,多数贻贝抗菌肽的表达具有明显的发育阶段特异性。其在贻贝幼虫阶段的低表达也被认为是贻贝幼虫容易感染疾病而死亡的重要因素[48]。
考虑到2种ALD分子在厚壳贻贝外套膜中的高表达量, 以及血细胞在贻贝免疫过程中的重要作用, 本文选择了外套膜和血细胞2种组织研究ALD分子在微生物刺激条件下的表达量变化。同时, 考虑到以往研究中, 贻贝对不同微生物具有不同的免疫特征, 本文分别选取了革兰氏阳性菌, 革兰氏阴性菌以及真菌作为刺激条件。从研究结果来看, 2种厚壳贻贝ALD均表现为在不同组织经过不同微生物诱导后, 具有不同的免疫反应特征(Fig.6)。首先, 本文注意到不同微生物刺激下, 2种ALD在不同组织中均出现表达量的明显上升, 表明2种ALD分子均参与了厚壳贻贝的免疫过程。但是,2种ALD在不同组织中对不同微生物表现出的敏感性以及反应时间各不相同。其中, ALD-1在外套膜中表现为对真菌和对革兰氏阴性菌的较强敏感性, 而在血细胞中表现为对革兰氏阳性菌刺激的较强敏感性(Fig.6);且ALD-1在血细胞中反应速度比在外套膜中相对更快, 其峰值出现的时间在血细胞中为2 h, 而在外套膜中表达量峰值出现的时间多为24 h(Fig.6);而对ALD-2而言, 其在外套膜中表现出对革兰氏阳性菌的较强敏感性, 在血细胞中表现为对真菌的较强敏感性(Fig.6)。上述结果充分表明, 不同的抗菌肽在贻贝组织以及不同微生物刺激下其差异化的免疫反应模式。该模式推测可能与抗菌肽具有不同的免疫识别和免疫信号传导机制有关。例如, 在节肢动物防御素研究中, 人们发现,具抗真菌活性的防御素的表达受到Toll 信号通路的调控,而其他防御素的表达则受到免疫缺陷(immune deficiency, IMD)信号通路的调控[50]。贻贝中目前已被证实存在多种与免疫相关的信号通路[51,52], 但其与贻贝抗菌肽表达之间的关联目前尚不清楚。我们推测, ALD-1和ALD-2在不同微生物刺激下, 其在不同组织中不同的表达模式可能与其表达调控的信号通路的不同有关, 但该推测还需进一步的实验证实。
本文的研究结果表明, ALD-1和ALD-2在贻贝各组织的相对表达量均较低, 意味着2种抗菌肽在贻贝体内的含量也极低。本文尝试从贻贝血清中纯化2种抗菌肽, 但均未成功。因此, 本文根据ALD的预测成熟肽序列, 采用固相多肽合成技术获得2种ALD的多肽分子, 经氧化复性后开展了其抑菌活性分析。结果表明, 2种厚壳贻贝ALD分子均表现出明显的、广谱的抑菌活性。且两者的抑菌谱类似,但ALD-1对革兰氏阳性菌S.aureus表现出相对较强的抑制率, 而ALD-2对革兰氏阴性菌V.parahaemolyticus表现出相对较强的抑制率。这表明2种ALD分子可能在免疫识别及机制方面存在差异。与以往报道的天然贻贝抗菌肽的抑菌活性相比, 2种合成后的ALD分子的抑菌活性并不强。目前多数已报道的贻贝抗菌肽在抑菌活性的浓度范围均在微摩尔级别[53], 而2种合成的ALD分子在本次研究中, 其对微生物的抑制率在毫摩尔水平下仅具有相对较弱的抑制活性, 推测与ALD合成及复性过程中其二硫键的折叠困难有关。目前, 对贻贝抗菌肽的固相化学合成策略, 其最大的困难在于贻贝抗菌肽通常含有多对二硫键, 因此合成后的抗菌肽分子的复性成功率较低, 因而导致其活性较天然的抗菌肽分子有所下降[54]。
综上所述, 对厚壳贻贝中新发现的2种新型防御素, ALD-1和ALD-2, 开展了序列分析, 表达谱分析以及功能验证。该研究初步探明了2种ALD分子在贻贝免疫防御过程中的作用, 进一步拓展了对贻贝抗菌肽分子多样性的科学认知。同时, 也为后续深入研究贻贝抗菌肽的分子机制, 以及在此基础上开发贻贝抗菌肽为来源的新型生物抗生素奠定了基础。