唾液酸免疫球蛋白型凝集素-15促进结直肠癌细胞增殖和迁移并抑制肿瘤组织中CD4+与CD8+T细胞浸润
2022-09-07成敏蓉刘杭丰高书华郑锦秀
成敏蓉, 刘杭丰, 高书华, 郑锦秀,3), 杨 涛,3)*
(1)山西医科大学基础医学院生物化学与分子生物学教研室, 太原 030001;2)山西医科大学基础医学院药理学教研室, 太原 030001;3)山西医科大学细胞生理学教育部重点实验室, 太原 030001)
唾液酸免疫球蛋白型凝集素-15(sialic acid-binding immunoglobulin-type lectin-15, Siglec-15)是唾液酸结合免疫球蛋白样凝集素家族成员,主要在巨噬细胞、树突状细胞和破骨细胞中表达,通过细胞表面受体与配体相结合而发挥不同的作用[1, 2]。早期研究表明,Siglec-15参与破骨细胞分化[3-5],且可作为骨质疏松症的潜在治疗靶标[6, 7]。近年的研究发现,Siglec-15是一种新的免疫抑制分子,主要通过抑制T细胞功能促进肿瘤发生免疫逃逸。其序列与程序性死亡配体1(Programmed cell death ligand 1,PD-L1)相似,但免疫抑制功能独立于PD-1/PD-L1,有望成为免疫治疗新靶点[8-10]。Siglec-15在肺癌、膀胱癌等多种肿瘤细胞和巨噬细胞中广泛上调[10-12]。在骨肉瘤和肝癌中,分别具有促进细胞增殖和迁移的作用[13, 14]。然而,Siglec-15在结直肠癌(colorectal cancer,CRC)中,是否异常表达及其对CRC细胞生物学功能的影响尚不明确。
肿瘤微环境中,免疫细胞浸润与肿瘤的发生发展密切相关。T淋巴细胞在介导抗肿瘤免疫中扮演重要的角色[15-17]。T淋巴细胞主要分为 CD4+T细胞亚群及CD8+T细胞亚群,其浸润水平在一定程度上反映了机体抗肿瘤反应的强度[18-20]。有研究证实,Siglec-15在肾上腺皮质癌中,与CD8+T细胞浸润成正相关,在子宫癌肉瘤中则相反[11]。而在结直肠癌中,Siglec-15与肿瘤微环境CD4+T细胞、CD8+T细胞浸润的相关性尚不清楚。
基于这些现状,本文通过CCK8、划痕愈合、ELISA以及小鼠荷瘤等实验,探究了Siglec-15异常表达对CRC细胞功能、CD8+T细胞功能及小鼠肿瘤生长的影响。同时,结合生物信息学分析与临床组织样本检测分析了Siglec-15表达与CD4+T细胞、CD8+T细胞浸润的相关性。
1 材料与方法
1.1 材料
小鼠结直肠癌细胞株MC38购自中国医学科学院基础研究所细胞库;人结直肠癌细胞株SW480购自中国科学院典型培养物保藏委员会细胞库;正常结肠上皮细胞NCM460购自山西哲源科学仪器有限公司。4~6周龄雌性C57BL/6购买自山西医科大学实验动物中心。收集山西省肿瘤医院病理科2015年1月4日至2015年12月30日存档的52例的结直肠癌及其配对癌旁正常黏膜组织的石蜡标本。本研究已通过山西医科大学伦理委员会批准,病人和家属均已签署知情同意书。
RPMI1640培养基和DMEM培养基购自Hyclone公司;L-15培养基购自Boster公司;胎牛血清(FBS)购自Moregate Biotech公司;过表达Siglec-15慢病毒及其阴性对照病毒购自吉凯基因公司;CCK8试剂盒购自Boster公司;小鼠CD8+T细胞磁珠阴选试剂盒购自STEMCELL Technologies公司;Siglec15抗体(NBP2-41162)购自Novus公司;Siglec15抗体(PA5-50759)购自Thermo fisher公司;CD4抗体(ab183685,ab133616)、CD8抗体(ab209775)均购自abcam公司;CD8抗体(70306s)购自Cell Signaling Technology公司;转染试剂LipofectamineTM2000购自Invitrogen公司;通用型试剂盒(小鼠/兔聚合物法检测系统)、二氨基联苯(DAB)显色试剂均购自北京中杉金桥生物技术公司。ELISA 试剂盒(abs520010、abs520007)购自Absin公司,细胞毒性试剂盒(G9290)购自Promega公司。
1.2 生物信息学分析
Wilcoxon秩和检验分析癌症基因组图谱(TCGA)数据库来源的568例结直肠癌与44例正常组织样本中Siglec-15表达数据;通过单样本基因集富集分析(single sample gene set enrichment analysis,ssGSEA),评估UCSC Xena数据库中CRC样本免疫细胞的浸润水平。
1.3 Western印迹检测
RIPA裂解混合液(RIPA∶PIC∶PMSF=100∶2∶1)提取总蛋白质。BCA法对蛋白质定量分析,通过SDS-PAGE分离蛋白质,并转移至PVDF膜上,室温封闭1 h,加入一抗4℃过夜孵育。次日,二抗室温孵育1 h,加入适量ECL发光液,凝胶成像仪显影。
1.4 质粒构建及转染
设计Siglec-15 shRNA引物,shSiglec-15-1上游引物:5′-GATCGTCAACATCTCGGTGCT-3′,下游引物:5′-AGCACCGAGATGTTGACGATC-3′;shSiglec-15-2上游引物:5′-GACAGGCTCATTTGTGAGAAC-3′,下游引物5′-GTTCTCACAAATGAGCCTGTC-3′。引物退火形成双链,用BamHⅠ、EcoRⅠ对载体37℃双酶切,将退火片段与载体按质量比4∶1混合,加入T4 DNA连接酶16℃过夜连接,并将连接产物转化。挑取单克隆菌落,接种于含氨苄的液体LB培养基,37℃摇菌12~14 h。收集菌液送至西安擎科生物技术有限公司测序。按照LipofectamineTM2000说明,转染SW480细胞。6 h,更换新鲜培养基,48 h后观察转染效率并加入遗传霉素(Geneticin,G418)筛选。
1.5 细胞增殖检测
取对数增殖期的细胞,按5×103个细胞/孔接种至96孔板中。每组设置3个复孔,分别培养24 h、48 h、72 h,每孔加入10 μL CCK8。1~2 h后检测450 nm处的吸光度值。
1.6 划痕愈合实验
取对数增殖期的细胞接种于6孔板中,每组设置3个复孔。待细胞完全汇合后,用200 μL枪头在孔板内行“井”字划痕,保证每孔划痕宽度一致。PBS清洗脱落细胞后,加入无血清培养基继续培养,分别于0 h、24 h和48 h时,在相同位置拍照观察划痕愈合情况,并用Image J软件进行分析。
1.7 细胞培养与病毒感染
SW480、MC38和NCM460细胞分别使用L15、RPMI1640和DMEM培养基。培养基均含100 U/mL的青霉素-链霉素混合物和10% FBS,细胞株置于37℃和5% CO2恒温培养箱中培养。待细胞密度达到80%,用0.25%胰酶消化传代。在6孔板中接种MC38细胞(8×104/孔),待细胞汇合度为20% ~ 30%时,将阴性对照慢病毒及过表达Siglec-15慢病毒按感染系数MOI=20感染MC38细胞,12 h后更换新鲜培养基。感染约72 h,观察感染效率,加入嘌呤霉素进行筛选,并分别命名为“LV-NC”和“LV-Siglec-15”。
1.8 小鼠荷瘤
将4~6周龄雌鼠随机分为2组,每组5只,每只小鼠右腿皮下接种2×106个细胞。约7 d成瘤后,每隔3 d测量肿瘤的长径与短径。按肿瘤体积=(长径×短径2)/2计算体积并绘制肿瘤体积生长曲线。28 d后处死小鼠,分离出肿瘤,测量肿瘤体积并拍摄图片。
1.9 T细胞体外杀伤实验
取荷瘤小鼠脾组织于70 μm细胞筛网上,用注射器芯轻压揉碎,PBS冲洗收集小鼠脾的悬液,按照CD8+T细胞磁珠分选试剂盒说明分选出CD8+T细胞。将CD8+T细胞、稳定过表达Siglec-15的MC38细胞株及对照细胞株以3∶1和5∶1有效靶比加入到96孔板中。共培养24 h,吸去含T细胞培养基并用PBS洗涤。每孔加入10 μL CCK-8溶液,置37℃孵育1~2 h,测定450 nm处的吸光度值[21]。
1.10 细胞毒性实验
将CD8+T细胞、稳定过表达Siglec-15的MC38细胞株及对照细胞株,以5∶1的有效效靶比加入到96孔板中,CD8+T 细胞、MC-38细胞分别作为效应细胞(effector cells,E)组和靶细胞(target cells, T)组。共培养24 h, 按照细胞毒性试剂盒说明书,测定吸光度A值。CD8+T细胞对肿瘤细胞的杀伤率计算公式:肿瘤细胞裂解率(%)= (AE+T-AE-AT)/(AEmax-AE)×100%。其中,AEmax=靶细胞全部裂解后的A值。
1.11 酶联免疫吸附测定(ELISA)
收集肿瘤细胞与T细胞共培养的细胞悬液。4℃下,12 000 r/min离心5 min。将上清液转移到一个新1.5 mL EP管中,分别使用小鼠IFN-γ、TNF-α ELISA试剂盒,测定上清液中IFN-γ与TNF-α含量。简要步骤如下:配制标准品,将标准品、实验样本加入相应孔中,每孔100 μL,封住反应孔,室温孵育2 h,洗板3次;在每个孔内加入100 μL检测抗体,室温孵育2 h,洗板3次;在每个微孔内加入100 μL稀释好的链霉亲和素-HRP,室温避光孵育20 min后洗板3次;在每个微孔内加入100 μL显色底物,室温避光孵育20 min;随后在每个孔内加入50 μL终止液,使用酶标仪测量450 nm的吸光度值,设定540 nm或570 nm作为校正波长。
1.12 IHC染色
二甲苯脱蜡,经各级浓度乙醇水化,置于枸橼酸钠抗原修复液中,高压抗原修复15 min后晾至室温,阻断内源性过氧化物酶,5% BSA室温封闭30 min,一抗37℃孵育1 h,PBS振荡清洗后加二抗,DAB适度显色,苏木素复染30 s ~ 4 min,盐酸乙醇溶液分化、脱水、透明和中性树脂封片。以“染色阳性率评分(0分,阴性;1分,<25%;2分,25%-50%;3分,>50%)”以及“染色强度评分(0分,阴性;1分,弱阳;2分,中阳;3分,强阳)”乘积为总评分[22]进行分组。根据评分中位值,分为高表达组和低表达组。所有的IHC染色结果均由两位病理医师经双盲法独立评分。
1.13 统计学方法
所有图表使用GraphPad Prism 8制作,t检验用于计算两组之间的差异。所有数据以mean ±SD表示,P<0.05为差异有统计学意义。
2 结果
2.1 唾液酸免疫球蛋白型凝集素-15在结直肠癌组织中的高表达
分析TCGA数据库中结直肠癌与正常组织中Siglec-15 mRNA表达水平。结果显示,Siglec-15 mRNA在癌组织中表达水平明显高于正常组织(0.742 ± 1.823vs0.151 ± 0.293,P<0.01,Fig.1A)。为进一步明确Siglec-15在结直肠癌组织中的表达情况,IHC检测52对结直肠癌组织和癌旁组织中Siglec-15的表达,Siglec-15在结直肠癌组织中的免疫评分为5.221 ± 1.751,在癌旁组织中的免疫评分为2.212 ± 0.982。其结果与TCGA数据分析结果一致。Sigec-15在结直肠癌组织中的表达明显上调(P<0.01,Fig.1B)。
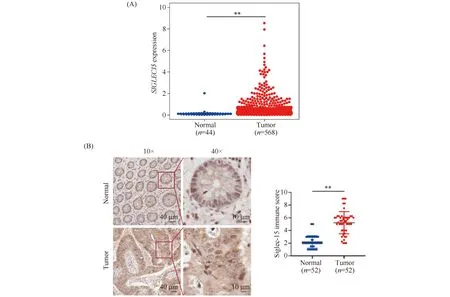
Fig.1 Siglec-15 is highly expressed in CRC tissues (A) Expression of Siglec-15 in CRC tumors (n=568) and normal tissues (n=44) obtained from the TCGA database.(B) Representative results of Siglec-15 IHC in CRC tissues (n=52) and paired adjacent tissues (n=52).** P<0.01
2.2 敲减唾液酸免疫球蛋白型凝集素-15抑制人结直肠癌细胞SW480的增殖和迁移
首先,研究了Siglec-15对CRC细胞生物学功能的影响。与正常结直肠上皮细胞NCM460相比,人结直肠癌细胞SW480中Siglec-15的蛋白质水平较高(Fig.2A)。稳定敲减Siglec-15的细胞株SW480(Fig.2B)。CCK8结果显示,敲减Siglec-15可抑制SW480细胞的增殖。其中,在72 h时,对照组A450值为1.266 ± 0.147,敲减Siglec-15组A450值为0.635 ± 0.095(P<0.01,Fig.2C)。划痕结果表明,敲减Siglec-15在48 h时可抑制SW480细胞的迁移。对照组和敲减Siglec-15组48 h迁移率分别为42.860% ± 7.208%和20.470% ± 5.135%(P<0.05,Fig.2D)。
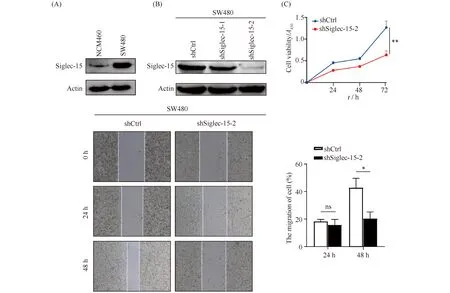
Fig.2 Knockdown of Siglec-15 inhibits the proliferation and migration of human colon cancer cell SW480 (A) Western blot showed Siglec-15 expression in NCM460 and SW480 cells. (B) Western blot was used to detect Siglec-15 knockdown efficiency in SW480 cells. (C) CCK8 assay showed that knockdown of Siglec-15 could inhibit the proliferation of SW480 cells. The data are presented as mean ± SD of three experiments. (D) Wound healing assay showed that Siglec-15 knockdown inhibited the migration of SW480 cells at 48 hours. The data are presented as mean ± SD of three experiments.*P<0.05, **P<0.01
2.3 过表达唾液酸免疫球蛋白型凝集素-15抑制CD8+T细胞的体外杀伤
本文探究了Siglec-15对CD8+T细胞介导的体外杀伤作用的影响。Western印迹检测MC38细胞中Siglec-15过表达效率(Fig.3A)。分选荷瘤小鼠脾脏CD8+T细胞与MC38细胞共培养,CCK8检测MC38细胞对CD8+T细胞杀伤的敏感性。结果显示,以3∶1或5∶1效靶比共培养24 h时,过表达Siglec-15组中的MC38细胞的存活率高于对照组。其中,效靶比3∶1时,对照组和过表达Siglec-15组存活率分别为26.630% ± 3.800%和68.530% ± 1.966%(P<0.01)。效靶比5∶1时,对照组和过表达Siglec-15组存活率分别为29.600%± 7.532%和81.270% ± 19.360%(P<0.05,Fig.3B)。进一步通过细胞毒性实验检测Siglec-15对CD8+T细胞介导的体外杀伤作用。发现以效靶比5∶1共培养24 h时,对照组肿瘤细胞裂解率(44.530% ± 5.008%)高于过表达Siglec-15组肿瘤细胞裂解率(18.400% ± 2.800%)(P<0.01,Fig.3C)。ELISA检测共培养上清液中的IFN-γ和TNF-α。结果显示,过表达Siglec-15组分泌的IFN-γ和TNF-α含量较对照组分别下降了81.650 ± 10.630 pg/mL和206.300 ± 29.500 pg/mL(P<0.01,Fig.3D)。综上所述,Siglec-15可能通过促进CRC细胞增殖、迁移和抑制CD8+T细胞功能影响结直肠癌的进展。

Fig.3 Overexpression of Siglec-15 inhibits the effect of CD8+ T cells in vitro (A) The overexpression of Siglec-15 in MC38 cells was analyzed by Western blot. (B) CCK8 assay was used to detect the killing effect of CD8+ T cells on tumor cells. (C) Cytotoxicity assay was used to detect the killing effect of CD8+ T cells on tumor cells. (D) Co-culture supernatants were subjected to ELISA to measure IFN-γ and TNF-α. Data (B-D) are presented as mean ± SD of three experiments. *P<0.05,**P<0.01
2.4 过表达唾液酸免疫球蛋白型凝集素-15促进小鼠肿瘤生长
本文进一步将稳定过表达Siglec-15的MC38细胞及其对照细胞接种于C57BL/6雌鼠右腿皮下,在动物水平上研究Siglec-15对CRC肿瘤生长的影响。体内实验表明,与对照组相比,Siglec-15过表达组肿瘤生长速度快,体积较大(P<0.05),对照组中有1只小鼠肿瘤完全消退(Fig.4A,B)。Western印迹结果显示,荷瘤小鼠肿瘤组织中过表达组Siglec-15蛋白水平高(Fig.4C)。IHC分析2组肿瘤组织中Siglec-15的表达以及CD4+T细胞、CD8+T细胞的浸润。结果正如Fig.4D所示,对照组和Siglec-15过表达组,肿瘤组织中高倍镜(× 400)5个随机视野下CD4+T平均阳性细胞数分别为43.670 ± 4.163和11.670 ± 3.512(P<0.01),CD8+T阳性细胞数分别为53.000 ± 7.937和12.670 ± 3.512(P<0.01)。
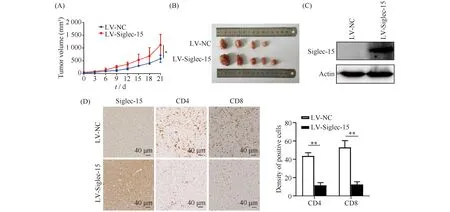
Fig.4 Overexpression of Siglec-15 promotes tumor growth in mice (A) Tumor growth curve in control and Siglec-15 overexpression group. (B) Images of subcutaneous tumors in mice. (C) Western blot was used to detect Siglec-15 level in tumor tissues. (D) IHC staining of CD4+ T cells and CD8+ T cells. The data represented mean ±SD (n=3).*P<0.05, ** P<0.01
2.5 唾液酸免疫球蛋白型凝集素-15异常表达抑制人结直肠癌组织中CD4+T细胞、CD8+T细胞的浸润
ssGSEA结果显示,Siglec-15高表达组中,CD4+T细胞浸润减少(P<0.01),CD8+T细胞浸润也有所减少,但无统计学意义(Fig.5A)。为进一步验证生物信息学分析的结果,利用IHC对52例人结直肠癌组织进行检测,根据免疫评分的中位值分为Siglec-15低表达组和Siglec-15高表达组。在Siglec15低表达组和Siglec15高表达组中,CD4免疫评分分别为4.983 ± 1.726和3.851 ± 1.494,CD8免疫评分分别为2.800 ± 1.727和1.966 ± 0.972,表明Siglec15高表达组中CD4+T细胞、CD8+T细胞浸润明显减少(P<0.05,Fig.5B)。
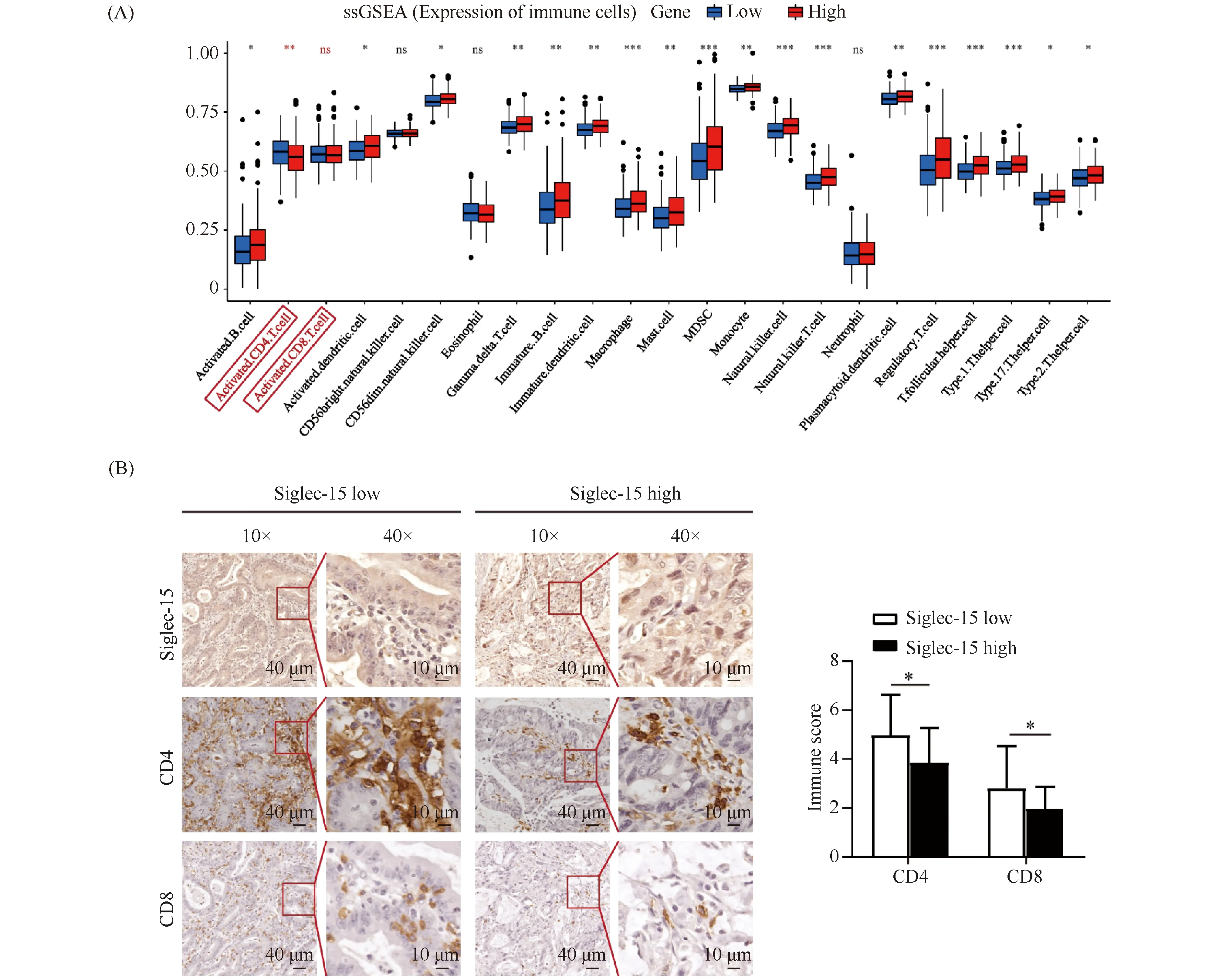
Fig.5 Aberrant expression of Siglec-15 inhibits infiltration of CD4+ T cells and CD8+ T cells in human CRC tissues (A) ssGSEA was used to analyze the infiltration level of 23 immune cells in Siglec-15 high and low expression group.(B) IHC staining of Siglec-15 and Immune scores of CD4+ T and CD8+ T cells in 52 cases of CRC, the data represented mean ± SD (n=52), compared with the Siglec15 low expression group. *P<0.05, ** P<0.01
3 讨论
针对免疫检查点开展的肿瘤免疫治疗是近年来的研究热点。Wang等[8]研究表明,Siglec-15有可能是一个补充治疗靶点,可以为anti-PD-1/PD-L1 治疗无响应的患者提供新的治疗选择。Li等[11]通过生物信息学分析发现,CRC中Siglec-15的表达高于正常组织,但未在临床组织中进一步验证。本研究除了分析TCGA数据库中结直肠癌与正常组织中Siglec-15的mRNA表达水平以外,还对52例CRC患者癌组织及癌旁组织中Siglec-15表达进行检测,发现Siglec-15在癌组织中高表达。此外,敲减Siglec-15能抑制人结直肠癌细胞SW480的增殖和迁移,这表明Siglec-15可能有促进CRC发生发展的作用。根据文献报道,在骨肉瘤细胞中,Siglec-15过表达能通过诱导上皮间质转化促进骨肉瘤细胞增殖、迁移和侵袭[13];在肝癌中,Siglec-15 可通过调节 CD44 蛋白的稳定性促进肝癌细胞迁移[14];Siglec-15与肿瘤相关唾液酸-Tn抗原之间相互作用,通过DAP12-Syk途径增强巨噬细胞TGF-β分泌,进而促进肿瘤发生发展[23]。以上研究表明,Siglec-15可能与多数肿瘤的恶性进展相关。
作为新型的免疫抑制分子,巨噬细胞来源的Siglec-15可抑制人和小鼠T细胞的增殖和活性,并抑制IFN-γ和TNF-α的分泌。Siglec-15抗体阻断可提高抗肿瘤免疫力,阻碍小鼠肿瘤生长[8]。本研究进一步在小鼠结直肠癌细胞MC38中探究了Siglec-15对CD8+T细胞杀伤效应的影响,发现在MC38细胞中过表达Siglec-15可抑制CD8+T细胞对CRC细胞的杀伤以及IFN-γ和TNF-α的分泌。综上,本文的结果表明,Siglec-15可能通过促进CRC细胞增殖以及抑制CD8+T细胞功能从而影响结直肠癌的进展。
肿瘤微环境中免疫细胞浸润与肿瘤进展密切相关。其中,CD4+T淋巴细胞可以表现出抗肿瘤或促肿瘤活性,CD8+T细胞浸润与抗PD-1反应和患者预后密切相关[24-27]。在膀胱癌中,生物信息学分析及63 例膀胱癌标本免疫组化结果均显示,Siglec15与肿瘤微环境中CD8+T 细胞、NK 细胞、Th1 细胞、巨噬细胞和树突细胞的浸润水平呈负相关[28];而在非小细胞肺癌中,Siglec-15表达与基质中的 CD8+T 细胞密度呈正相关[29]。将B16-GMCSF肿瘤细胞移植到Siglec-15敲除小鼠,浸润的CD8+T细胞和NK细胞明显增多,CD8+T细胞的IFN-γ等细胞因子的产生也明显增多[8]。然而,Siglec-15与CRC肿瘤免疫微环境中,CD4+T细胞、CD8+T细胞浸润之间的关系并不明确。本研究表明,在动物水平上,过表达Siglec-15可促进荷瘤小鼠肿瘤生长,并抑制CD4+T细胞、CD8+T细胞的浸润;生物信息学分析显示,与Siglec-15低表达组相比,Siglec-15高表达组中CD4+T细胞浸润减少,CD8+T细胞浸润减少但无统计学意义;而在人CRC组织标本中,Siglec-15高表达组中CD4+T细胞、CD8+T细胞浸润减少且均有统计学意义,这表明Siglec-15可能通过抑制免疫细胞浸润促进结直肠癌进展。
综上所述,本研究表明,Siglec-15在CRC中异常表达,其可能通过促进细胞增殖迁移、抑制CD8+T细胞功能以及抑制CD4+T细胞、CD8+T细胞浸润等多方面因素影响结直肠癌进展。然而,关于Siglec-15在CRC中异常表达的分子机制尚不清楚,Siglec-15与其他免疫检查点联合研究也仍需进一步探讨。
