黄芩苷通过苦味受体促进哮喘小鼠呼吸道炎性细胞凋亡
2022-09-07郭雪冬仪慧兰
郭雪冬, 仪慧兰
(山西大学生命科学学院生物科学系, 太原 030006)
支气管哮喘(简称哮喘)是一种由多种炎性细胞参与的气道慢性反应性炎症,以炎性细胞(嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞等)浸润为主要病理特征[1-3]。炎性细胞的凋亡异常增加了哮喘的炎症强度及持续时间。因此,对炎性细胞凋亡的调控在哮喘气道炎症的缓解中具有重要意义[2,3]。
细胞凋亡受细胞自身基因的调控。凋亡抑制基因对抑制细胞凋亡发挥作用,促凋亡基因对细胞凋亡发生有促进作用。其中,Bcl2和Bax被认为是抑制和促进细胞凋亡的最重要的调控基因。Bcl2主要通过阻断细胞凋亡的信号通路,抑制细胞凋亡过程,而Bax的表达能够促进细胞凋亡[4]。研究发现,哮喘患者支气管活检标本中,Bcl2 mRNA表达升高,嗜酸性粒细胞、巨噬细胞和淋巴细胞等炎性细胞凋亡数量明显减少[5]。糖皮质激素作为哮喘病临床控制药物,可抑制肺组织中炎性细胞浸润,促进嗜酸性粒细胞凋亡,使患者哮喘症状缓解、肺功能改善[1,3]。但长期使用糖皮质激素会导致多种不良反应,例如引起感染扩散、血钾降低和骨质疏松等[2,3]。因此,寻找和发现新的哮喘治疗和干预药物是多年来药学研究需要破解的难题。
中草药在治疗哮喘方面效果独到,不良反应小。研究发现,穿山龙、淫羊藿苷和麻荆止咳颗粒等中草药成分和制剂可通过调节哮喘鼠肺内Bcl2和Bax的转录和翻译水平,促进肺组织中炎性细胞凋亡,减少炎性细胞浸润,减轻气道炎症,从而发挥平喘作用[2,3,6]。前期研究表明,实验小鼠哮喘发生与其呼吸道苦味受体(bitter taste receptors,Tas2rs)及苦味信号转导分子的转录抑制有关[7];而柠檬苦素可使PM 2.5致慢性气道炎症大鼠气管和肺组织中Tas2r14的表达增加,抑制TNF-α和IL-13产生和释放[8]。这些结果提示,中草药含有的苦味物质可能在哮喘治疗和干预中发挥了作用。选择适合的苦味剂激活呼吸道苦味信号转导通路,可能对哮喘病的预防和治疗有积极的作用[7]。
苦味化合物黄芩苷(baicalin,BA)是中药材黄芩的主要活性成分,具有抗炎、抗氧化、抗肿瘤和抗过敏等多种药理活性[9-11]。近期研究表明,黄芩苷具有一定的抗哮喘作用,可通过降低转化生长因子-β1、IL-13和血管内皮生长因子的表达,抑制卵清蛋白(ovalbumin,OVA)诱导的哮喘小鼠气道重塑[12];能通过苦味信号通路调节细胞内钙离子通道,舒张哮喘豚鼠支气管平滑肌[13];还能通过调节Th1/Th2平衡减轻OVA致敏性哮喘小鼠的气道炎症和气道高反应性[11]。但黄芩苷缓解哮喘的机制尚不清楚,是否与呼吸道炎性细胞凋亡及苦味信号转导有关未见报道。
为进一步探讨黄芩苷的平喘机制,本研究以哮喘炎症反应的炎性细胞为切入点,探讨黄芩苷对呼吸道中炎性细胞凋亡的影响及其与苦味信号转导的关系。
1 材料与方法
1.1 材料
氯化钠、氢氧化铝、磷酸氢二钠、磷酸二氢钾、无水乙醇、磺基水杨酸、甲醇、伊红、甲醛、二甲苯、苏木精,均为国产分析纯试剂;黄芩苷(BA)购自索莱宝生物科技有限公司;卵清蛋白(OVA,gradeV)购自美国Sigma公司;戊巴比妥钠购自上海倍卓生物科技有限公司;胱天蛋白酶3(caspase3)活性检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司;Trizol和逆转录试剂购自TaKaRa公司;实时荧光定量 PCR试剂盒购于上海生工生物工程有限公司。

Table 1 Primer sequences used in real-time RT-PCR
1.2 实验动物分组与处理
选5周龄SPF级雄性BALB/c小鼠,购自北京维通利华实验动物技术有限公司(许可证号: SCXK (京) 2016-0006),饲养于无特定病原菌的环境中(温度:23±1℃,相对湿度:55%±10%,光照12 h/黑暗12 h),自由饮用蒸馏水,喂食全价营养大颗粒饲料。适应性喂养1周后,按体重将小鼠随机分为3组(每组6只):对照(CK)组、OVA组和OVA + BA组。将动物分组日记为第0 d。于第0 d和第7 d,OVA组和OVA+BA组,每只小鼠腹腔注射含100 μg OVA和 2 mg 氢氧化铝的抗原液200 μL;CK组小鼠腹腔注射200 μL无菌生理盐水。第14 d至第20 d,OVA组和OVA+BA组小鼠吸入1% OVA进行雾化激发,每d,0.5 h,连续7 d。OVA + BA组小鼠在OVA雾化前按40 mg/kg/d的剂量进行BA灌胃。
1.3 支气管肺泡灌洗及炎性细胞计数
小鼠麻醉后打开胸腔结扎右肺,随后暴露颈部气管插管固定,无菌生理盐水灌洗左侧肺叶3次,每次1 mL。取10 μL收集的肺泡灌洗液(bronchoalveolar lavage fluid,BALF),进行白细胞计数。其余BALF 于1 500 r/min低温离心10 min,沉淀用100 μL生理盐水重悬,取20 μL涂片,干燥后用Wright-Gimesa染液染色,显微镜下计数不同类型炎性细胞数目。取右肺中叶,固定于4% 的中性甲醛中,右肺其余组织及气管经液氮冷冻后-80℃保存备用。
1.4 组织切片的制备与观察
取中性甲醛固定的肺组织,经梯度酒精脱水、二甲苯透明,石蜡包埋并切片(4~5 μm)。苏木素-伊红(HE)染色后封片,光学显微镜(Olympus,日本)观察,DP72数码成像系统采集图像。
1.5 胱天蛋白酶3活性检测
取冻存的小鼠肺组织,按照胱天蛋白酶3活性检测试剂盒(武汉伊莱瑞特生物科技股份有限公司)说明书对胱天蛋白酶3活性进行测定。
1.6 总RNA提取及实时荧光定量RT-PCR
取冻存的肺和气管组织用Trizol法提取总RNA,采用TaKaRa反转录试剂盒合成cDNA。以cDNA为模板,选正常小鼠呼吸道中表达量相对较高的4个Tas2rs(Tas2r108、Tas2r126、Tas2r135和Tas2r143)、苦味信号转导分子味导素 α 亚基(α-gusducin,α-gust)和瞬时电位阳离子通道M5(transient receptor potential cation channel subfamily M member 5,Trpm5)[7]、黏蛋白Muc5ac基因,以及凋亡相关基因P53、Bax、Bcl2和Casp3,设计合成相应引物,用CFX96TM Real-Time PCR Detection System(Bio Rad)进行基因扩增。以β-肌动蛋白(β-actin)为内参,采用2-ΔΔCt法[14]计算靶基因的相对表达量。
1.7 数据统计方法
实验结果表示为平均值±标准误(SE),采用IBM SPSS 25.0软件进行统计学分析。采用单因素方差分析(one-way ANOVA),检验各组间差异显著性。用不同字母表示组间差异具有统计学意义(P<0.05)。
2 结果
2.1 卵清蛋白诱发实验小鼠哮喘
在模型建立的过程中,随着OVA雾化激发次数增多,OVA组小鼠出现烦躁不安、呼吸急促、抓耳挠背、弓背直立、竖毛、前肢缩抬、二便失禁等哮喘急性发作症状。与OVA组相比,OVA+BA组小鼠哮喘急性发作症状减轻。CK组小鼠在蒸馏水雾化吸入中未见明显异常。此外,小鼠的体重(Fig.1A)、肺脏重量(Fig.1B)及肺脏脏器系数(Fig.1C)在各处理组小鼠间无显著差异。说明OVA诱导小鼠哮喘及黄芩苷干预未对小鼠体重、肺脏重量及肺脏脏器系数产生明显影响。
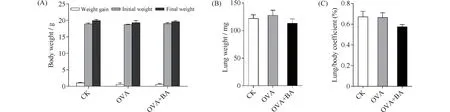
Fig.1 Body weight (A), lung weight (B) and lung/body coefficient (C) of mice CK, control; OVA,asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. Data were expressed as mean ± SE (n = 6)
2.2 黄芩苷缓解哮喘小鼠呼吸道炎症反应
镜检发现,CK组BALF中主要为巨噬细胞和淋巴细胞,嗜酸性粒细胞和中性粒细胞甚少;与CK组相比,OVA组白细胞总数及分类细胞数(嗜酸性粒细胞数、中性粒细胞数、淋巴细胞和巨噬细胞)均显著增高(P<0.05),分别为CK组的25.71倍、106.71倍、83.83倍、7.84倍和11.66倍;OVA+BA组白细胞总数、嗜酸性粒细胞和中性粒细胞数均显著低于OVA组(P<0.05),分别为OVA组的71%、55%和55%。结果表明,OVA诱发了小鼠肺部过敏性炎症反应,黄芩苷干预能缓解OVA诱发的炎症反应。
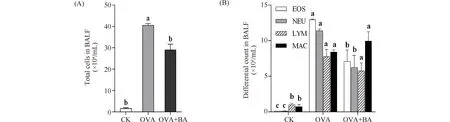
Fig.2 The number of total cells (A) and differential cells (B) in mouse bronchoalveolar lavage fluid (BALF) CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. EOS, eosinophils; NEU, neutrophils; LYM, lymphocytes; MAC, macrophages. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0.05
2.3 黄芩苷缓解哮喘小鼠肺组织损伤并下调Muc5ac表达
显微镜观察发现,CK组小鼠肺组织结构清楚,肺泡间隔正常,气道上皮完整,上皮细胞排列整齐;OVA组肺泡腔明显狭窄,肺泡间隔增厚,支气管周围可见大量炎性细胞浸润,支气管基底膜增厚;OVA+BA组小鼠肺组织病变程度比OVA组明显减轻,虽然与CK组相比存在肺泡腔狭窄、支气管基底膜增厚现象,但支气管周围炎性细胞数量明显减少(Fig.3A)。与此同时,小鼠肺组织中Muc5ac的mRNA水平在OVA组显著增高,其表达量约为CK组的53倍(P<0.05),OVA+BA组显著低于OVA组,仅为OVA组Muc5ac表达量的1/3(P<0.05)(Fig.3B),与肺组织病理学观察结果一致。

Fig.3 Effect of baicalin on asthmatic mouse lung tissue structure and the mRNA expression of Muc5ac in mouse lungs CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice.(A) Representative histopathological images of mice lungs with HE staining. Scale bar is 50 μm. Blue arrows indicated thickened subepithelial cell layers, yellow arrows indicated diminished alveolar spaces and black arrows indicated inflammatory cells infiltration. (B) Relative level of Muc5ac expression in mice lungs. β-Actin was used as an internal control. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0.05
上述肺部组织的形态结构和Muc5ac表达的改变说明,腹腔注射致敏加雾化吸入OVA诱发了实验小鼠的哮喘性疾病,黄芩苷干预能够降低哮喘小鼠的炎症水平,改善肺功能,减轻肺损伤。
2.4 黄芩苷减轻哮喘对小鼠呼吸道Tas2rs及其信号转导的抑制作用
依据前期检测正常小鼠肺组织中Tas2rs的结果,选择表达量较高的4个Tas2rs基因及其下游信号转导分子,检测其在哮喘模型和干预组小鼠呼吸道组织中的转录水平。结果发现,小鼠气管组织中所检4个Tas2rs基因Tas2r108、Tas2r126、Tas2r135和Tas2r143及苦味信号转导分子α-gust和Trpm5的mRNA水平在OVA组均显著降低,分别为CK组的10%、42%、16%、42%、29%和9%(P<0.05),在OVA+BA组均显著升高,分别为OVA组的7.89倍、1.70倍、3.12倍、1.90倍、1.89倍和6.99倍(P<0.05)(Fig.4);小鼠肺组织中,OVA组Tas2r108、Tas2r135、α-gust和Trpm5的mRNA水平显著降低,分别为CK组的50%、53%、71%和36%(P<0.05);OVA+BA组Tas2r108、α-gust和Trpm5的mRNA水平显著升高,分别为OVA组的1.32倍、1.22倍和2.17倍(P<0.05);与OVA组相比,OVA+BA组Tas2r135的mRNA表达量有所升高,但无明显差异;Tas2r126和Tas2r143的mRNA表达量在各组小鼠肺组织中无显著差异(Fig.5)。结果表明,苦味受体及其下游信号转导分子在OVA组呼吸道组织中转录抑制,即苦味信号转导通路在哮喘鼠呼吸道中被抑制;其中部分Tas2rs和α-gust、Trpm5可被黄芩苷激活表达,说明黄芩苷可能发挥苦味受体激动剂的作用,黄芩苷干预组哮喘症状减轻则表明,通过黄芩苷激活苦味信号转导通路可对哮喘病治疗发挥作用。
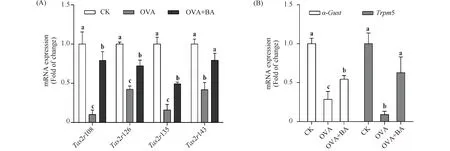
Fig.4 Relative mRNA expression of Tas2rs (A), α-gust and Trpm5 (B) in mouse trachea CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. β-Actin was used as an internal control. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0.05
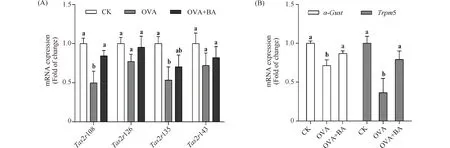
Fig.5 Relative mRNA expression of Tas2rs (A), α-gust and Trpm5 (B) in mouse lung CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. β-Actin was used as an internal control. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0.05
2.5 黄芩苷激活哮喘小鼠呼吸道凋亡通路
小鼠气管组织中(Fig.6),OVA组凋亡抑制基因Bcl2表达水平显著上升,为CK组的146%(P<0.05),促凋亡基因P53、Bax及Casp3的表达水平显著降低,分别为CK组的26%、20%和30%(P<0.05);OVA+BA组Bcl2表达水平显著下降,为OVA组的81%(P<0.05),而P53、Bax及Casp3的mRNA水平显著升高,分别为OVA组的2.91倍、3.97倍和2.42倍(P<0.05)。小鼠肺组织中(Fig.7),OVA组上述基因表达趋势与气管组织一致;与OVA组相比,OVA+BA组中Bcl2转录下调、P53 转录上调,但均无统计学差异,而Bax和Casp3 的表达水平显著升高,分别为OVA组的1.60倍和1.20倍(P<0.05),Bax/Bcl2比值显著升高,为OVA组的1.38倍(P<0.05)。结果表明,线粒体凋亡通路关键基因在OVA组小鼠呼吸道组织中转录抑制,哮喘气道炎症与细胞凋亡通路抑制同时发生;黄芩苷干预组促凋亡基因表达增强,凋亡抑制基因转录抑制,线粒体凋亡通路呈激活状态。该结果提示,OVA 组小鼠肺组织中炎性细胞浸润、OVA+BA组小鼠肺组织中炎性细胞减少可能与细胞凋亡通路的抑制和激活有关。
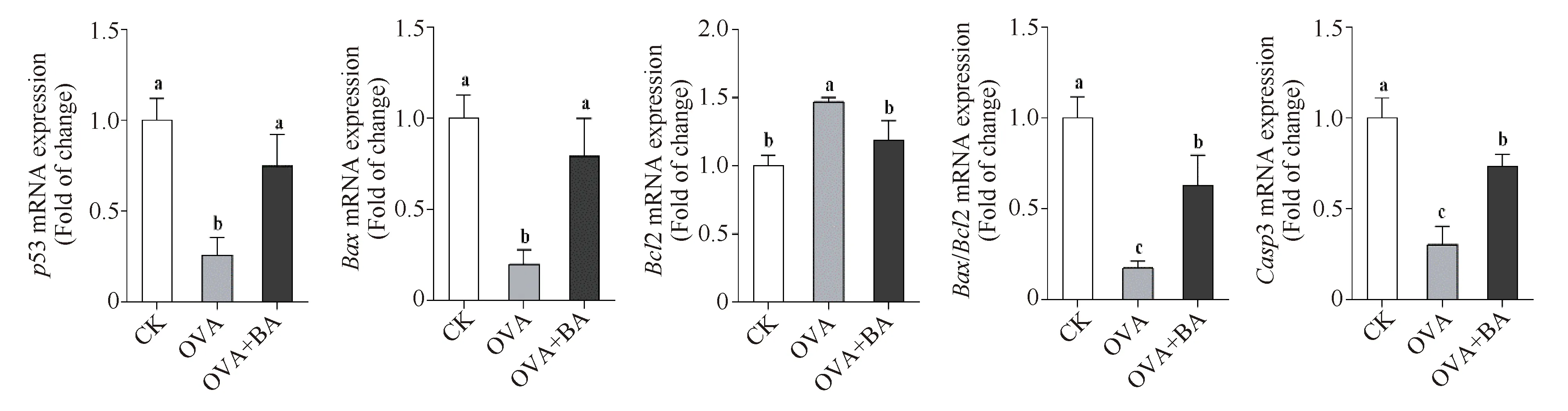
Fig.6 Effect of baicalin on mRNA expression of apoptosis-related genes in mouse trachea CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. β-Actin was used as an internal control. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0.05
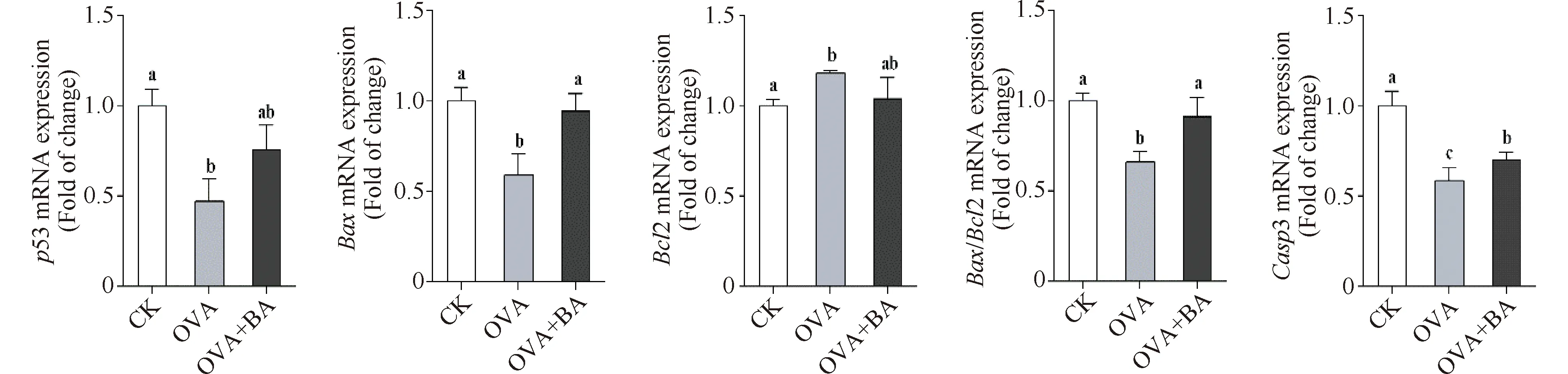
Fig.7 Effect of baicalin on mRNA expression of apoptosis-related genes in mouse lung CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. β-Actin was used as an internal control. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0. 05
胱天蛋白酶3是细胞凋亡途径的关键蛋白酶,在细胞凋亡中发挥不可替代的作用。研究发现,OVA组小鼠胱天蛋白酶3的活化程度显著低于CK组(P<0.05),为CK组的56%,而OVA+BA组胱天蛋白酶3的活化程度显著高于OVA组(P<0.05),为OVA组的2.9倍(Fig.8)。
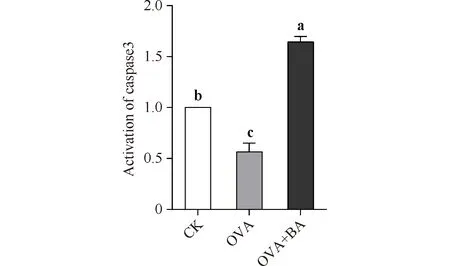
Fig.8 The caspase3 activity in mouse lungs CK, control; OVA, asthmatic mice elicited by ovalbumin; OVA+BA, baicalin intervention in OVA-induced asthmatic mice. Data were expressed as mean ± SE (n = 6). Columns labeled with different letters indicate a significant difference at P<0. 05
3 讨论
本文用腹腔注射致敏加雾化吸入OVA建立了小鼠哮喘模型。哮喘小鼠出现躁动不安、打喷嚏和呼吸急促等反应,肺部炎性细胞浸润,黏液高分泌,与前人报道的OVA致敏鼠哮喘的症状类似,说明本文所建立的小鼠哮喘模型具有较好的代表性[7,11,15]。OVA+BA组小鼠肺部炎性细胞浸润及黏液分泌程度较OVA组明显减轻,说明黄芩苷干预可以减轻小鼠哮喘。与此同时,呼吸道苦味信号转导通路和线粒体凋亡途径基因在哮喘鼠中被抑制,受黄芩苷干预而激活。因此,黄芩苷干预可能激活了哮喘鼠呼吸道苦味信号转导通路,促进了肺部炎性细胞凋亡、黏液分泌减少,从而减轻肺部炎症和损伤,缓解哮喘发作。
气道黏液高分泌是哮喘的重要病理特征,可引起气道阻塞,增加支气管哮喘的病死率[16]。MUC5AC是气道上皮杯状细胞分泌的主要黏蛋白,Muc5ac基因的上调表达是OVA致敏哮喘小鼠气道杯状细胞化生的标志[16]。前期研究发现,苦味剂桔梗皂苷能够抑制哮喘小鼠Muc5ac基因表达和蛋白质积累,降低黏液产生和分泌[17]。本研究中苦味剂黄芩苷能够抑制哮喘小鼠肺组织中Muc5ac的转录,减少黏液量。这些结果表明,苦味物质能抑制Muc5ac的转录和翻译,在此过程中Tas2rs及其下游信号转导分子发挥了重要作用。
苦味受体是一类表达于舌上皮味蕾细胞、中枢神经系统、呼吸道和生殖系统等多个部位的G蛋白偶联受体[18]。近年来大量的研究显示,苦味受体及其下游信号转导分子在呼吸道的表皮细胞、平滑肌细胞及免疫细胞中表达;在离体人气道上皮分布有苦味受体,用苦味化合物苦精刺激可引起纤毛搏动频率增加[19];苦味受体激动剂奎宁可使OVA致敏哮喘小鼠呼吸道平滑肌松弛[20],苦味受体激动剂氯喹和奎宁可减轻OVA诱导哮喘小鼠的气道炎症,抑制气道黏液的积累,降低炎症反应[15]。因此,苦味信号转导通路为哮喘的治疗提供了新的靶点。苦味受体的表达具有组织特异性,并与特定生理和病理过程有关[21,22],苦味信号转导分子α-gusducin与TRPM5共表达,参与细胞对苦味信号的转导[7,23]。本文结合实验室前期研究结果[7],筛选并检测了小鼠呼吸道中Tas2r108、Tas2r126、Tas2r135和Tas2r143及苦味信号转导分子α-gust和Trpm5的表达,发现它们在哮喘小鼠呼吸道中的转录均受到抑制,说明呼吸道中苦味信号转导通路抑制与哮喘的发生和演进有关,而黄芩苷干预组小鼠Tas2rs及其下游信号转导分子在呼吸道中转录上调,表明苦味剂黄芩苷能激活呼吸道苦味信号转导通路,并对哮喘的治疗和干预发挥作用。
哮喘组小鼠肺组织切片中有明显的炎性细胞浸润,肺泡灌洗液中的炎性细胞总数显著升高,其中嗜酸性粒细胞数和中性粒细胞数增幅较大;黄芩苷干预组肺组织中炎性细胞浸润减轻,肺泡灌洗液中的白细胞总数、嗜酸性粒细胞和中性粒细胞数均显著低于OVA组。不同组别的炎性细胞在组织切片观察与肺泡灌洗液计数中得到的结果一致,说明黄芩苷干预小鼠哮喘能够明显减轻肺部炎性细胞的浸润。近期研究认为,呼吸道炎性细胞的凋亡异常与哮喘的发生密切相关,并与细胞凋亡通路的抑制存在一定关系[2-4]。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序死亡,涉及一系列基因的激活、表达和调控。Bcl2和Bax是线粒体凋亡途径关键决定因素,Bcl2能抑制线粒体释放细胞色素C,使下游胱天蛋白酶级联反应无法激活,抑制细胞凋亡,而Bax的过度表达可拮抗Bcl2的保护效应,使细胞趋于凋亡[24]。Bax/Bcl2比值在调控细胞凋亡过程中发挥着关键作用,Bax和Bcl2表达的不平衡可能是导致细胞凋亡的重要原因[25]。P53可通过诱导Bax表达增强,抑制Bcl2转录激活,提高Bax/Bcl2比值,促进线粒体细胞色素C释放,激活下游胱天蛋白酶基因,导致细胞凋亡[24,25]。本文中哮喘鼠呼吸道组织中促凋亡基因P53、Bax和Casp3转录抑制,凋亡抑制基因Bcl2转录上调,凋亡关键蛋白酶胱天蛋白酶3活性下降,显示哮喘鼠组织中细胞凋亡通路的抑制,而黄芩苷干预组小鼠呼吸道中促凋亡基因P53、Bax和Casp3转录激活,凋亡抑制基因Bcl2表达抑制,以及胱天蛋白酶3活性的上升,表现为黄芩苷对线粒体凋亡途径的活化。相比于前人报道的哮喘鼠肺组织中Bcl2和Bax的表达改变[2,3,6],本文对细胞凋亡通路相关基因的检测结果提供了凋亡抑制与哮喘炎症相关的新证据。本文结果表明,黄芩苷可能通过激活哮喘小鼠呼吸道中的凋亡通路来促进炎性细胞凋亡,从而减少哮喘鼠肺部炎症细胞,降低炎症反应,缓解哮喘发作。
综上所述,哮喘性疾病的发生与呼吸道炎性细胞凋亡抑制、苦味受体及其下游信号转导分子转录抑制有关。苦味信号转导作为机体生理应答的必要组成与机体健康有直接关系,黄芩苷干预能够激活哮喘小鼠被抑制的苦味信号转导系统,下调凋亡抑制基因的表达、上调促凋亡基因的表达,促进小鼠呼吸道内炎性细胞的凋亡,减少肺组织中炎性细胞的浸润,从而降低哮喘小鼠呼吸道的炎症反应和黏蛋白质分泌,减轻呼吸道损伤,缓解哮喘发作。本结果为建立以苦味信号转导途径为靶标的哮喘性疾病治疗和干预的新途径提供了依据,也为开展中药苦味成分的靶向治疗研究提供了新思路。
